转录组测序分析ZNF185在食管鳞状细胞癌中的作用机制*
2022-08-15宋乃成李寿康郑志坤李劲松
宋乃成,王 磊,张 彬,李寿康,郑志坤△,李劲松△
华中科技大学同济医学院附属协和医院 1胸外科 2肿瘤科,武汉 430022
食管癌是一类较为常见的恶性肿瘤,据2020年全球癌症数据统计,其发病率在所有癌症中排名第7(60.4万例新发病例),死亡率排名第6(54.4万例死亡),这意味着在2020年每18例癌症死亡中就有1例是食管癌造成的[1]。近年来,随着胃镜的普及和手术技术的改进,食管癌的生存率有所提高,但是因食管癌有较强的转移、侵袭能力以及较高的复发率,使得食管癌的总体治疗效果不甚理想。食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是食管癌最常见的组织学亚型,其发病率和死亡率呈快速上升趋势,同时也是我国食管癌患者主要的病理类型[2]。因此,研究ESCC的发病机制及潜在的分子靶点对探索新的治疗方式及药物十分重要。
我们在前期研究中发现锌指蛋白185(zinc finger protein 185,ZNF185)在ESCC细胞中低表达,基因数据库的检索也证明了这一点[3]。而ZNF185也被报道为一种抑癌基因,与多种肿瘤的发生发展过程相关。早期的一项研究证实ZNF185基因表达的降低与前列腺癌进展高度相关[4]。也有实验发现ZNF185表达降低是肺原发肿瘤和肺癌细胞系的常见特征,说明此蛋白在肺癌发展中也起到一定作用[5]。近期的研究发现ZNF185在高级别的低分化鳞状细胞癌中显著低表达,并且参与角化细胞的分化过程[6]。但ZNF185相关的信号通路仍然需要进一步的研究。
因此,为了探究ZNF185对ESCC的作用机制,我们建立了敲低ZNF185表达的ESCC细胞系,并通过转录组测序(transcriptome sequencing,RNA-seq)检测敲低ZNF185后ESCC细胞的mRNA表达谱变化,再通过生物信息分析筛选出可能的相关信号通路,以期为ESCC发病机制研究探索新的方向和思路。
1 材料与方法
1.1 细胞培养
人食管鳞状细胞癌Eca-109细胞株购于中国科学院细胞库。Eca-109细胞用含10%胎牛血清(164210-500,武汉普诺赛生命科技有限公司)和1%青霉素/链霉素(PB180120,武汉普诺赛生命科技有限公司)的RPMI-1640(PM150110,武汉普诺赛生命科技有限公司)培养液于37℃、5% CO2恒温培养箱中培养。
1.2 分组及处理
将ESCC细胞系Eca-109分为2组进行培养:①ZNF185干扰组(Eca-109+shRNA-ZNF185),构建含ZNF185 shRNA的慢病毒转染Eca-109细胞;②干扰对照组(Eca-109+shRNA-NC),空载质粒转染Eca-109细胞。
1.3 慢病毒转染
含有pVSV-G的慢病毒颗粒与293T细胞混合培养,通过lipofectamine 2000产生不同的慢病毒颗粒。将含有慢病毒颗粒的细胞培养液收获并加入到Eca-109细胞系的培养液,48 h后更换新鲜培养液,72 h后收集细胞并采用实时定量PCR和蛋白免疫印迹Western blot鉴定转染病毒后ZNF185表达的效果。
1.4 RNA提取和转录组测序
应用试剂盒提取总RNA,评估RNA质量,由诺禾致源公司完成转录组测序。建库起始RNA为总RNA,通过Oligo(dT)磁珠富集带有多聚腺嘌呤尾的mRNA,随后在裂解缓冲液中用二价阳离子将得到的mRNA随机打断。以片段化的mRNA为模版,随机寡核苷酸为引物,在逆转录酶体系中合成cDNA第1条链,随后用RNA酶H降解RNA链,并在DNA聚合酶Ⅰ体系下,以dNTPs为原料合成cDNA第2条链。纯化后的双链cDNA经过末端修复、加腺嘌呤尾并连接测序接头,用纯化磁珠筛选370~420 bp的cDNA,进行PCR扩增并再次使用纯化磁珠纯化PCR产物,最终获得文库。由测序仪进行测序,库检合格后,把不同文库按照有效浓度及目标下机数据量的需求集中后进行测序,并产生150 bp配对末端读数。
1.5 测序数据处理及分析
测序获得的原始数据中包含少量带有测序接头或测序质量较低的reads。为了保证数据分析的质量及可靠性,需要对原始数据进行过滤。使用DESeq2软件(1.20.0)进行两个比较组之间的差异表达分析。通过clusterProfiler(3.4.4)软件实现差异表达基因的基因本体论(the Gene Ontology,GO)富集分析以及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路中差异表达基因的统计富集。
STRING数据库用于分析差异表达基因的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)。本研究使用STRING在线工具及Cytoscape(3.8.2)软件将RNA-Seq测序数据中差异表达的基因进行PPI网络分析,寻找ZNF185下游的关键靶基因。
GEPIA是基于交互网络服务器的RNA测序数据分析工具,能够从TCGA数据库及GTEx数据库中分析相关肿瘤及正常组织的表达差异情况[7]。利用GEPIA分析关键基因在ESCC及正常组织的表达差异情况,同时进行相关生存分析。
1.6 统计学方法
采用Graphpad 7.0软件对数据进行统计学分析,符合正态分布的计量资料两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 测序结果质量控制
为了保证转录组测序结果的准确性,分析前经过严格的质量控制,对原始数据进行了过滤和筛选,去除了低质量的数据信息。同时检测了测序错误率及GC碱基含量分布,数据汇总见表1。6组样品,碱基质量值大于20(Q20)和30(Q30)的碱基占总体碱基比例分别大于97%及93%,错误率在0.03%左右,表明测序结果较好。6组数据原始序列总计约有2.74×108个,最终得到的用于分析的序列有2.61×108个(95.36%)。
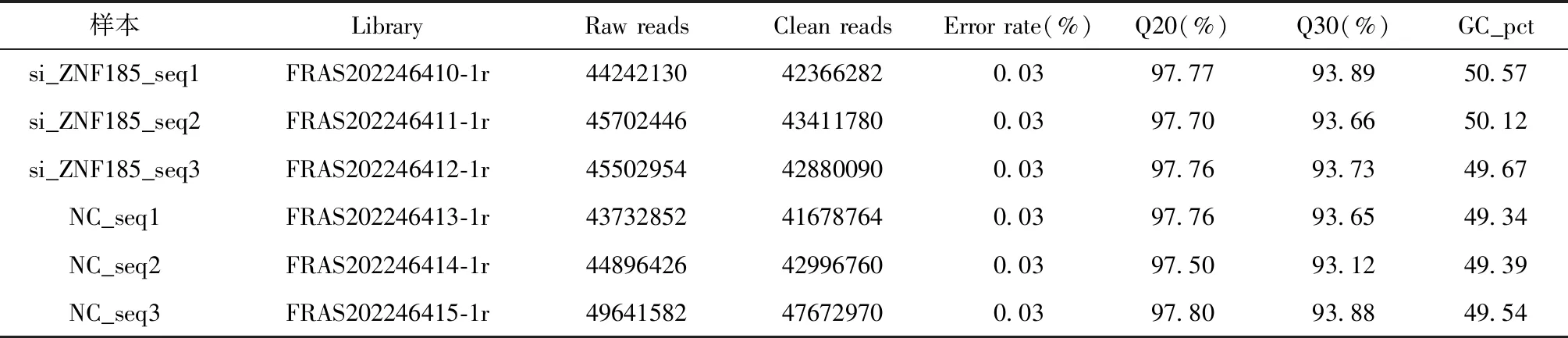
表1 测序结果及质量控制Table 1 Summary of transcriptome sequencing results and quality control
2.2 分析测序数据筛选出差异基因
为了分析ESCC细胞中ZNF185所调控的相关基因,在转录组分析中对差异表达基因进行总结。通过DEseq软件筛选出样本中表达明显差异的基因,筛选标准按照经验选择│log2(Fold Change)│>0并且P≤0.05。结果发现ZNF185干扰组与干扰对照组的差异基因共有3859个,其中表达升高的基因有2112个,表达下降的基因有1747个(图1)。
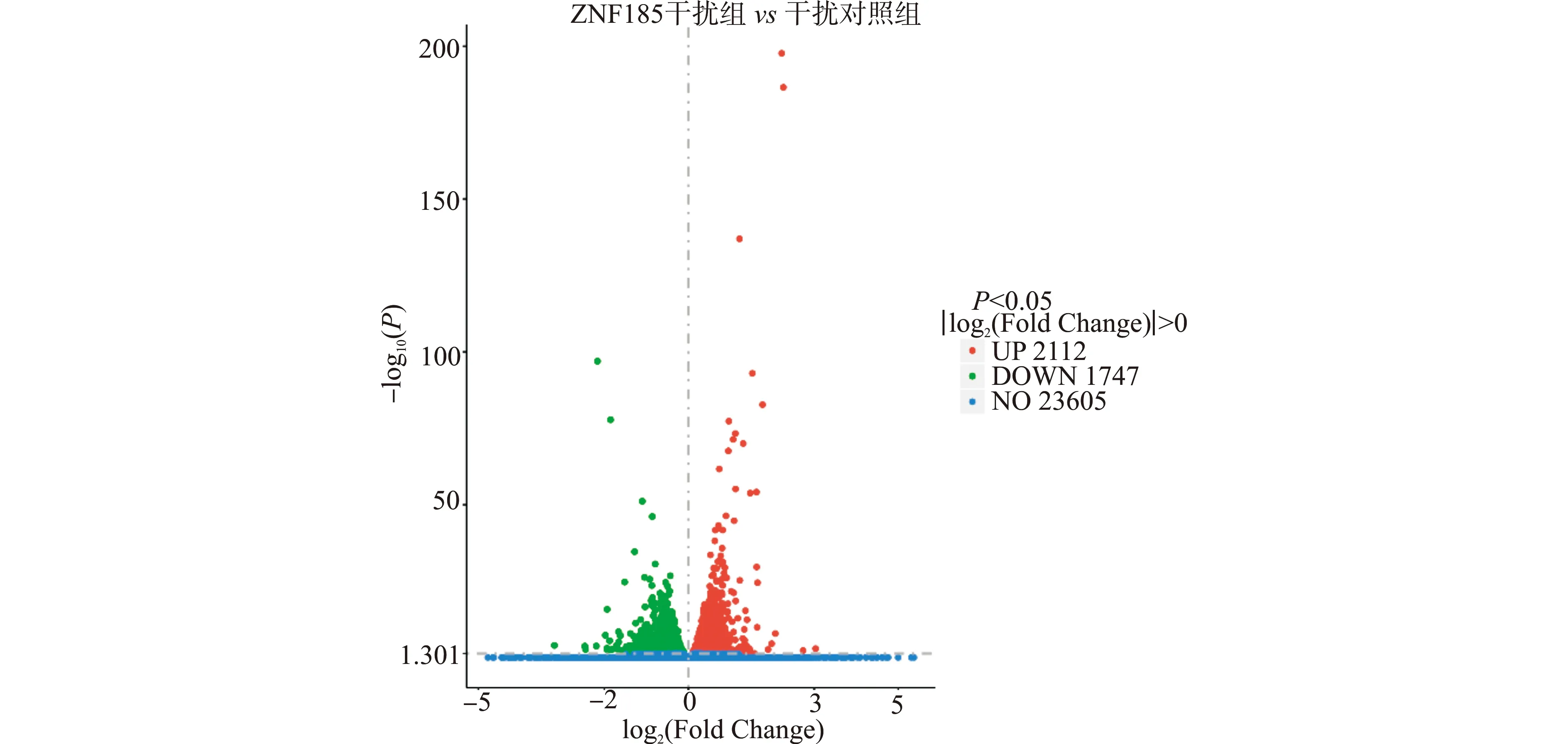
图1 食管鳞癌细胞中敲低ZNF185后的差异表达基因火山图Fig.1 Volcano map of differentially expressed genes after knockdown of ZNF185
2.3 GO功能富集分析结果
关于ZNF185在ESCC中参与的生物学过程,我们运用GO功能富集分析,使用cluster Profiler(3.4.4)软件实现差异表达基因的GO富集分析。GO是描述基因功能的综合性数据库,可分为生物过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)3个部分,可以揭示基因及其表达产物可能的生物学功能。分析结果显示显著富集的GO项目共有444项,其中生物过程348项,细胞组成63项,分子功能33项。在分析结果中,选择了以上3个方面中每个方面最显著的前10个项目,包括RNA剪接、核糖核蛋白复合物的生物生成、细胞-基质连接、局部粘附、细胞粘附分子的结合、钙粘着蛋白的结合等(图2)。这说明ZNF185可能通过上述生物学功能参与调控ESCC的发生发展。
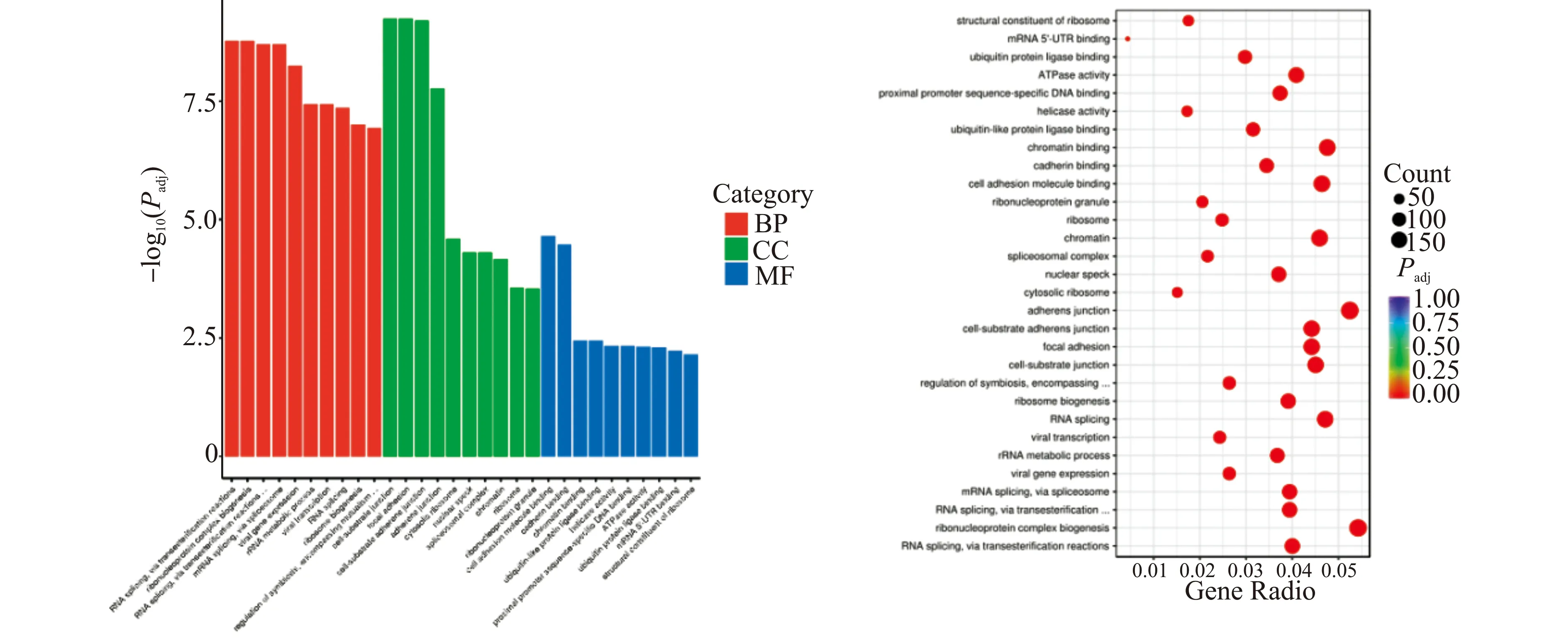
BP:生物过程;CC:细胞组成;MF:分子功能;图仅列出中各项排名前10位的GO分析富集条目。图2 GO功能富集分析Fig.2 Results of GO function enrichment analysis
2.4 KEGG富集分析结果
同时为了进一步了解ZNF185的生物学功能,本研究还进行了KEGG通路富集分析。KEGG是整合了基因组、化学和系统功能信息的综合性数据库。结果显示,在ESCC细胞中敲低ZNF185后差异表达基因显著富集的代谢过程有:剪接体、核糖体、癌症过程中的蛋白多糖和microRNAs、内质网中的蛋白质加工过程等。其中也包括一些信号通路,如:缺氧诱导因子1(hypoxia inducible factor 1,HIF-1)信号通路、p53信号通路等(图3)。
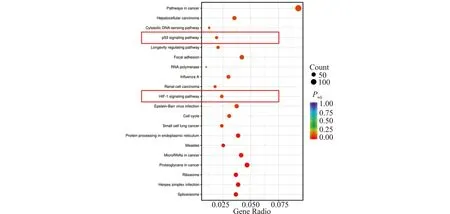
纵坐标表示KEGG通路富集分析的条目,横坐标表示显著差异表达基因的比例,每个点的大小表示基因的数目。图3 KEGG通路富集分析Fig.3 Results of KEGG pathway enrichment analysis
2.5 差异表达基因的蛋白互作网络分析
为了充分了解ZNF185与其他蛋白之间的相互作用以及潜在机制,本研究使用STRING 11.0及Cytoscape 3.8.2工具构建蛋白质相互作用网络图,由于差异基因过多,选择│log2(Fold Change)│>1.6并且P≤0.05的基因对应的蛋白质(图4A),并根据MCODE插件绘制子网络图(图4B),利用cytoHubba插件计算网络图中节点的度(degree),即与此节点相连的边数,某个节点的度越大,说明其可能在网络中处于较为核心的位置。根据度的大小选择了蛋白质相互作用网络的中心节点关键蛋白(图4C)。
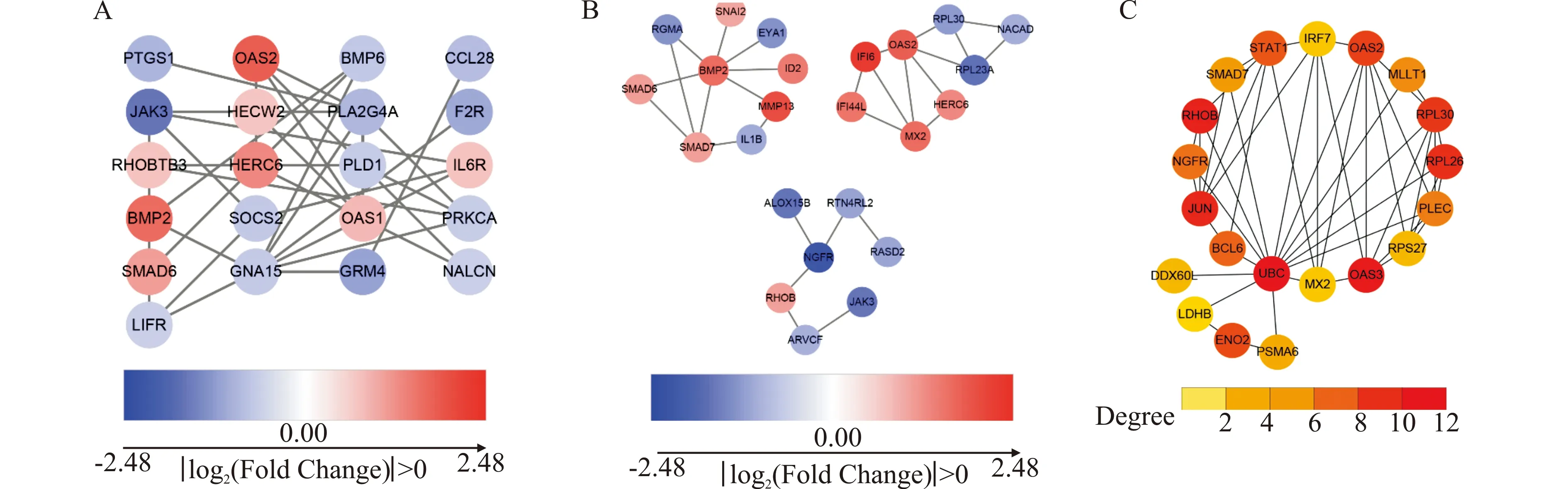
A:│log2(Fold Change)│>1.6并且P≤0.05的基因对应的蛋白质互作网络;B:根据MCODE插件绘制子网络图;C:度(degree)排名位于前列的基因对应蛋白的互作网络。图4 差异表达基因蛋白互作网络分析Fig.4 Protein-protein interaction network analysis of differentially expressed genes
2.6 关键蛋白的表达及生存分析
通过GEPIA网络工具在TCGA数据库中对关键蛋白对应的基因在食管癌(ESCA)数据集的表达情况进行分析,发现与正常组织相比,关键基因BMP2、OAS2、OAS3、IFI6在食管癌中表达升高(图5)。通过GEPIA工具对上述基因进行了生存分析,结果显示BMP2的表达升高与食管癌患者预后差有关(P<0.05)。而OAS2、OAS3及IFI6的表达与食管癌患者的预后相关性不高。对比BMP2低表达者,BMP2表达升高的患者总体生存率(overall survival,OS)明显降低(图6)。
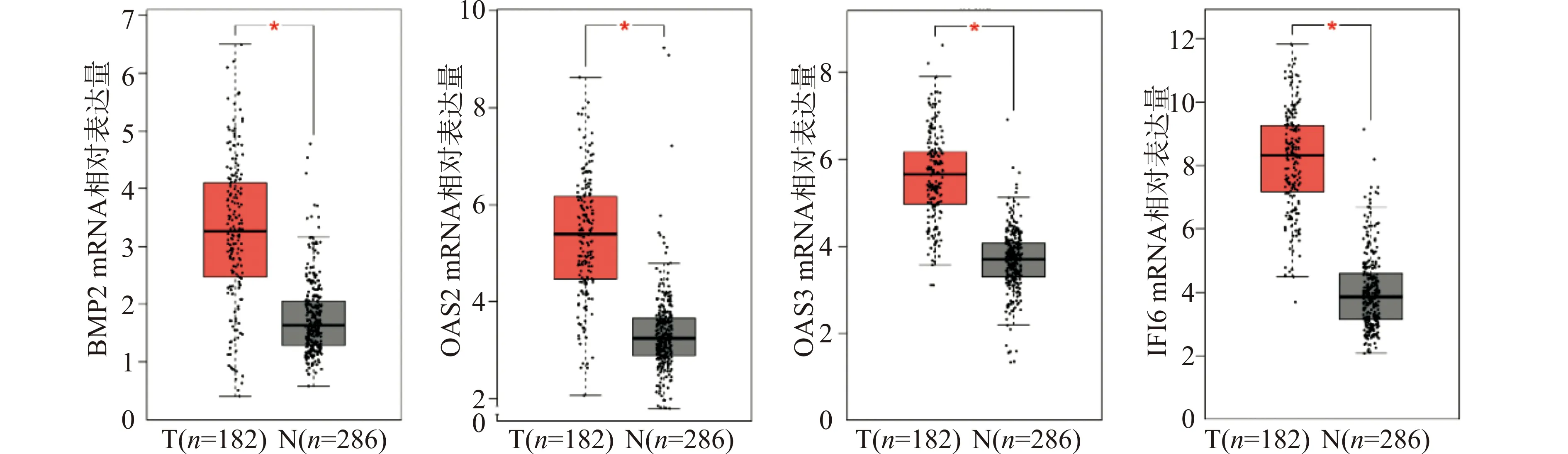
T:食管癌组织;N:正常组织;*P<0.05图5 关键基因在食管癌及正常组织的表达情况Fig.5 Expression of critical genes in esophageal cancer tissues and normal tissues
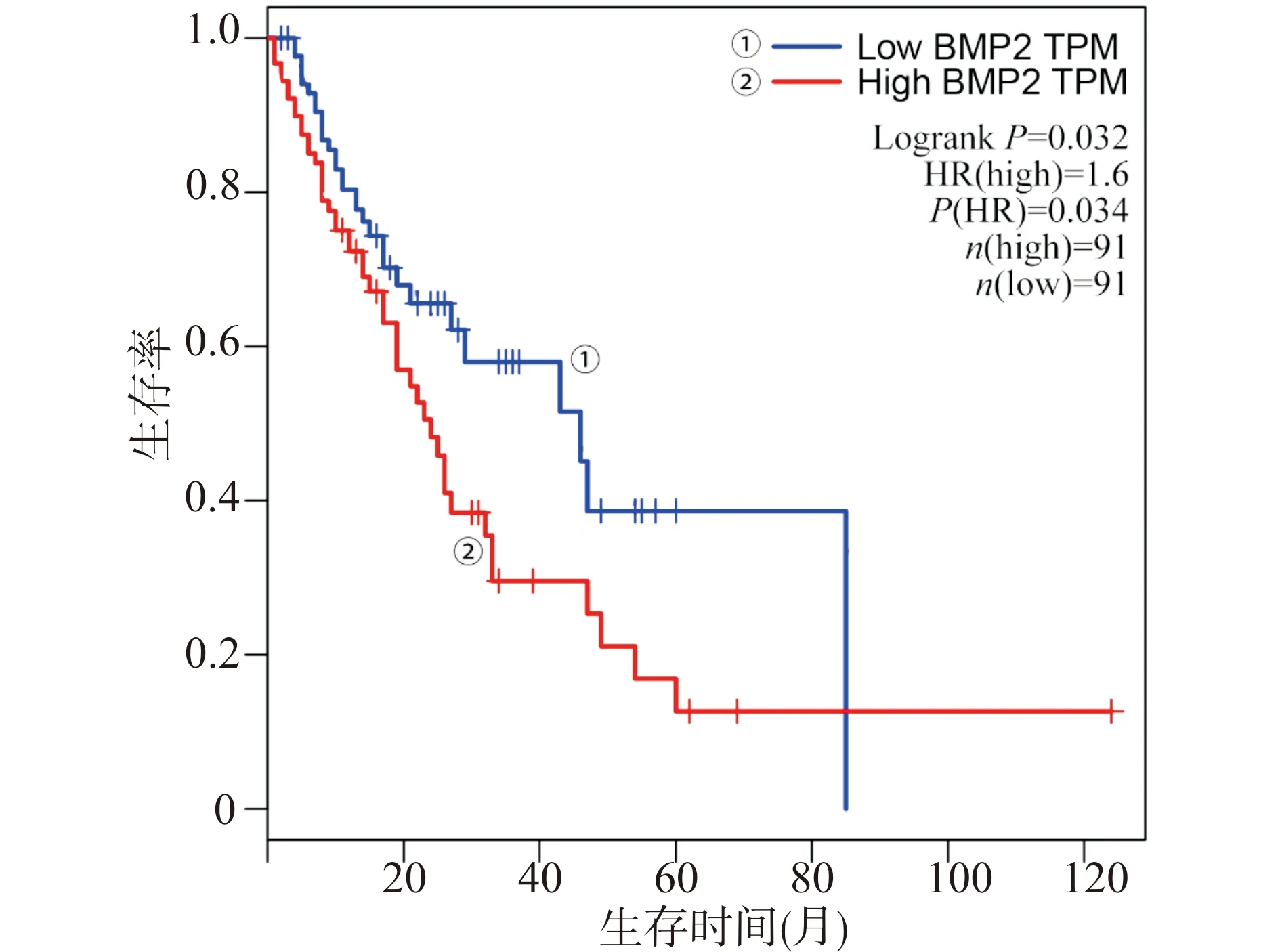
图6 关键基因在食管癌患者中的生存分析Fig.6 Survival analysis of critical genes in esophageal cancer
3 讨论
ESCC作为一种恶性程度高、易复发的疾病,在被诊断时往往已是疾病的晚期,总体预后较差[8],而其发病机制尚待进一步研究。ZNF185作为一种含锌离子并带有指状结构域的蛋白质[9],在多种肿瘤中存在表达异常的情况,提示该基因可能在肿瘤发生发展中发挥作用。本研究利用shRNA转染ESCC细胞系,敲低ESCC细胞中ZNF185的表达,再提取RNA进行转录组测序。结果显示敲低ESCC中ZNF185表达后有2112个基因表达升高,1747个基因表达下降,同时通过GO功能富集分析和KEGG通路富集分析,得到ZNF185可能起到关键作用的生物学过程及信号通路。另外利用蛋白互作网络分析,筛选出中心节点的关键蛋白。
ZNF185基因编码1个肌动蛋白-细胞骨架相关的Lin-l1、Isl1和Mec-3(LIM)结构域含锌指蛋白,最初从染色体Xq28上分离出来。LIM结构域是蛋白-蛋白相互作用结构域,广泛存在于各种蛋白质中,其功能与细胞骨架动力学、发育以及癌症的发生发展有关[10]。既往研究显示,ZNF185在前列腺癌、肺部肿瘤及头颈部鳞状细胞癌中表达下降[4-6],提示其可能起到一定的抑制癌症的作用。另有研究发现ZNF185为结肠癌肝转移的不良预测因素,提示其在结肠癌的侵袭转移中可能起到促进作用[11]。而在乳腺癌的研究中发现ZNF185在转移灶中有明显突变[12]。同时也有研究发现ZNF185与肿瘤的血行转移相关,其在细胞膜中的高表达被认为是胰腺癌的不良预后因素[13]。另外也有实验发现ZNF185与胰腺癌对吉西他滨的化疗敏感性相关,下调ZNF185可提高胰腺癌细胞的化学敏感性、促进凋亡和增殖抑制[14]。我们的既往研究发现ZNF185在ESCC中表达明显较低,且在ESCC细胞中敲低ZNF185后肿瘤细胞的增殖能力明显增强[3],提示ZNF185能够抑制ESCC肿瘤的发生发展,本次的转录组分析为研究ZNF185的作用机制及其下游通路提供了进一步的线索和方向。
在具体信号通路方面,有研究发现ZNF185能够通过抑制AKT/GSK3β途径抑制肺腺癌细胞的生长和侵袭[15]。在鳞状细胞癌中ZNF185能够通过p63相关通路影响鳞状上皮的分化[6]。也有实验证实了p53野生型细胞在DNA损伤时,能够转录激活ZNF185,从而抑制肿瘤细胞的活性、侵袭性及转移能力[16]。
在GO功能富集分析中显示,ZNF185在ESCC中可能与RNA剪接、核糖核蛋白复合物的生物生成、细胞-基质连接、局部粘附、细胞粘附分子的结合、钙粘着蛋白的结合等生物学过程相关。而ZNF185作为肌动蛋白相关蛋白,具体的功能尚不清楚,但已有研究显示其能与钙粘蛋白相互作用[6],提示ZNF185与细胞粘附相关,这与我们的分析结果一致,提示ZNF185很可能通过调控ESCC细胞的局部粘附影响肿瘤的发生。
KEGG通路富集分析发现在ESCC细胞中敲低ZNF185后,HIF-1信号通路和p53信号通路出现显著的富集,提示ZNF185可能通过上述通路影响ESCC的发生发展。HIF-1由2个亚基(HIF-1α和HIF-1β)组成,在调节细胞对缺氧的适应性反应中起着核心作用。在缺氧条件下,HIF-1α变得稳定,易位进入细胞核,并与HIF-1β异二聚形成复杂的HIF-1,再激活一系列下游基因的表达[17]。其在肿瘤的增殖、迁移、进展、代谢重编程、血管生成和肿瘤干细胞干性维持等方面也发挥着关键作用[18]。同时也有研究发现HIF-1α为ESCC患者的不良预后因素[19-21]。且有实验证实稳定敲低HIF-1α可抑制ESCC细胞的增殖[22],但具体机制尚不清楚。另外研究发现HIF/缺氧信号能够诱导p53表达[23],而p53的表达可以负反馈地降解HIF-1α[24]。我们的转录组测序数据提示ZNF185可能通过HIF-1/p53信号通路影响ESCC的发生发展,当然这还需要进一步的实验验证。
在PPI网络分析及生存分析中,BMP2作为关键基因在食管癌中表达升高,并且与患者预后相关。BMP2是骨形态发生蛋白家族的一员,隶属于转化生长因子-β1超家族,在调控生长发育过程中扮演重要角色[25]。有研究证实BMPs过表达显著影响ESCC细胞的侵袭和转移[26],提示ZNF185在ESCC中的作用可能与BMP2有关。
综上所述,本研究通过转录组测序技术及生物信息分析技术,得出食管鳞癌Eca-109细胞在敲低ZNF185后基因的差异表达情况,分析结果显示ZNF185能够通过细胞粘附等生物学过程影响ESCC的发生发展,其调控机制可能是通过HIF-1/p53信号通路实现,提示ZNF185可能成为ESCC治疗的潜在靶点。
