二甲双胍对2型糖尿病大鼠结直肠癌发生率及其肠道菌群的影响*
2022-08-15黄晓颖黄启友谢竹夫吴清明
黄晓颖,黄启友,谢竹夫,姚 菲,龙 辉,吴清明,,3△
武汉科技大学医学院1感染免疫与肿瘤微环境研究所,2武汉科技大学附属天佑医院消化内科,武汉 430065 3职业危害识别与控制湖北省重点实验室,武汉 430081
结直肠癌(colorectal cancer,CRC)是一种常见的消化道上皮源性恶性肿瘤,发病率位于恶性肿瘤第3位,死亡率高居第2位;我国结直肠癌的发病率在男性和女性中均呈现出上升的趋势[1]。2型糖尿病(T2DM)是以胰岛素分泌缺陷或生物功能受损引起的高血糖为特征的代谢性疾病,目前2型糖尿病的病理生理学机制被认为是胰岛素抵抗和β细胞功能缺陷。大量流行病学研究表明,与非糖尿病患者相比,2型糖尿病患者患结直肠癌的风险更高[2-4]。《中国糖尿病防治指南2020版》中将生活方式管理和二甲双胍(MET)作为2型糖尿病患者高血糖的一线治疗方案[5]。目前包括基础研究、临床试验和流行病学研究在内的大量研究表明,二甲双胍作为2型糖尿病的一线治疗药物,同时也可能是一种能够降低结直肠癌发生风险的化学预防药物,其可能的抑癌机制包括调节细胞代谢、免疫和肠道菌群等[6-8]。
因此本研究通过高脂高糖饮食联合腹腔注射低剂量链脲佐菌素(STZ)诱导建立2型糖尿病大鼠模型[9],在此基础上使用二甲基肼(DMH)诱导大鼠结直肠癌的发生,以此构建2型糖尿病结直肠癌大鼠模型,采用二甲双胍灌胃和控制大鼠饮食摄入量的方法,模拟临床2型糖尿病患者高血糖的治疗方案进行干预,观察其对2型糖尿病大鼠结直肠癌的发生情况以及肠道菌群的影响。
1 材料与方法
1.1 实验材料
1.1.1 实验试剂 二甲双胍、STZ、DMH均购于美国Sigma。无水乙醇、二甲苯、中性树胶购于国药集团化学试剂有限公司。苏木精-伊红(HE)染液、分化液、返蓝液购于武汉佰仟度生物科技有限公司。总RNA提取试剂Trizol购于美国Invitrogen,Real-time PCR逆转录-聚合链酶反应试剂盒购自日本TOYOBO,SYBR Green Supermix购自美国Bio-Rad。
1.1.2 实验动物 由北京维通利华实验动物技术有限公司购入36只雄性SD大鼠,6周龄,体重180~230 g。SPF级实验室温度(23±2)℃,相对湿度(50±10)%,每日光照12 h,自由饮水。
1.2 实验方法
1.2.1 构建2型糖尿病结直肠癌大鼠模型 取24只SPF级SD大鼠以高脂高糖饲料(HFD)饲养6周后,采取腹部注射STZ(35 mg/kg)的方式进行2型糖尿病造模。注射1周后,采用大鼠尾尖取血法用罗氏血糖仪和血糖试纸测量大鼠空腹血糖(FBG),以FBG≥11.1 mmol/L为2型糖尿病模型造模成功标准[10]。根据STZ说明书,对未达标的大鼠进行STZ补注后,所有造模大鼠的FBG均大于11.1 mmol/L。2型糖尿病模型构建成功后,将所有大鼠的饮食转为普通饲料喂养,同时每只大鼠给予约为其体重5%的维持饲料,以模拟临床上2型糖尿病患者高血糖一线治疗方案中的生活方式管理。在2型糖尿病模型的基础上进行DMH腹腔注射,注射浓度为30 mg/kg,每周1次,持续给药32周。
1.2.2 实验动物分组 将2型糖尿病结直肠癌模型大鼠随机分为对照组(Control group)和实验组(MET group),每组12只。在2型糖尿病模型构建成功后DMH腹腔注射的同时,实验组每天给予二甲双胍灌胃,二甲双胍浓度按200 mg/(kg·d),灌胃量3 mL/kg[11],对照组给予0.9%生理盐水灌胃。另取12只SD大鼠为正常组,仅给予普通饲料,不作任何其他处理。
1.2.3 动物取材与指标观察 大鼠饲养过程中,每4周记录大鼠体重,测量空腹血糖,并观察各组大鼠毛发、肛门、大便情况。在DMH注射32周末取材,取材前大鼠禁食24 h,解剖前记录体重和FBG。10%水合氯醛腹腔注射麻醉后解剖大鼠,观察大鼠器官有无病变,取盲肠下端至肛门处分离结直肠,并纵向剖开肠道,取出大鼠肠道内粪便,-80℃冻存,用于肠道菌群16S rRNA测序;4℃预冷的0.9%生理盐水清理结直肠,直尺测量长度,观察结直肠病变情况,并记录肿瘤个数。取肿瘤病灶处左右各2 cm结直肠组织标本,包括肿瘤组织与癌旁组织、未患癌的正常结直肠组织,从中截取两份,一份完全浸泡于4%多氯甲醛溶液中,置于4℃冰箱中,用于HE染色实验,另一份加入1 mL Trizol置于-80℃冰箱中冻存,用于检测正常肠组织和肿瘤组织中IL-17的表达。
1.2.4 HE染色与组织病理学观察 石蜡切片脱蜡后,进行HE染色,脱水封片,中性树胶封片,光学显微镜下观察并拍照。
1.2.5 各组正常肠组织与癌组织中IL-17的表达 采用Trizol法提取各组大鼠正常肠组织或肿瘤组织中的总RNA,使用分光光度计检测A260/A280比值,若该值在1.8~2.2范围内,则认为RNA纯度较高。根据逆转录试剂盒使用说明将总RNA逆转录成cDNA,再进行实时定量聚合酶连反应(qRT-PCR)反应。IL-17引物由上海生工生物工程股份有限公司设计合成,上游引物:5′-TGCCTGATGCTGTTGCTGCTAC-3′,下游引物:5′-TTGGACACACTGAACTTTGAGGGATG-3′。反应条件设置为95 ℃反应2 min,95 ℃反应10 s,60 ℃持续30 s,40个循环。反应结束后,以actin为内参,采用2-ΔΔCt法计算RNA的相对表达量。
1.2.6 大鼠肠道菌群测序 通过CATB法提取大鼠粪便样本中的DNA后,进行PCR扩增,将得到的PCR产物进行等浓度混养和纯化,使用TruSeq©DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后,使用NovaSeq6000进行上机测序。
1.3 统计学方法
所有实验数据均采用SPSS 25.0软件进行实验数据统计分析。计量资料用均数±标准差表示,组间比较采用t检验;计数资料用百分率表示,组间比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠体重与血糖监测
2.1.1 大鼠体重监测 高脂高糖饲料喂养6周后大鼠体重增长更为明显,但与普通饲料喂养的大鼠相比差异无统计学意义(P>0.05);在成功构建2型糖尿病模型后,大鼠体重呈现明显的下降趋势;在DMH注射32周后,正常组的体重明显高于另两组(P<0.01),实验组平均体重与对照组比较差异无统计学意义(P>0.05)(图1)。
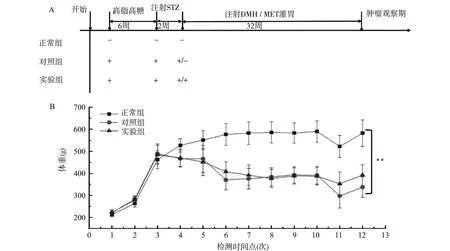
A:实验处理流程示意图;B:各组大鼠体重变化曲线,**P<0.01 图1 实验流程及大鼠体重监测Fig.1 Body weight monitoring of rats
2.1.2 大鼠血糖监测 图2显示,高脂高糖饲料喂养期间对照组与实验组大鼠的FBG明显高于正常组,且对照组与实验组血糖无明显差异(P>0.05),造模成功(图2时间点4)。随后实验组接受MET灌胃治疗。在图2时间点6,实验组的FBG已经呈现出明显的下降趋势,与对照组相比有极显著差异(P<0.01),而对照组的FBG一直处在约25 mmol/L的高血糖水平。在实验后期(图2时间点11~14)实验组的血糖水平逐渐升高,但实验组的平均FBG水平依旧与对照组存在显著差异(P<0.05),因此相较于对照组,二甲双胍仍有效抑制实验组大鼠的血糖水平升高。

*P<0.05图2 大鼠血糖监测Fig.2 Blood glucose monitoring in rats
2.2 大鼠肿瘤生长情况
DMH注射32周末,对照组死亡1只,剩余11只;实验组死亡2只,剩余10只。解剖发现对照组11只大鼠结直肠均发生病变,其中1只大鼠面颊部病变导致其无法正常进食(图3A),1只大鼠肝脏发生明显病变(图3B),可见明显的肠胀气现象(图3C);实验组有6只大鼠结直肠发生病变,4只未有肉眼可见病变;正常组大鼠结直肠均未有肉眼可见病变。正常组与实验组未患癌大鼠的结直肠剖面内表面光滑,无肉眼可见病变(图3D、3E)。实验组患癌大鼠与对照组患癌大鼠的肠道内均有大小不一的息肉状或乳头状瘤体(图3F、3G)。实验组肿瘤发生率60%,对照组肿瘤发生率100%,因此在本研究中相较于对照组,二甲双胍干预有效地降低了结直肠肿瘤的发生率,差异有统计学意义(P<0.05)。实验组平均肿瘤数[(1.70±1.79)个/只]较对照组[(3.82±2.17)个/只]明显减少(P<0.05),表明二甲双胍干预可以显著降低DMH诱导的2型糖尿病大鼠结直肠癌的发生率。

A:对照组大鼠面颊部病变图;B:对照组大鼠肝脏病变图;C:对照组大鼠肠胀气图;D:正常组大鼠结直肠;E:实验组大鼠未病变结直肠;F:实验组大鼠病变结直肠;G:对照组大鼠病变结直肠图3 大鼠解剖图Fig.3 Anatomy of rats
2.3 HE染色与组织病理学观察
通过光学显微镜对大鼠结直肠组织以及肿瘤组织进行观察。正常组大鼠与实验组未患癌大鼠的结直肠组织黏膜上皮完整,腺体排列规则,未见明显炎性浸润(图4A、4B)。实验组大鼠低级别上皮内瘤变的腺体具有明显的异型性,癌前病变组织内可见少量炎性细胞浸润(图4C);印戒细胞癌中可见脉管癌栓,分化较差,腺体中有大量炎性细胞浸润(图4D)。对照组大鼠绒毛管状腺癌癌前病变组织中大量炎性细胞浸润(图4E);腺癌(图4F)和肝癌(图4G)组织中可见大量炎性细胞浸润。

A:正常组大鼠结直肠组织;B:实验组未患癌大鼠结直肠组织;C:实验组大鼠低级别上皮内瘤变;D:实验组大鼠印戒细胞癌;E:对照组大鼠绒毛管状腺癌;F:对照组腺癌;G:对照组肝癌图4 各组大鼠结直肠组织以及肝脏组织病理变化(苏木精-伊红染色)Fig.4 Pathological changes of colorectal and liver tissues of rats in each group(HE staining)
2.4 各组大鼠正常肠组织与肿瘤组织中IL-17的表达
通过qRT-PCR检测各组大鼠正常肠组织与肿瘤组织中IL-17的表达。肿瘤组织中IL-17的表达显著高于正常组织(P<0.05)(图5A)。与正常组肠组织相比,实验组正常组织中IL-17的表达无统计学差异(P>0.05),对照组正常组织中IL-17的表达明显升高(P<0.05)(图5B)。而实验组与对照组肿瘤组织中IL-17的表达差异无统计学意义(图略)。

A:肿瘤组织与正常组织中IL-17的表达;B:三组大鼠正常肠组织中IL-17的表达;*P<0.05,**P<0.01 图5 各组大鼠正常肠组织和肿瘤组织中IL-17的表达水平Fig.5 Expression levels of IL-17 in normal colorectal tissues and tumor tissues of rats in each group
2.5 肠道菌群16S rRNA测序数据及分析
2.5.1 三组大鼠肠道菌群操作分类单元(OTUs)数目比较 根据聚类得到的OTUs结果绘制VENN图。图6A可见正常组、对照组和实验组之间共有OTUs个数为666个,其中正常组特有1369个OTUs、对照组特有648个OTUs、实验组特有641个OTUs。相对于正常组,对照组和实验组特有的OTUs个数都有明显的下降(P<0.05),但二甲双胍干预并未减少特有OUTs的个数。
2.5.2 三组大鼠肠道菌群物种相对丰度 根据物种注释结果,选取每个分组在门水平上最大丰度排名前10的物种,生成物种相对丰度柱形图。通过图6B可见Firmicutes厚壁菌门,Bacteroidota拟杆菌门,Verrucomicrobia疣微菌门,Proteobacteria变形菌门,Actinobacteria放线菌门在3组中均是相对丰度占绝大多数的门水平菌群,其中厚壁菌门和拟杆菌门以及疣微菌门在3组中占比均最高。根据所有样本在属水平的物种注释及丰度信息及其所在组别,选取丰度排名前35的属,进而进行聚类,绘制成热图。通过图6C可见3组大鼠在属水平上的物种聚集有着明显的差异,其中正常组Romboutsia、Chryseobacterium聚集较多;对照组Alistipes、Colidextribacter、Ciceribacter、Bacteroides聚集较多;实验组Turicibacter、NK4A214_group、Clostridium_sensu_stricto_1、Limosilactobacillus、Blautia、Bifidobacterium(双歧杆菌)聚集较多。
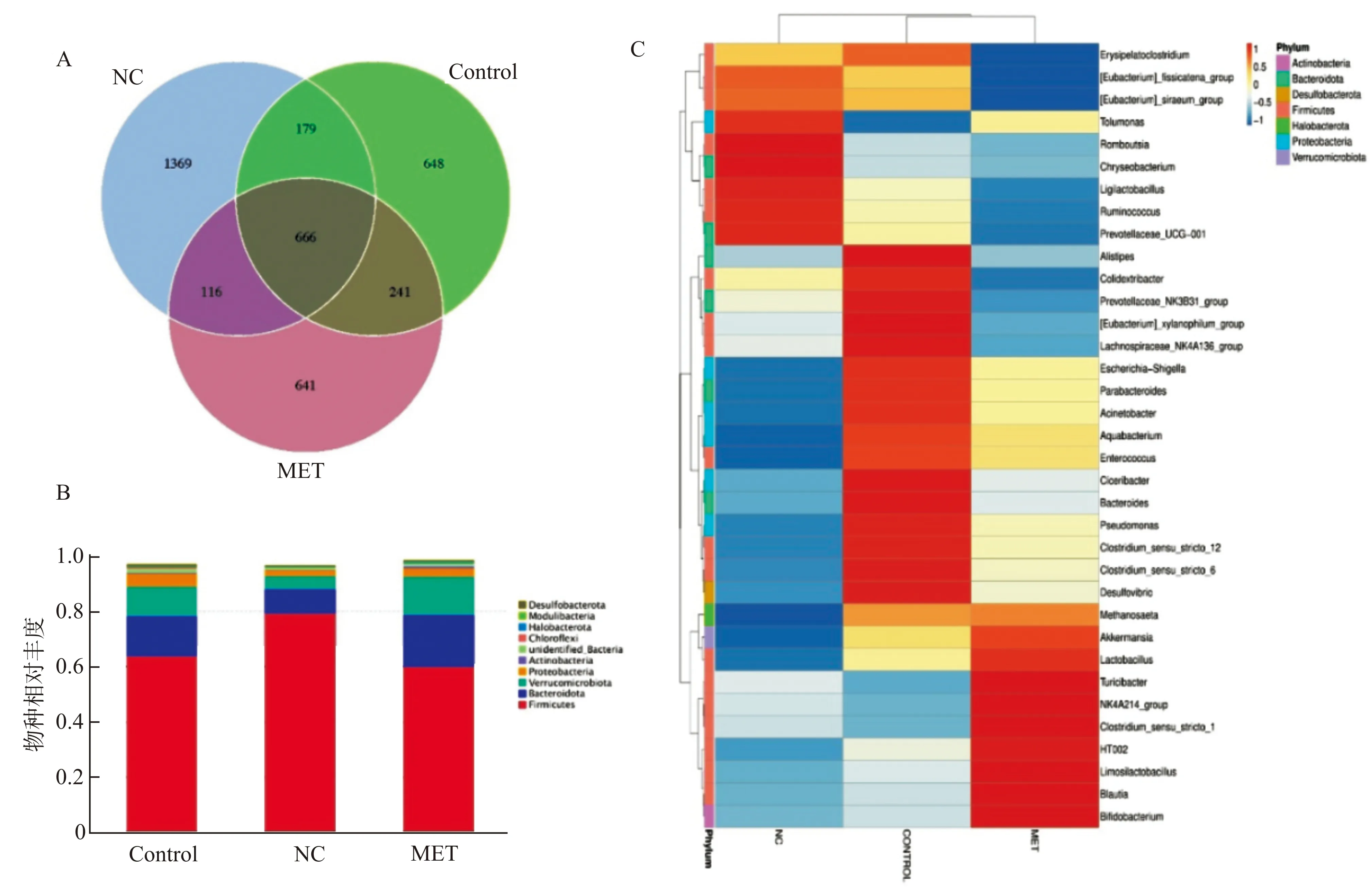
NC:正常组;MET:实验组;Control:对照组;A:VENN图;B:物种聚类热图;C:物种相对丰度柱形图图6 肠道菌群测序数据以及物种分布情况Fig.6 Gut microbiota sequencing data and species distribution
2.5.3 三组大鼠粪便菌群Alpha多样性指数组间差异分析 图7A可见实验组Shannon指数低于对照组,且具有统计学意义(P<0.05);正常组Shannon指数低于对照组,但差异无统计学意义;图7B可见实验组Simpson指数均低于对照组(P<0.05)。提示DMH诱导2型糖尿病大鼠成瘤过程中,大鼠肠道菌群Alpha多样性呈现上升的趋势,而二甲双胍干预可以在一定程度上使2型糖尿病结直肠癌大鼠的肠道菌群Alpha多样性更趋近于正常大鼠。
2.5.4 稀释曲线和物种累积箱形图 稀释曲线可直接反映测序数据量的合理性。图7C可见随着测序数量增加,OTUs数量快速增加并逐渐趋向平坦,说明测序数据量渐进合理,更多的数据量只会产生少量新的OTUs。物种累积箱形图结果反映了持续抽样下OUTs出现的速率。图7D可见物种数量上升趋势随着样本量的增加趋于平缓,则表示此环境中的物种并不会随样本量的增加而显著增多,表明抽样充分,可以进行后续数据分析。
2.5.5 三组大鼠粪便菌群Beta多样性指数组件差异分析 NMDS是基于Bray-Curtis距离来进行分析的非线性模型,根据样本中包含的物种信息,以点的形式反映在二维平面上。其设计目的是为了克服线性模型(包括PCA、PCoA)的缺点,更好地反映生态学数据的非线性结构。图7E显示,实验组与正常组菌群组成相差最多,与对照组接近。
2.5.6 三组大鼠粪便菌群在不同水平上差异物种分析 通过t检验在门水平和属水平上找出组间显著差异物种(P<0.05)。在门水平上可见对照组的厚壁菌门丰度低于正常组(P<0.05),拟杆菌门与脱硫菌门丰度高于正常组(P<0.05);在门水平上,实验组与对照组未见明显差异(图8A)。在属水平上可见正常组中Ligilactobacillus的丰度相较于对照组更高,而Bacteroides、Clostridium_sensu_stricto_6、Alistipes、UCG-005的丰度都低于对照组(图8B)。实验组中Ligilactobacillus、Ruminococcus、[Eubacterium]_siraeum_group、Prevotellaceae_NK3B31_group、Alistipes、[Eubacterium]_fissicatena_group、UCG-005的丰度均低于对照组(图8C)。
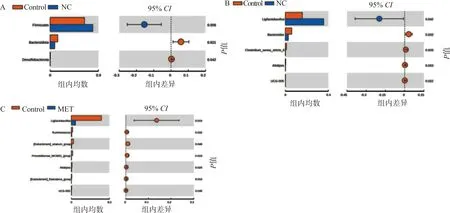
NC:正常组;MET:实验组;Control:对照组;各图中左侧为组间差异物种丰度,右侧为组间差异的95%置信度,最右端是对应物种的组间显著性检验P值;A:门水平上的对照组与正常组的物种差异;B:属水平上的对照组与正常组的物种差异;C:属水平上的对照组与实验组的物种差异图8 组间物种差异分析图Fig.8 Analysis of species difference between groups
3 讨论
结直肠癌(CRC)是最常见的癌症之一,对全球健康构成重大负担。2018年,在全球所有癌症中,CRC发病率排名第3,死亡率排名第2。目前大量临床流行病学、大队列人群研究均显示相较于正常人群,2型糖尿病患者患结直肠癌的风险更高。早在2006年就有研究表明,2型糖尿病大鼠相较于非糖尿病大鼠在接受DMH诱导后结直肠癌的发生率更高[12]。二甲双胍作为2型糖尿病的一线治疗药物,在结直肠癌中的化学预防作用受到了广泛关注,其抑癌机制包括对细胞代谢、免疫和肠道菌群的调控。已有研究证明二甲双胍可以激活AMPK通路,而AMPK可通过抑制mTOR信号转导和转录激活因子3(STAT3)而抑制Th17细胞的分化[13],且对自发性肠道肿瘤发生小鼠模型的研究已证明Th17分泌的细胞因子IL-17可促进肿瘤发生和进展[14]。此外,亦有文献表明特异性敲除IL-17A的肠细胞可减少小鼠的肿瘤形成,这表明IL-17A在肠细胞中具有直接致瘤功能[15]。研究发现,与口服二甲双胍相比,静脉注射二甲双胍几乎不能改善血糖,且肠道中的二甲双胍水平比血清中的水平高出100到300倍,这就使得肠道成为人体二甲双胍的主要储存库[16]。临床研究表明,二甲双胍的干预可以改善2型糖尿病患者已经失调的肠道菌群[17-19],而结直肠癌的进展与肠道菌群之间的联系密不可分。因此越来越多的学者提出二甲双胍或许在肠黏膜界面与肠道菌群发生代谢结合,以此改变肠道菌群的组成,发挥其肠道抑癌特性[20]。
本研究借鉴已有的2型糖尿病结直肠癌大鼠模型建立方法[10],但此模型在2型糖尿病造模成功后继续给予大鼠高脂高糖饲料且自由饮食,其结果中二甲双胍对降低2型糖尿病大鼠结直肠癌的发生率并无统计学意义。鉴于临床2型糖尿病患者高血糖的一线治疗方案包括生活方式管理和二甲双胍,本研究在2型糖尿病大鼠造模成功后,将饲料更换为普通饲料,且控制每只大鼠每日进食量约为其体重的5%,以模拟临床2型糖尿病患者高血糖的治疗方案,同时监测大鼠体重和血糖的动态变化以及一般情况。
在DMH注射32周末,解剖全部大鼠,观察到二甲双胍有效降低由DMH诱导的2型糖尿病大鼠结直肠癌的发生率。通过石蜡包埋和HE染色,对3组大鼠结直肠组织和肿瘤组织进行观察,发现二甲双胍干预减轻大鼠肠道正常组织和癌前病变组织中炎性细胞的浸润。qRT-PCR结果显示IL-17的确在大鼠肿瘤组织中呈现高表达,二甲双胍干预可降低2型糖尿病结直肠癌大鼠正常肠组织中的IL-17表达,但无法抑制2型糖尿病结直肠癌大鼠肿瘤组织中IL-17的表达。
为了探索二甲双胍干预对大鼠肠道菌群的影响,本研究将大鼠粪便送至武汉迈维代谢公司进行16S rRNA测序。测序结果显示对照组相对正常组的Alpha多样性有明显的升高趋势,而二甲双胍干预则显著降低Alpha多样性并与正常组保持在相似水平上。NMDS分析结果显示,实验组与正常组菌群结构相差最多,与对照组相似。
物种分布显示在门水平上,厚壁菌门和拟杆菌门在3组中占比均最高,此结果与黄廷玉等[21]的研究结果一致;在属水平上,可见3组聚集物种差异显著,其中对照组Alistipes、Bacteroides(脆弱拟杆菌属)聚集较多。Alistipes被认为与人类CRC的发生相关[22],且已有研究表明Alistipes在结直肠癌患者中含量更高,对APCMin/+小鼠使用二甲双胍治疗后其含量降低[23]。Bacteroides被认为是通过肠内慢性炎症诱发结直肠癌发生的主要菌种之一,其产生的毒素能够诱导促炎症细胞因子IL-18的产生,从而诱导慢性炎症的发生,此外还可以清除E-钙粘蛋白,破坏上皮内稳态,导致肠上皮增生,并诱导结直肠癌的发生[24]。实验组中Turicibacter、Limosilactobacillus、Blautia、Bifidobacterium(双歧杆菌)聚集较多。临床研究发现在治疗2型糖尿病患者时可以明显聚集肠道内Akkermansia,且Akkermansia的丰度下降被认为与CRC的发生相关,但目前已有研究提出Turicibacter似乎与Akkermansia为拮抗菌群[25],且Turicibacter在AOM/DSS诱导的结直肠癌小鼠粪便中被检出[26],因此本研究中实验组Turicibacter的聚集可能是造成其结直肠癌发生的一个重要菌属。但目前研究多认为Limosilactobacillus、Blautia、Bifidobacterium为有益菌:Limosilactobacillus中的CECT5716已成为最有前途的益生菌之一,并被描述为对炎症过程和免疫改变具有潜在的有益作用[27];Blautia的丰度被认为与人类CRC的发生呈负相关[28];Bifidobacterium是放线菌门的一个属,目前认为其在维持肠道功能乃至人体稳态方面发挥着重要作用,在1997年,研究人员就证实长双歧杆菌和乳果糖复合物可以有效抑制AOM/DSS诱导的大鼠结肠异常隐窝病灶(ACF)的发生,提示了双歧杆菌对于结直肠癌的发生具有一定的预防作用[29]。
差异物种分析显示在门水平上实验组与对照组未见明显差异,但在属水平上对照组中的Ruminococcus(瘤胃球菌属)、Alistipes都显著高于实验组。有报告称瘤胃球菌在CRC患者的粪便样本中有着较高的丰度,被认为与CRC的发生有关[30]。
综上所述,本研究发现二甲双胍可显著降低DMH诱导的2型糖尿病大鼠结直肠癌的发生率,抑制促炎细胞因子IL-17的分泌,并影响其肠道菌群。恢复肠道菌群Alpha多样性,改变2型糖尿病结直肠癌大鼠肠道菌群构成,为二甲双胍成为临床2型糖尿病患者结直肠癌预防药物提供了新的理论支持与研究思路。
