TCT 结合HR⁃HPV 基因检测对宫颈病变的诊断及HPV 基因型与TCT 结果、病理分型的关系
2022-08-15牛振楠孟常娟成云云
吴 杉 牛振楠 孟常娟 路 萌 成云云*
(1.邢台市第三医院健康体检中心,邢台 054000;2.邢台市第三医院内镜室,邢台 054000;3.邢台市第三医院病理科,邢台 054000)
宫颈癌是女性第四大常见的恶性肿瘤,尤其是在发展中国家。目前国际上关于高级别宫颈病变的诊治没有争议[1]。但是,宫颈病变的患者即使在治疗后发生宫颈癌的风险明显高于正常人群。因此,为了防止宫颈病变的复发和进展,对这部分人群的监测是一项重要的工作。然而,不同的国家和地区的随访方案差异比较大。目前对于宫颈病变治疗后的女性,术后需要定期行宫颈细胞学和宫颈HPV 检测,但由于筛查方法存在高敏感性和低特异性等不足,这部分患者需要频繁的接受检查[2,3]。并且检测的间隔时间长短不一,这不仅为患者带来严重的心理负担和压力,也为国家带来巨大的负担。因此,目前需要一种方法可以简便和有效的预测宫颈病变治疗后的残留与复发。约99.7%的宫颈癌是由于HPV 感染造成的,HPV 持续感染与子宫颈癌,肛门生殖器,以及头颈癌密切相关[4,5]。国际认可的宫颈癌筛查三步方案包括初次筛查、阴道镜检查和组织病理学。目前,通过HPV 检测和Thinprep 细胞学检测(TCT)单独筛查方案应用广泛,但筛查结果较局限,仍需寻找可靠的筛查方案。本研究探讨TCT 结合HR⁃HPV 基因检测对宫颈病变的诊断及HPV 基因型与TCT 结果、病理分型的关系。评价其对诊断宫颈病变的价值,进而为宫颈癌的及时发现以及后续疗法的选择提供依据。
1 资料与方法
1.1 一般资料
选取2019年1月~2020年10月入邢台市第三医院的行宫颈病变的426例,<21 岁组80例,21~29岁组98例,30~65 岁组135例,>65 岁组113例,均行TCT 检测和HR⁃HPV 基因型检测,患者均知晓并签署《知情同意书》,本研究经医院伦理委员会审查并通过。
1.2 纳入和排除标准
纳入标准:①参照美国宫颈病变筛查推荐指南;②患者检查前3d 未进行性行为;③患者可进行良好沟通,无严重的精神病史;④无其他器官功能障碍;⑤伴有白带异常、阴道内不规则出血等。
排除标准:①患有急性生殖道炎症,免疫系统疾病以及性传播疾病等;②已进行全子宫切除术;③筛查的1 周内有阴道用药史;④已接受过HPV治疗者(2 内周内);⑤不配合本研究患者。
1.3 方法
1.3.1 TCT 检测方法
是一种针对传统巴氏涂片缺点改进后的宫颈细胞脱落采集、制片、阅片的方法。利用从宫颈外表面(子宫颈阴道部)和宫颈管(宫颈内膜)获取的细胞来评估移行带(鳞状柱状上皮接合处)发生宫颈病变的风险。TCT 的采样工具是一把小毛刷,和传统的刮板相比,可以刷到更多细胞,然后经过特殊的制片技术把细胞分散成薄层样本。经Thin Prep 2000 全自动超薄液基细胞学检测系统制备成均匀的薄层细胞涂片,将玻片进行染色固定后进行细胞学诊断。
1.3.2 HPV 基因型检测
采用PCR 反向斑点杂交技术,以及HPV 基因分型检测试剂盒(深圳市某生物药械有限公司)进行定性检测并加以分型,能够检测23种HPV 基因型,直接提示感染HPV 的基因型;包括17种高危型(R⁃HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82)和6种低危型(L⁃HPV6、11、42、43、81、83)。采用PCR 仪(BD,美国)、核酸分子快速杂交仪、基因芯片⁃微阵列扫描分析仪,PCR 扩增待检测样品,并进行扩增,反应体系严格按照说明书。根据反应的质量,每个扩增系统的最终体积为25 μl,由50 mM KCl,10 mM pH 8.3 的Tris⁃HCl,4 mM MgCl2、200 mM 脱氧核苷酸三磷酸(dNTP),50 pmol 组成每个引物和2U Easy TAQ DNA Poly⁃merase。在PCR 仪中对引物进行扩增35个循环,反应条件为:94 ℃下45 s 变性,58 ℃下45 s 退火,并于45 ℃延伸。在72 ℃下45 s,在72 ℃下5分钟;而使用GP5+和GP6+引物进行扩增的条件包括:在94 ℃初始变性4分钟,然后进行40个循环,其中在94 ℃变性1分钟,在50 ℃退火1分钟并在72 ℃下在1分钟内延长15 s,此外,在1.3%琼脂糖凝胶中使用电泳分析通过反应获得的扩增产物。
1.4 观察指标
1.4.1 不同年龄层次HPV 基因型阳性率
分析年龄<21岁、21~29岁、30~65岁以及>65岁的年龄段的HPV 基因型阳性率;
1.4.2 TCT 结果与病理诊断阳性率
分析TCT 结果(ASCUS、LSIL、HSIL、SCC)与病理诊断阳性(CINⅠ、CINⅡ、CINIII 、癌、病理阳性率(%);
1.4.3 比较病理分级与HPV 感染情况
HR⁃HPV 阳 性、HPV 阴 性、HPV16+ 或HPV18+、HPV16 及HPV18 亚型感染率与病例分级比较。
1.4.4 比较HR‐HPV 感染与TCT 检测异常比较
宫颈炎组中HR⁃HPV 阳性、宫颈CIN 组、宫颈浸润癌组。
1.4.5 比较TCT 结合HR‐HPV 基因检测
分析3 种检测方式阳性预测值、阴性预测值、假阳性预测值、假阴性预测值
1.4.6 ROC 曲线分析
分析3 种检测方式的特异性和灵敏度。
1.4.7 相关性分析
以16、18、31、35、39、45、51、58、68、73 及82分型,采用Seperman 进行相关性分析。
1.5 统计学方法
应用SPSS 20.0 软件进行分析,计数资料采用χ²检验,以率[n(%)]表示,ROC 曲线用于灵敏度与特异度分析,采用Seperman 分析检测的相关性,以α=0.05 为检验水准,P<0.05 为差异有统计学意义。
2 结果
2.1 比较不同年龄层次HPV 基因型阳性率
与<21 岁组比较,30~65岁组和>65岁组HR⁃HPVS 阳性率升高(P<0. 05);与<21 岁组比较,>65岁组L⁃HPV 阳性率降低(P<0. 05);与21~29岁组比较,30~65 岁组、>65岁组HR⁃HPV阳性率均升高(P<0. 05),而L⁃HPV 阳性率比较无统计学意义(P>0. 05);而HPV 阴性率比较差异无统计学意义(P>0. 05)。见表1。
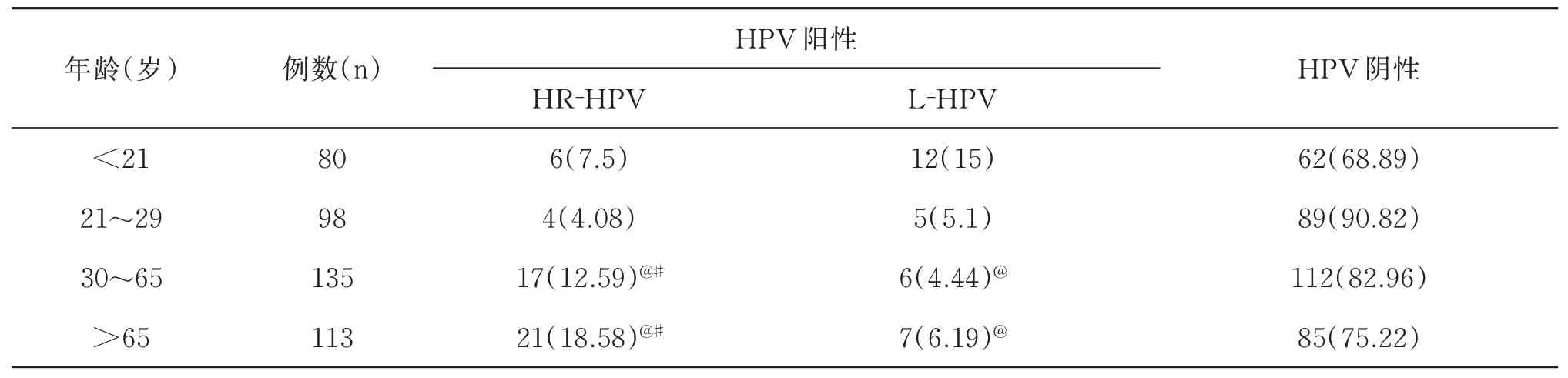
表1 比较不同年龄范围HPV 基因型阳性率
2.2 比较TCT 结果与病理诊断阳性率
426例异常TCT 患者中病理阳性133例,病理阳性率31.2%,其中,ASCUS 病理阳性45例(4.37%),LSIL 病理阳性24例(38.1%),HSIL 病理阳性45例(60.81%),SCC 病理阳性率为100%,随着TCT 检查级别与病理阳性率成正比(P<0.05)。见表2。
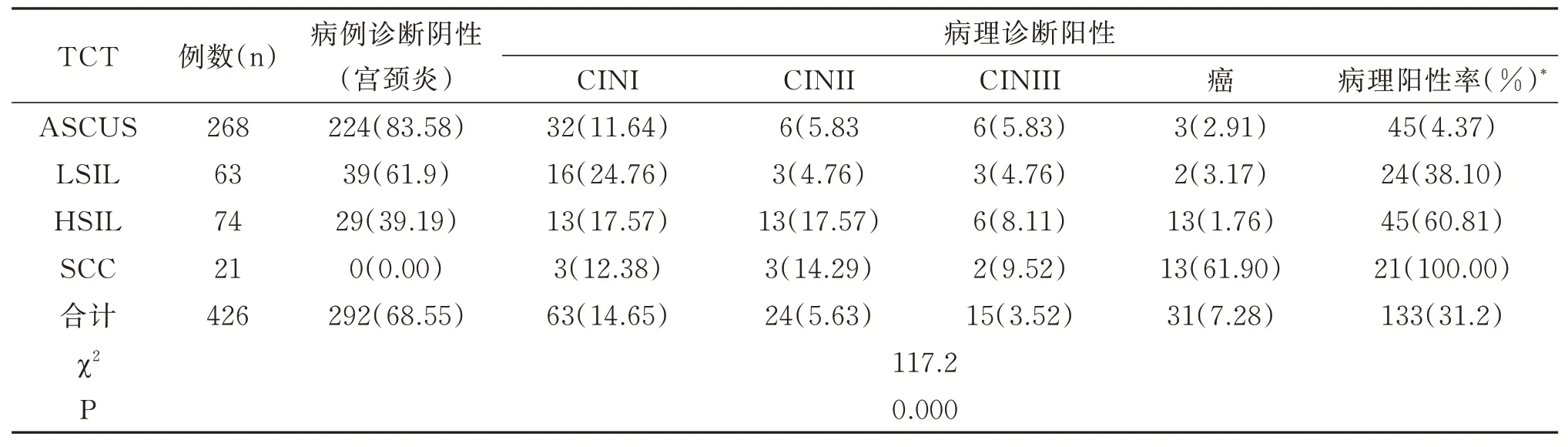
表2 比较TCT 结果与病理诊断阳性率
2.3 比较病理分级与HPV 感染情况
相比于HPV16+或HPV18+,HPV16 及HPV18亚型感染率在不同病例分级(CNⅠ、CNⅡ、CNⅢ、SCC)中明显升高(P<0.05)。见表3。

表3 比较病理分级与HPV 感染情况
2.4 高危型HR‐HPV 感染与TCT 检测异常的比较
宫颈炎组中HR⁃HPV 阳性77例,感染率36.15%,宫颈CIN 组中HR⁃HPV 阳性58例,感染率73.41%,宫颈浸润癌组中HR⁃HPV 阳性31例,感染率91.12%,提示宫颈病变病理级别与高危型HPV 感染率呈正比(P<0.05)。见表4。
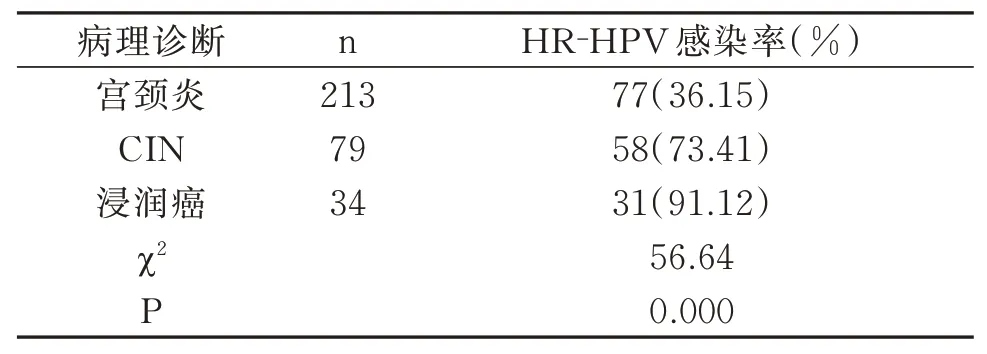
表4 高危型HR‐HPV 感染与TCT 检测异常的比较
2.5 比较TCT 结合HR‐HPV 基因检测
TCT+HR⁃HPV 检测的阴性预测值均高于单独的T CT 和HR⁃HPV 检测。见表5。
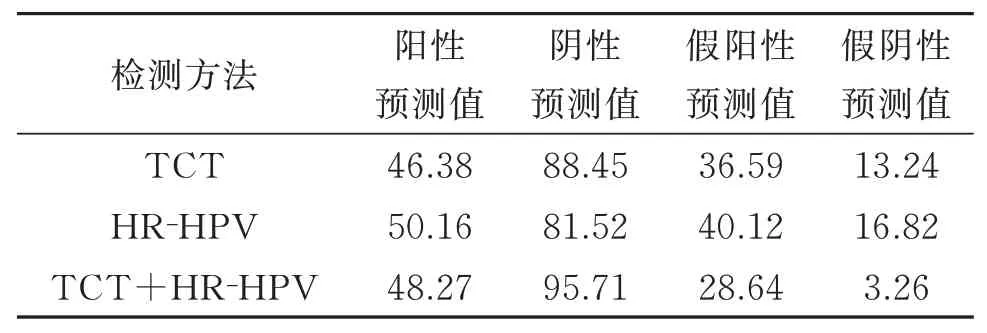
表5 比较TCT 结合HR‐HPV 检测
2.6 ROC 曲线分析
TCT+HR⁃HPV 检测敏感度及特异度均高于单独的TCT 和HR⁃HPV 检测,两种方法联合检测敏感度及特异度均最高。见图1。

图1 TCT、HR‐HPV 和 TCT+HR‐HPV ROC 曲线分析
2.7 HPV 基因型与宫颈病变的相关性分析
以16、18、31、35、39、45、51、58、68、73 及82分型,进行相关性分析,其中16、18、31、58、73 及82 密切相关(P<0.05)。见表6。
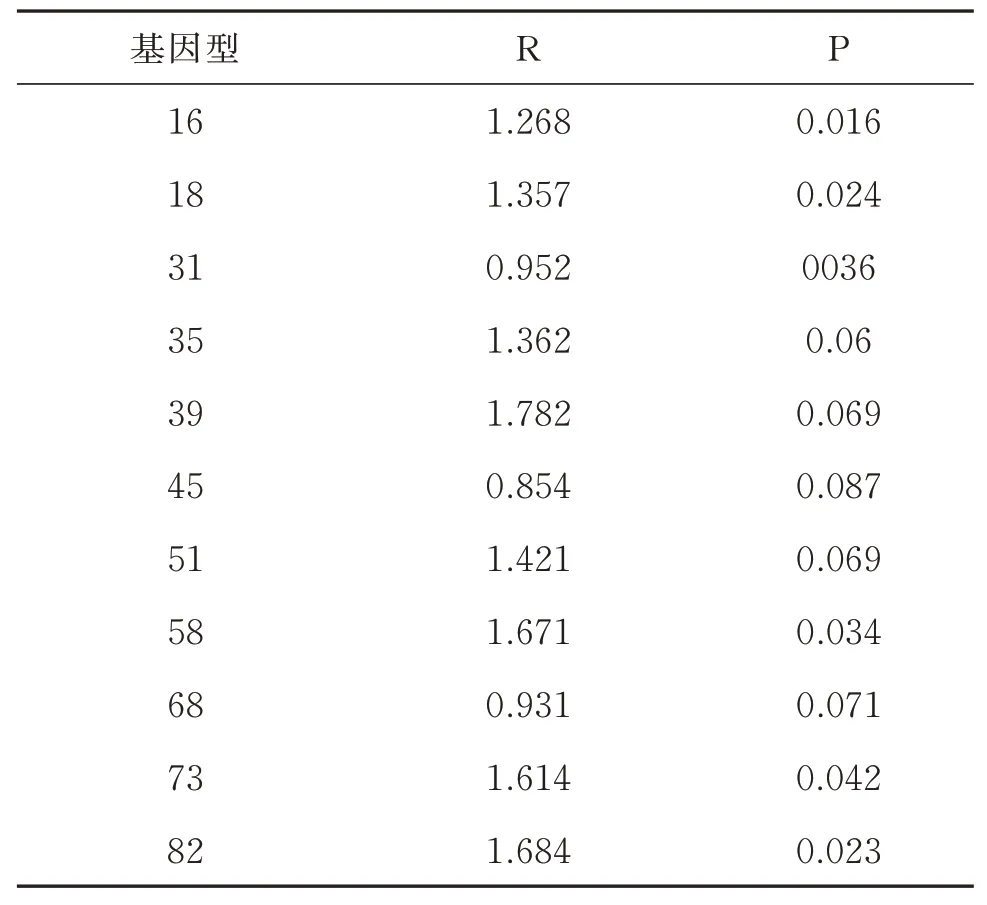
表6 HPV 基因型与宫颈病变的相关性分析
3 讨论
宫颈病变是我国女性中常见的妇科疾病,癌变的可能性极大,长时间的HR⁃HPV 感染在宫颈癌的发展中起主要作用,高危型HPV 感染累计一定程度发展为宫颈原位癌。一些研究已经报道了感染程度与HPV 类型特异性,持续存在相关联的灵敏度损失,而另一些则未表示出此相关性。这些差异可能是HPV 检测方法差异,因此,早期诊断和及时治疗宫颈癌病变对于宫颈癌筛查尤为重要。几种技术用于筛查宫颈癌,例如视觉检查,阴道镜检查和宫颈抹片检查,但是这些技术在检测癌前病变方面具有较低或中等的临床敏感性[6,7]。相反,基于实时PCR 的HPV 基因组检测具有很高的灵敏度,而TCT 的明显优势在于大大减少了阻碍视线的血液、粘液和炎细胞数量,提高筛查的准确率[8,9]。本研究TTC 分型为SCC 中HR⁃HPV 感染率较高,采用HR⁃HPV 筛查可发现部分宫颈癌患者。然而,宫颈癌HR⁃HPV 筛查目的不是证实癌变患者HR⁃HPV 高感染率,而是在疾病早期发现更多的癌前病变患者,为后期治疗争取时间。
本研究发现,30~65岁组和>65岁组HR⁃HPVS阳性率升高,>65岁组L⁃HPV 阳性率降低,与21~29岁组比较,30~65 岁组、>65岁组HR⁃HPV 阳性率均升高。TCT 检查宫颈病变级别的增高,病理阳性率随之增加。有研究显示,<20 岁组HR⁃HPV 感染率较高,但多为单次一过性HPV 感染阳性,无长期持续性感染,其组织学病理诊断多为阴性[10,11],相比于HPV16+或HPV18+,HPV16 及HPV18 亚型感染率在不同病例分级(CNⅠ、CNⅡ、CNⅢ、SCC)中明显升高,说明宫颈病变病理级别与高危型HPV感染率呈正比趋势,TCT+HR⁃HPV 检测的阴性预测值均高于单独的TCT 和HR⁃HPV 检测,TCT+HR⁃HPV 检测敏感度及特异度均高于单独法,而联合检测的敏感度及特异度均最高。同时,16、18、31、58、73及82基因型与宫颈病变密切相关。有结果显示[12],宫颈病变等级与HPV 感染率以及TCT 阳性率呈正比。HPV 感染和宫颈癌的相对风险达到307.5。我们的研究结果与先前的研究一致。也有研究表明[13],HR⁃HPV 检测宫颈病变的敏感性和特异性分别为91.91%和84.46%。相比之下,细胞学检查的相应结果为80.51% 和83.12%。同时,TCT 结果与宫颈病变等级之间存在等级相关性。根据这些结果,HR⁃HPV 载量在诊断宫颈病变方面具有比TCT 更高的特异性,但敏感性更高[14⁃16]。此外,一项基于RCT 结果的荟萃分析发现,HPV检测结果阴性的女性宫颈癌的发病率明显降低。阴道镜检查程序与宫颈筛查有关的潜在不良反应包括疼痛,出血,分泌物和焦虑症。采用HPV 检测可提高其特异性和阳性预测价值,并减少对患者的不必要伤害。本结果显示TCT 联合HPV 分型检测对宫颈病变的假阴性率较低,灵敏度更高,与先前研究结果相符。HPV 作为分流检查的依据是在阴道镜转诊之前根据细胞学检查结果异常的人进行的,以排除更多低危人群,从而减少了侵入性手术的机会,并为患者节约了医疗费用。
目前,我国宫颈筛查计划以“三步走”策略实施,包括TCT,HPV 检测和阴道镜检查,并且以多种方式进行,针对不同人群采用不同的筛查策略。其旨在以最低的成本筛查异常病例,并根据当地情况选择最佳的筛查方法,可以在有限的医疗费用下为大多数女性带来最大的收益[17,18]。因此,基层医院应扩大宫颈的筛查范围,为低成本筛查策略提供更多选择。本研究也存在一定的局限性,纳入的病例数有限,后期还需多中心、多样本例数进行验证,已得到更加可靠的结果。
综上所述,联合筛查明显提高诊断的灵敏度,漏诊率明显降低。HPV 在宫颈癌筛查中能够为临床早期筛查提供理论基础,并尽早发现宫颈癌前期诱因。
