两种腔镜入路治疗较大体积肾上腺肿瘤的疗效分析
2022-08-15徐秀民左泽平宇洪涛王月生谢友弟朱金海钱俊杰王一行
徐秀民,左泽平,龚 强,宇洪涛,王月生,谢友弟,朱金海,钱俊杰,王一行,周 军,吴 俊,李 玮,杨 超
(1.铜陵市人民医院泌尿外科,安徽 铜陵,244000;2.安徽医科大学第二附属医院泌尿外科)
腹腔镜手术治疗肾上腺肿瘤始于上个世纪九十年代,具有手术切口小、术中副损伤少、出血量少、术后康复快等优势,已成为目前微创治疗肾上腺肿瘤的首选方式[1-3]。临床行腹腔镜肾上腺肿瘤切除术时,较小的肿瘤多经后腹腔镜三层面或单层面入路切除;体积较大的肿瘤,需根据肿瘤位置、性质、毗邻情况及术者手术偏好等采取不同的入路[4-5]。本文通过回顾分析48例腹腔镜下两种不同入路治疗直径>5 cm的肾上腺肿瘤患者的临床资料,探讨其临床疗效及安全性。
1 资料与方法
1.1 临床资料 选取2017年1月至2021年8月收治的48例肾上腺肿瘤直径≥5 cm的患者。入选标准:(1)肾上腺原发肿瘤;(2)肾上腺CT检查示瘤体直径≥5 cm;(3)影像学检查无邻近脏器侵犯或远处转移。排除标准:(1)患有严重基础疾病无法耐受手术;(2)有腹部或腹膜后手术史;(3)瘤体巨大,不适合腔镜手术。术前患者均行肾上腺CT平扫+增强确诊,同时完善肾上腺相关内分泌检查:促肾上腺皮质激素、血皮质醇、肾素、血管紧张素Ⅰ、血管紧张素Ⅱ、立卧位血醛固酮、儿茶酚胺、电解质等,肿瘤性质经影像学及肾上腺内分泌检查初步明确。48例患者按手术入路分为两组,腹膜后组(n=24)与经腹腔组(n=24),其中男16例,女32例,22~75岁,平均(51.08±10.99)岁。肿瘤位于左侧25例,右侧23例,瘤体直径平均(6.51±1.22)cm。两组患者性别、年龄、肿瘤直径、肿瘤位置及BMI差异无统计学意义(P>0.05),具有可比性,见表1。
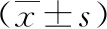
表1 两组患者临床资料的比较
1.2 手术方法 经腹膜后组:全身麻醉后留置导尿管,患者取健侧卧位,腰部垫高,抬高腰桥;腋后线12肋下切开皮肤约1.5 cm至皮下脂肪层,血管钳钝性撑开肌层至腰背筋膜下,手指伸入腹膜后间隙钝性分离,推开腹膜;自制手套气囊置入腹膜后腔,充气500 mL,持续约2 min后退出,在手指引导下,于腋前线11肋缘下穿刺5 mm或12 mm Trocar,腋中线髂嵴上约1.5 cm处穿刺12 mm Trocar作为腔镜通道,腋后线12肋下穿刺12 mm Trocar后用7号丝线缝合密闭切口并固定;连接气腹管,压力维持在12~14 mmHg,置入30°腹腔镜,观察后腹腔有无副损伤,超声刀清理腹膜后脂肪靠背侧打开Gerota筋膜(图1);以腰大肌作为解剖标志,沿肾上腺3个相对无血管层面分别游离背侧、腹侧、肾上极,充分暴露肿瘤,沿瘤体包膜表面用超声刀进行游离,寻及中央静脉后用Hem-o-lok双重夹闭离断,完整切除肿瘤;术中游离腹侧面时注意避免损伤腹膜,左侧操作时注意避免损伤胰尾、脾脏及胸膜;右侧操作时注意避免损伤下腔静脉、十二指肠降段,适当延长手术切口取出标本[6]。再次检查手术区域无明显出血后,取出标本,于腔镜通道留置引流管并固定,逐层缝合关闭手术切口。经腹腔组:全身麻醉后留置导尿管,患者取60°~70°健侧卧位,Veress针穿刺脐部建立气腹。左侧采用3枚Trocar,取左侧腹直肌旁平脐水平处切开皮肤约1.5 cm,穿刺12 mm Trocar作为腔镜通道,连接气腹管,压力维持在12~14 mmHg,置入观察镜,观察腹腔脏器有无副损伤;直视下分别于左锁骨中线髂前上棘内上方约3 cm处、左肋缘下腹直肌外缘穿刺12 mm或5 mm Trocar;肿瘤位于右侧时,Trocar位置与左侧相反,多数情况下需于剑突下增加一个5 mm Trocar作为辅助通道,持针器钳夹侧腹膜向上挑起肝脏,充分暴露手术视野。超声刀打开结肠旁沟,左侧离断脾结肠韧带,右侧离断肝结肠韧带,将结肠向内下侧游离(图2)。沿瘤体包膜分离肾上腺周围组织,寻及中央静脉用Hem-o-lok双重夹闭离断,完整切除肿瘤;术中左侧操作时注意避免损伤胰尾及脾脏,右侧注意避免损伤十二指肠及腔静脉,肿瘤靠近肾门时注意避免损伤肾蒂血管,根据瘤体大小适当延长手术切口取出,留置腹腔引流管并固定,退出腔镜及Trocar,逐层缝合关闭手术切口。
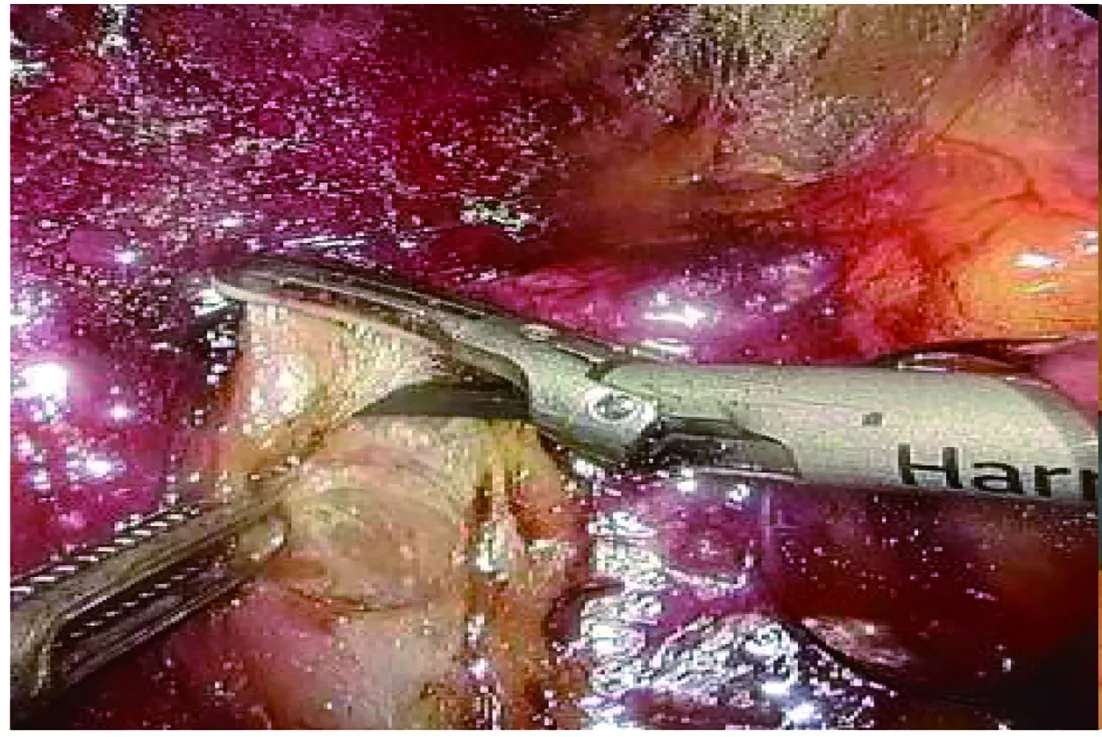
图1 清理腹膜外脂肪后超声刀靠背侧纵行打开Gerota筋膜显露腰大肌
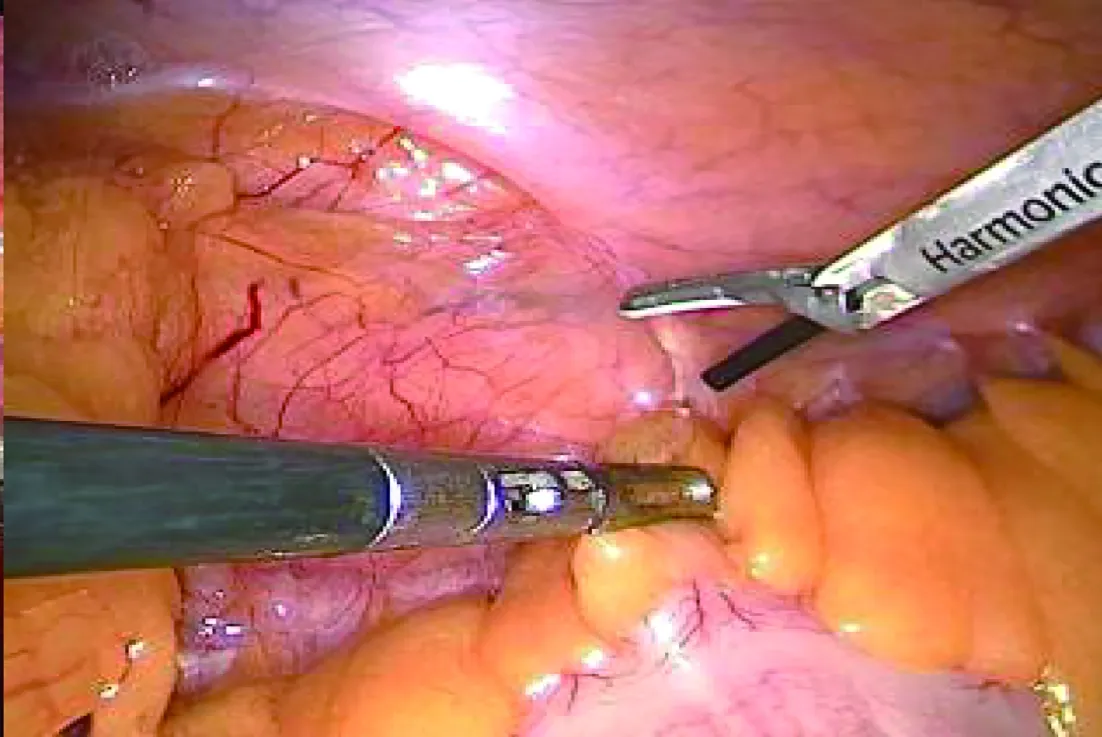
图2 超声刀打开结肠旁沟,将结肠游离后向内下侧牵拉
1.3 观察指标 观察两组手术时间、术中出血量、术中皮下气肿例数、术中瘤体破裂例数、术后引流管保留时间、术后首次肠道通气时间、术后住院时间。
2 结 果
2.1 临床疗效 患者均顺利完成腔镜肾上腺肿瘤切除术,术中无邻近脏器副损伤、输血病例及中转开腹,术后无继发大出血、感染、肾上腺危象、肿瘤复发等并发症发生。两组术中出血量、术后住院时间差异无统计学意义(P>0.05)。引流管基本于术后2~4 d内拔除,两组引流管放置时间差异无统计学意义(P>0.05)。腹膜后组术中出现瘤体包膜破裂6例(4例髓质脂肪瘤,2例肾上腺囊肿),经腹腔组术中出现瘤体包膜破裂1例,两组差异有统计学意义(P<0.05)。腹膜后组出现5例皮下气肿,高于经腹腔组(P<0.05)。总体手术时间长于经腹腔组(P<0.05),在体型肥胖、瘤体较大的患者中,手术时间明显延长。后腹腔组通气时间早于经腹腔组(P<0.05)。见表2。
表2 两组患者围手术期观察指标的比较
2.2 随访及预后 术后1~3个月复查促肾上腺皮质激素、血皮质醇、肾素、血管紧张素Ⅰ、血管紧张素Ⅱ、立卧位血醛固酮、儿茶酚胺、电解质未见明显异常,预后良好。
3 讨 论
肾上腺解剖位置深,周围毗邻重要的大血管及脏器,具有血供丰富、组织包膜脆弱等特点,术中游离过程中容易发生损伤出血导致严重并发症。虽然传统开放手术存在手术视野显露困难、创面大、出血多、康复慢、术后并发症多等不利因素,但对于巨大肾上腺肿瘤或有邻近器官累及的患者,开放手术仍是重要的手术方式[7]。随着腹腔镜医疗设备的更新换代、3D腹腔镜及超高清腹腔镜系统的临床应用,超高清成像系统可将手术区域放大数倍,增加了视野清晰度,避免了术中不必要的副损伤,缩短了手术时间。近年,随着腹腔镜技术的进展及临床实际应用水平的提高,在复杂性泌尿系疾病中的应用也取得了较大的成功[8-10]。两种腹腔镜入路有各自的优势与不足。腹膜后组术中瘤体破裂例数多于经腹腔组,经后腹腔相较经腹腔入路操作空间小,对于较大的肿瘤,操作空间有限,部分肿瘤在分离过程中受到挤压可能导致包膜破裂,在肿瘤质地较脆(如髓质脂肪瘤、肾上腺囊肿)的患者中更容易发生。经腹腔入路术中解剖标志清晰,手术视野层次清晰,肿瘤显露较容易,手术出血更容易控制,同时可获得理想的操作空间进行充分分离,避免肿瘤在游离过程中破裂导致种植性转移。腹膜后组皮下气肿例数多于经腹腔组,考虑可能因部分患者腋后线12肋下的Trocar深层组织缝合不严密、气体经软组织间隙曼延所致,严重时气肿可曼延至颈胸部,术中监测血CO2分压明显升高,一般不影响术中操作及患者生命体征,患者多于术后第1天恢复正常。腹膜后组手术时间长于经腹腔组,后腹腔入路操作空间较小,绝大多数需常规清理腹膜外脂肪,对于体型较肥胖的患者,清理脂肪时间明显延长。瘤体较大及靠近肾门血管时,分离可能导致瘤体包膜破裂、周围血管损伤、腹膜穿孔,造成瘤体表面渗血、视野模糊、操作空间受限,一定程度上增加了手术难度[11]。经腹腔入路操作空间大,手术视野层次清晰,解剖标志清楚,可获得理想的操作空间进行充分游离,手术出血更容易控制,可较早显露邻近脏器处理中央静脉,对于双侧病变者亦可同期处理[12-13]。腹膜后组术后首次通气时间早于经腹腔组,经腹腔入路术中对肠道的游离、牵拉导致术后胃肠道功能恢复慢,术后首次通气时间延长[14]。经腹膜后入路因腹膜对腹腔消化道脏器的遮挡,术中避免了对肠道分离、牵拉的操作,对术后肠道功能恢复基本无影响,但缺点是经腹膜后操作空间有限,较经腹腔操作空间小,游离暴露较大瘤体时较为困难[7,15]。
根据我们的临床经验,不论选择何种腔镜手术入路,术中均应解剖层次清晰,避免发生不必要的副损伤;一般肿瘤与正常肾上腺组织交界处较脆弱,切勿用力牵拉撕扯,游离出部分正常肾上腺组织后可用Hem-o-lok夹闭离断,以保留正常肾上腺组织(图3)。此外,游离肿瘤过程中尽量不要直接钳夹肿瘤或包膜,适当提起肿瘤周围的脂肪组织,沿肿瘤包膜与脂肪之间的间隙细致分离,避免暴力牵拉,以免瘤体破裂出血增加操作难度[16]。对于术前高度怀疑嗜铬细胞瘤、瘤体巨大(直径>10 cm)的患者,建议采用经腹入路,一方面可更好地获得操作空间,另一方面可较早控制肿瘤血供、缩短手术时间。分离肿瘤时更应小心谨慎,避免过度挤压瘤体释放儿茶酚胺引起术中血压波动造成严重并发症。在恶性肿瘤根治方面,经腹腔入路较腹膜后入路同样具有操作空间大、早期控制瘤体血供的优势,一定程度上避免了肿瘤挤压破裂种植转移及血行转移的风险。当肿瘤位置较低、靠近肾门血管时,需充分显露肿瘤周围的重要血管及脏器(图4),避免因术中解剖层次不清导致重要血管、邻近脏器损伤[17]。得益于近年来腔镜医疗器械、技术水平的发展,在腰腹联合入路、机器人辅助腔镜手术治疗巨大肾上腺肿瘤方面也取得较大的成功[18-20]。
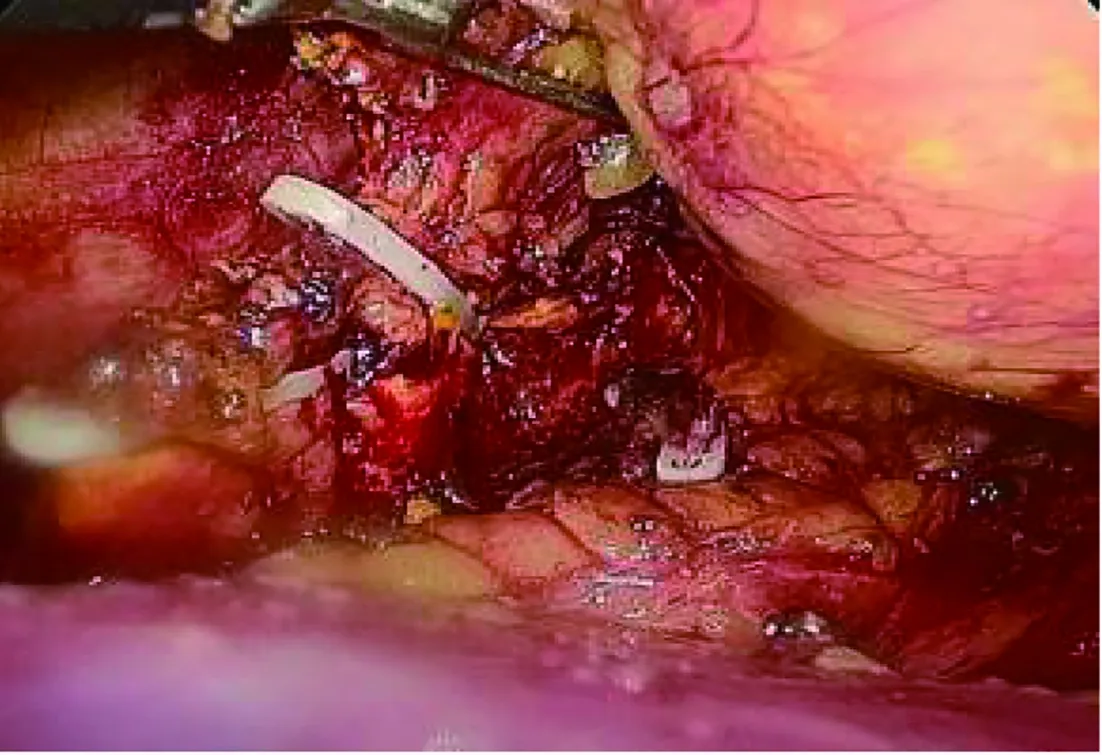
图3 游离正常肾上腺组织后用Hem-o-lok夹闭离断,保留部分正常肾上腺组织
综上,经后腹腔与经腹腔入路切除较大体积肾上腺肿瘤均是可选择的入路,实际工作中术者应根据患者的个体特征、医院设备条件及术前影像学检查综合评估[21]。同时术前应明确肿瘤性质、大小及邻近脏器、血管的关系,在临床实践中积累经验,提高手术技能,以期取得最佳的临床疗效。
