重组恶臭假单胞菌转化乙二醇-乙酸共底物合成单鼠李糖脂
2022-08-13辛开元何美霖罗云鹏刘豪杰钱秀娟董维亮
辛开元,何美霖,罗云鹏,刘豪杰,周 杰,3,钱秀娟,董维亮,3
(1.南京工业大学 生物与制药工程学院 废塑料生物催化解聚与循环利用重点实验室,江苏 南京 211800;2.南京工业大学 2011学院,江苏 南京 211800;3.南京工业大学 材料化学工程国家重点实验室,江苏 南京 211800)
废弃塑料化学解聚和生物解聚产物多为小分子酸/醇等的混合体系,存在分离困难、附加值低、难以再加工等不足[1-2]。若能结合合成生物学技术与发酵工程技术将废弃塑料单体进行高值转化,发展未来发酵行业新的原料替代方案,这对于提升塑料回收过程的经济效益和生态效益都具有重要意义[3-4]。
小分子二元醇是很多废弃塑料生物解聚后的单体成分,乙二醇(EG)作为PET塑料的主要解聚物之一,解析其微生物代谢机制、建立生物基产品合成路径是近年来EG高值化回收的热点研究路线[5-8]。2012年,Mückschel等[9]通过适应性进化筛选获得了可以利用EG的突变菌PseudomonasputidaJM37,并首次解析了EG微生物代谢机制。EG首先在周质吡咯并喹啉醌(PQQ)依赖性酶(PedE、PedH)的催化下转化为乙醇醛(glycolaldehyde,GA),接着在胞质醛脱氢酶PP_0545和PedI的作用下生成乙醇酸,继而在膜锚定的乙醇酸氧化酶GlcDEF的作用下生成乙醛酸。理论上,乙醛酸可以通过乙醛酸循环结合乙酰辅酶A生产苹果酸进而进入柠檬酸循环,但在P.putida模式菌株KT2440中,乙酰辅酶A的供给不足导致乙二醇无法作为菌株培养的唯一碳源。在突变菌P.putidaJM37中,乙醛酸可以通过诱变激活途径——乙醛酸醛连接酶(glyoxylate carboligase,GCL)途径,在GCL催化下生成酒石酸半醛,随后在羟基丙酮酸异构酶(Hyi)和酒石酸酯半醛还原酶(GlxR)的作用下生成甘油酸,进而转化为2-磷酸甘油酸进入糖酵解途径,转化为乙酰辅酶A。一部分乙酰辅酶A直接进入柠檬酸循环,另一部分则与前期代谢中间产物乙醛酸缩合生成苹果酸,通过乙醛酸途径进入柠檬酸循环。因此,突变菌P.putidaJM37可以利用EG作为唯一碳源生长,但利用能力仍非常低下。基于EG同化分子机制的研究基础,Franden等[5]通过过量表达hyi、glxR、ttuD和pykF等基因,在P.putidaKT2440中构建了用于EG代谢的GCL途径,实现了P.putidaKT2440对EG的快速利用,但由于GCL途径和TCA循环的碳损失量巨大,导致EG为发酵底物转化合成产物如聚羟基脂肪酸(PHA)的碳得率非常低,只有0.06 g/L。
GCL途径促进EG利用的主要原因可能是为菌株的代谢提供了乙酰辅酶A来源。乙酰辅酶A不足,EG代谢中间产物乙醛酸无法进一步转化,同时乙酰辅酶A也是重要的初级代谢产物,参与微生物的多种代谢活动[10]。因此,若能利用乙酰辅酶A直接前体如乙酸(AC)作为碳源进行共底物发酵,或将有效提高EG的微生物转化效率。
P.putidaKT2440是GRAS认证环境安全的假单胞菌属模式菌种[11],遗传背景清晰,产物的生物合成过程不受细胞群体感应的影响,并且具有出色的降解环境污染物以及在恶劣条件下的强大生存能力,是生物修复、代谢工程和生物催化的理想细胞底盘[12-14]。本研究选用P.putidaKT2440为底盘,通过设计EG-AC共底物发酵策略,并构建单鼠李糖脂(mono-RL)合成途径,建立EG完全同化合成mono-RL生物路线,以期为塑料解聚产物的生物法高值再造提供借鉴。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
本研究中使用的底盘菌株P.putidaKT2440由南京农业大学崔中利教授提供,鼠李糖脂合成菌株P.aeruginosaPAO1、P.aeruginosaKT1115和质粒pBBRmcs-5,保藏于南京工业大学废塑料生物催化解聚与循环利用重点实验室;自制鼠李糖脂标样。
1.1.2 培养基和主要试剂的配制
基础LB 液体培养基(g/L):NaCl 10.0、蛋白胨 10.0、酵母粉 5.0。在 121 ℃条件下高压灭菌 15 min,用作遗传改造筛选培养基以及种子培养。
M9培养基(g/L):NaNO37.7、NaCl 1.0、KCl 0.1、CaCl20.01、KH2PO43.5、Na2HPO43.5、MgSO40.26、FeSO40.001。根据实验需求添加碳源,利用2 mol/L NaOH和2 mol/L HCl调节初始pH为7.0。
菜籽油培养基(g/L):菜籽油 60.0、NaNO37.7、NaCl 1.0、KCl 0.1、CaCl20.01、KH2PO43.5、Na2HPO43.5、MgSO40.26、FeSO40.001、酵母粉 0.5、FeCl30.08、ZnSO40.75、CuSO40.075、MnSO40.75、H3BO30.15。利用2 mol/L NaOH和2 mol/L HCl调节初始pH为7.0。
硝酸盐培养基(g/L):NaNO36.0、酵母膏3.0、KH2PO41.0、Na2HPO41.0、CaCl2·2H2O 0.1、MgSO40.1。据实验需求添加碳源,利用2 mol/L NaOH和2 mol/L HCl调节初始pH为7.0。
1.2 方法
1.2.1 微生物利用EG情况
将-80 ℃保存的P.putidaKT2440接种至5 mL LB试管,置于30 ℃、180 r/min恒温摇床振荡培养12 h,按1%(体积分数)的接种量转接至50 mL LB培养基培养12 h后,按10%接种量接种于含50 mL M9培养基的摇瓶中,根据实验需要添加不同浓度的EG或EG与AC共底物作为碳源,发酵过程每24 h取样测定细胞生长、底物消耗与代谢中间产物积累情况。
1.2.2 EG与GA的细胞毒性分析
LB培养基过夜培养的P.putidaKT2440按1%接种量接种至20 mmol/L葡萄糖为碳源的M9培养基中,并在培养基中分别添加不同浓度的EG(0、20、40、60和80 mmol/L)和GA(0、2、4、6和8 mmol/L),通过对细胞生长情况的检测,分析EG和GA的细胞毒性。
1.2.3 Mono-RL合成菌株构建
以铜绿假单胞菌P.aeruginosaPAO1和P.aeruginosaKT1115基因组为模板,设计引物rh1IRBA-F:5-C ̄C ̄C ̄G ̄T ̄C ̄C ̄T ̄G ̄T ̄G ̄A ̄A ̄A ̄T ̄C ̄T ̄G ̄G ̄C ̄A-3′,rh1IRBA-R:5′-G ̄A ̄G ̄C ̄A ̄T ̄G ̄C ̄G ̄G ̄C ̄A ̄G ̄G ̄A ̄G ̄A ̄A ̄G ̄C ̄G-3′,扩增mono-RL合成基因簇rh1IRBA,对克隆的片段进行测序无误后,利用一步克隆引物rh1IRBA-F′:5′-G ̄A ̄C ̄T ̄C ̄A ̄C ̄T ̄A ̄T ̄A ̄G ̄G ̄G ̄C ̄G ̄A ̄A ̄T ̄T ̄G ̄G ̄A ̄G ̄C ̄T ̄C ̄C ̄C ̄G ̄T ̄C ̄C ̄T ̄G ̄T ̄G ̄A ̄A ̄A ̄T ̄C ̄T ̄G ̄G ̄C ̄A-3′,rh1IRBA-R′:5′-C ̄G ̄G ̄T ̄A ̄T ̄C ̄G ̄A ̄T ̄A ̄A ̄G ̄C ̄T ̄T ̄G ̄A ̄T ̄A ̄T ̄C ̄G ̄A ̄A ̄T ̄T ̄C ̄G ̄A ̄G ̄C ̄A ̄T ̄G ̄C ̄G ̄G ̄C ̄A ̄G ̄G ̄A ̄G ̄A ̄A ̄G ̄C ̄G-3′,对回收片段进行二次扩增(rh1IRBA-F′引物5′端引入pBBRmcs-5质粒SacⅠ酶切位点上游26 bp作为一步克隆用同源臂,rh1IRBA-R引物5′端引入pBBRmcs-5质粒EcoR Ⅰ酶切位点下游28 bp作为一步克隆用同源臂)。
表达载体pBBRmcs-5 经SacⅠ和EcoRⅠ双酶切后,与2种不同来源rh1IRBA基因片段通过一步克隆连接获得pBBRmcs-5-rh1IRBA-1(来源于P.aeruginosaPAO1)和pBBRmcs-5-rh1IRBA-2质粒(来源于P.aeruginosaKT1115),电转化至P.putidaKT2440中,感受态细胞在30 ℃、200 r/min摇床孵育1 h后,稀释涂布在含30 μg/L的庆大霉素的LB固体培养基上,30 ℃过夜培养获得重组菌株P.putidaKT2441(来源于P.aeruginosaPAO1)和P.putidaKT2442(来源于P.aeruginosaKT1115)。
1.2.4 EG、AC、GA浓度测定
EG浓度测定:将适当稀释后的0.1 mL发酵液加入1 mL乙腈中,添加0.3 g无水Na2SO4用于去除发酵液中水分,振荡混匀后,静置吸取上层有机相,并通过滤膜过滤,滤液用于气相色谱分析,检测条件:140 ℃维持5 min后,以4 ℃/min升温至230 ℃并维持8 min,分流比为100∶1的He作为载气,进样口温度为260 ℃。
AC浓度测定:1.5 mL发酵液10 000 r/min离心5 min,上清液稀释适当倍数后,经滤膜过滤,用于高效液相色谱分析。流动相为0.25 g/L 稀H2SO4,检测条件为柱温55 ℃、流速1 mL/min、检测波长215 nm。
GA浓度测定:利用酚试剂能与酚类和醛类化合物反应生成有色化合物的原理对GA进行检测[15]。将15 μL 10 g/L的3-甲基-2-苯并噻唑啉酮腙盐酸盐水合物与75 μL甘氨酸-HCL缓冲液混合,并加入10 μL发酵上清液形成衍生物1,取100 μL所得待测样品加入750 μL FeCl3溶液以及150 μL去离子水形成衍生物2,测定其在630 nm处的吸光值,根据GA浓度标准曲线计算发酵液中的GA含量。
1.2.5 发酵液中mono-RL的提取、定性与定量检测
发酵液在4 ℃、10 000 r/min离心20 min,保留上清液,调节pH至1.5,于4 ℃冰箱放置12 h后,4 ℃、10 000 r/min离心20 min,保留沉淀,并用pH 2.0的盐酸溶液重复洗涤沉淀3次。随后,用3 mL氯仿-乙醇溶液(体积比为2∶1)对沉淀重复萃取3次,合并收集的有机相,经冷冻干燥后获得的粉末即为mono-RL粗提物,用于薄层色谱法(TLC)分析。
TLC定性检测:将mono-RL粗提物溶于乙酸乙酯,取5 μL溶液点在TLC硅胶板上。对照组为单双鼠李糖脂混合物,展开剂为氯仿-甲醇-乙酸(三者的体积比为65∶15∶2),显色剂为80%(体积分数)的浓H2SO4。将干燥的硅胶板在80 ℃下孵育30 min 后测定比移值(Rf)。
质谱分析(MS):分离纯化后的mono-RL样品溶于甲醇溶液,制备成1 mg/mL的RLs甲醇溶液。检测流动相由A相(甲酸-甲醇溶液(体积比为1∶1 000))和B相(甲酸-乙腈溶液(体积比为1∶1 000))组成,流速为0.3 mL/min、柱温为30 ℃、进样量为0.3 μL,使用电喷雾电离质谱(ESI-MS)对RLs进行结构分析,分析条件为阴离子模式、毛细管电压3.5 kV、裂解电压50 V、N2作为脱溶气体,扫描范围为50~1 000m/z。
采用蔥酮硫酸法定量测定mono-RL产量∶精确称取0.2 g 蒽酮溶于100 mL体积分数为80%的浓H2SO4中,获得蒽酮硫酸溶液。取0.5 mL适当稀释后的发酵上清液在冰水浴中加入2 mL蒽酮硫酸溶液,使其充分混合后在沸水浴中反应10 min,再将反应体系放入冰水浴冷却至室温。利用酶标仪测试反应液吸光度,吸收波长为620 nm,基于蔥酮硫酸法测定的鼠李糖标准曲线计算mono-RL浓度(ng/L),空白组为蒸馏水。鼠李糖分子量为164,本研究发酵所获得的单鼠李糖脂经质谱测定主要为Rha-C10-C10,分子量为503,mono-RL质量浓度ρ(g/L)的换算公式为ρ=503n/164(g/L)(n为稀释倍数)。
2 结果与分析
2.1 P. putida KT2440对不同浓度EG利用情况
以不同浓度EG为唯一碳源培养P.putidaKT2440,结果见图1(a)。由图1(a)可知:在发酵前期,有10~20 mmol/L的EG被迅速消耗,菌株生物量有不同程度的增加。当EG起始浓度为60 mmol/L时,P.putidaKT2440在培养24 h左右,OD600从接种时的0.37增长到0.65。但在24 h后,底物不再被消耗且细胞生长停滞。

图1 不同浓度的EG利用情况及代谢物质细胞毒性分析
EG及其代谢中间产物GA具有一定的细胞毒性[16-17],底物和中间代谢物的细胞毒性可能是导致EG无法被继续生物利用的原因之一。因此,考察发酵过程中GA的累积情况,结果见图1(a)。由图1(a)可知:在发酵前期GA迅速积累,当EG浓度分别为60和80 mmol/L时,细胞培养48 h后GA积累量最高分别可达4.3和5.4 mmol/L。
为进一步考察EG和GA对P.putidaKT2440的细胞毒性,考察不同浓度EG和GA对菌株利用葡萄糖的影响,结果见图1(b)和(c)。由图1(b)和(c)可知:不同EG添加量对于菌体利用葡萄糖生长速率没有明显抑制现象,表明EG无显著的细胞毒性。不同GA添加量对于菌体利用葡萄糖生长影响显著,当GA添加量大于6 mmol/L时,菌株生长最高OD600值降低20%,当GA添加量达到8 mmol/L时,菌株生长被完全抑制(图1(c)),表明GA的细胞毒性强大。然而,EG代谢过程中GA的最高积累仅为5.4 mmol/L,未达到细胞最低抑制浓度,由此可见EG和GA的细胞毒性并非导致EG无法继续利用的关键。
2.2 P. putida KT2440利用EG与乙酸共碳源生长情况
基于前期对EG代谢途径的分析发现,乙酰辅酶A供给不足可能是EG无法被微生物持续利用的主要原因。因此,本研究利用乙酸作为乙酰辅酶A的直接供体,以期通过底物共发酵为EG利用提供充足的乙酰辅酶A,结果见图2。
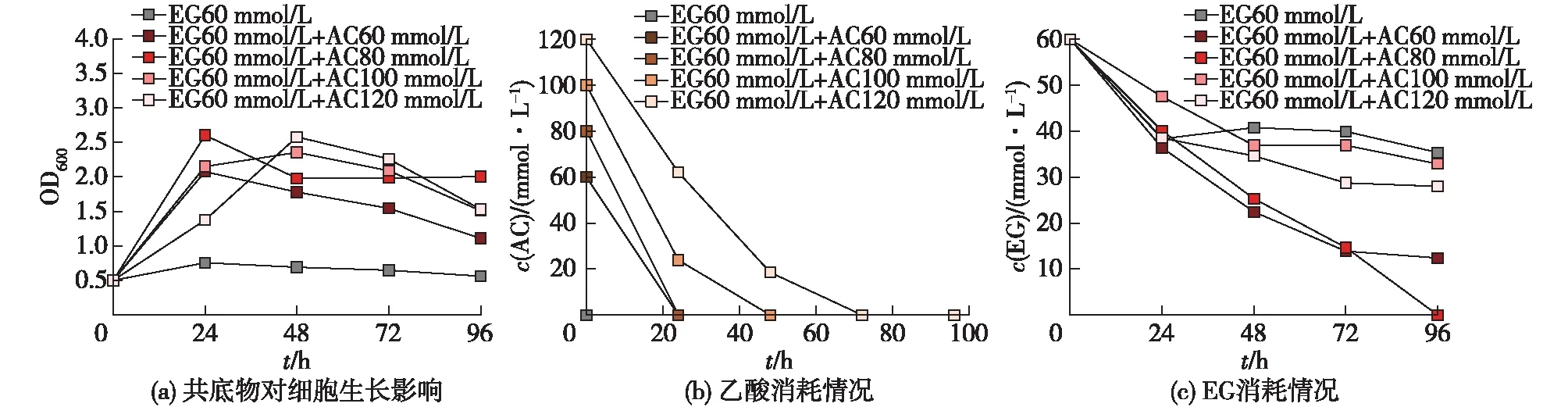
图2 P. putida KT2440利用EG与乙酸共底物发酵考察
由图2可知:60 mmol/L EG与60 mmol/L 乙酸共底物发酵时,乙酸消耗迅速,24 h内被完全耗尽,发酵96 h后,80%的EG被消耗,与EG为唯一碳源相比,其利用率提高1.5倍。当60 mmol/L EG与80 mmol/L 乙酸共底物发酵时,EG在96 h时被完全消耗,摇瓶细胞OD600最高可达2.6。由此可见,与乙酸共底物发酵可以激活EG的利用途径。共底物培养发酵过程调控是强化微生物利用顽固底物的常用策略[18-19],乙酸是木质纤维素水解、合成气发酵、有机废弃物的厌氧消化等过程的产物或副产物,广泛的来源成为多种微生物发酵的理想原料[20-23],因此建立EG与乙酸的共底物发酵体系具有良好的经济和环境效益。乙酸浓度进一步提高也对细胞造成了一定的毒性影响,在120 mmol/L乙酸浓度下细胞的生长速率比100 mmol/L时的降低50%。最终根据细胞生长和底物消耗确定60 mmol/L EG与80 mmol/L 乙酸作为最优共底物比例。
2.3 P. putida KT2440合成鼠李糖脂重组菌株构建
P.aeruginosaPAO1和P.aeruginosaKT1115是鼠李糖脂合成的常用菌株,分别克隆其鼠李糖脂合成基因线路rhlIRBA并组装至P.putidaKT2440中,获得重组菌株P.putidaKT2441和P.putidaKT2442。以菜籽油为底物发酵120 h,考察合成鼠李糖脂重组菌株的性能,结果见图3。由图3可知:P.putidaKT2441最高OD600可达1.49,合成鼠李糖脂产量为5.35 g/L,菜籽油消耗22.17 g/L,鼠李糖脂得率为0.24 g/g;P.putidaKT2442最高OD600可达1.65,合成鼠李糖脂产量为6.56 g/L,菜籽油消耗25.68 g/L,鼠李糖脂得率为0.26 g/g,表明P.putidaKT2442具有更强的鼠李糖脂合成能力。
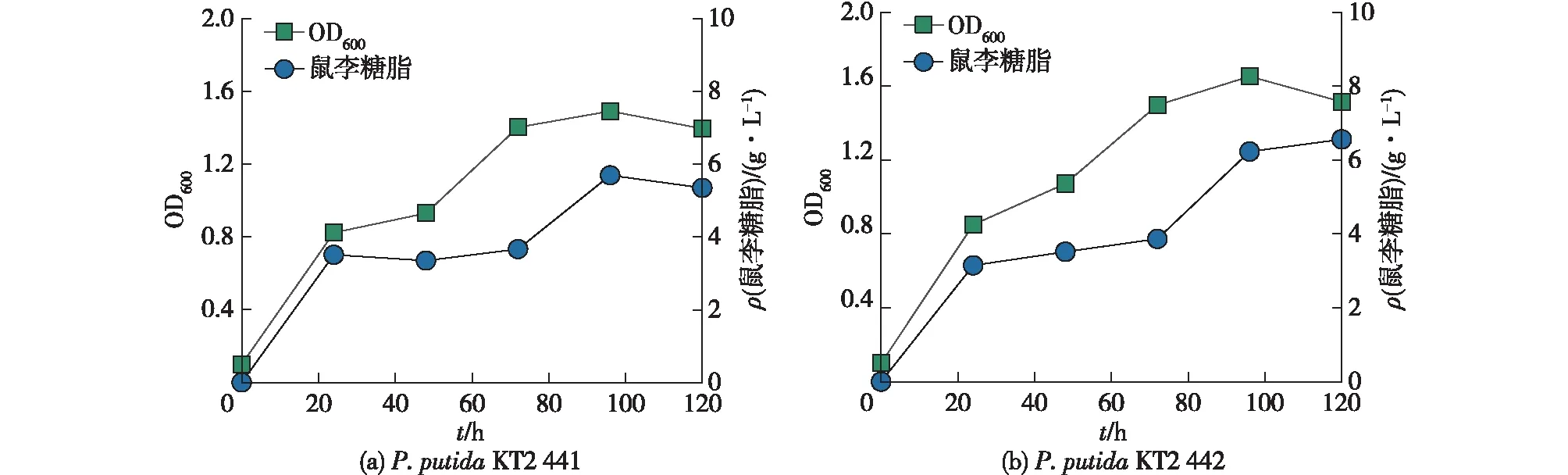
图3 重组菌株P. putida KT2441和P. putida KT2442产鼠李糖脂发酵结果
受铜绿假单胞菌合成绿脓素和严重产泡现象的影响,近年来,通过在恶臭假单胞菌中构建鼠李糖脂合成线路,实现鼠李糖脂的定向、高效合成获得广泛关注。2008年,Cha等[24]通过异源整合高产表面活性剂PseudomonasaeruginosaEMS1的鼠李糖脂合成基因线路,实现重组菌P.putida1067(pNE2)鼠李糖脂合成产量达6.97 g/L。2020年,Tiso等[25]通过在P.putidaKT2440中整合鼠李糖脂合成线路,耦合泡沫循环利用策略,鼠李糖脂产量达1.5 g/L。同年,Raza等[26]以废弃煎炸油为碳源,对鼠李糖脂合成恶臭假单胞菌重组菌进行培养基优化,鼠李糖脂最高产量达4.1 g/L。相较而言,本研究获得的重组菌P.putidaKT2442鼠李糖脂合成能力强大,应用前景广阔。分析P.aeruginosaPAO1和P.aeruginosaKT1115来源的鼠李糖脂合成基因差异发现,基因组中负责调控rhlIRBA表达的转录调控因子RhlI存在3个氨基酸差异位点,HAAs合成酶RhlA存在一个氨基酸差异位点[27],这些氨基酸的差异可能导致鼠李糖脂合成相关酶的活性存在差异,进而影响鼠李糖脂的合成效率。
2.4 EG与乙酸共底物发酵合成鼠李糖脂
P.putidaKT2442以60 mmol/L EG和80 mmol/L乙酸共底物发酵,结果如图4所示。由图4可知:利用M9培养基发酵24 h 后乙酸被完全消耗,细胞生物量达到最大值1.71 g/L,120 h后EG被完全消耗,细胞生物量逐渐降低到0.71 g/L,鼠李糖脂最终产量为0.29 g/L,得率为3.45%(图4(a));当利用以NaNO3为氮源的硝酸盐培养基时,细胞生长和底物消耗趋势与M9培养基相当,而鼠李糖脂最终产量可达0.46 g/L,得率为0.055 g/g(图4(b)),比M9培养基的结果提升显著,表明氮源发酵调控可有效促进鼠李糖脂的生物合成。

图4 P. putida KT2442利用EG与AC共底物发酵合成鼠李糖脂
进一步对合成的鼠李糖脂产物进行鉴定,结果见图4(c)和(d)。由图4(c)可知:对照组为单/双鼠李糖脂混合物,单双鼠李糖脂的Rf值分别为0.75和0.28;而P.putidaKT2442利用共碳源合成的产物成分单一,Rf值为0.758,与mono-RL的Rf值一致。由图4(d)可知:产物的质谱分析显示只有1个高强度的离子峰503.3m/z,与mono-RL(Rha-C10-C10)理论分子量(503)一致,其他峰值占比非常低,可能为不同脂肪链长度的mono-RL。
目前,市售的鼠李糖脂产品多为P.aeruginosa发酵合成,由于糖基数和脂肪酸链差异多为不同结构的混合物,如P.aeruginosaKT1115合成鼠李糖脂为单糖基和双糖基的混合物[28]。本研究构建的重组菌株P.putidaKT2442,只引入了mono-RL合成线路,实现了以EG与乙酸共底物合成结构单一的mono-RL(Rha-C10-C10),简化了下游分离与纯化工艺,合成过程经济效益高。此外,mono-RL具有优异的亲油特性和乳化活性,因此其在提高疏水性有机污染物的生物可利用性、乳化驱油等方面应用前景广阔[29]。
3 结论
乙酰辅酶A不足是EG难以作为唯一发酵碳源的主要原因。通过与乙酸共底物发酵可以强化EG的生物利用,当EG与乙酸浓度比为3∶4时,EG在96 h时被完全消耗,细胞OD600最高可达2.6。进一步引入P.aeruginosa来源的mono-RL合成基因线路rh1IRBA,重组菌株P.putidaKT2442利用菜籽油合成鼠李糖脂产量为6.56 g/L,得率为0.26 g/g。重组菌株P.putidaKT2442利用EG与乙酸共底物发酵,鼠李糖脂最终产量0.46 g/L,得率0.055 g/g,产物鉴定为mono-RL(Rha-C10-C10),结构单一,下游分离与纯化工艺简单。结合合成生物学技术和发酵工程技术,设计并实现塑料解聚物到高值化学品的转化路线,发展未来发酵行业的原料替代方案,对于经济可持续发展意义重大。
