不可降解塑料的全细胞催化降解及升级再造
2022-08-13董维亮刘亚君
颜 飞,董维亮,崔 球,刘亚君
(1.中国科学院 青岛生物能源与过程研究所,中国 青岛 266101;2.南京工业大学 生物与制药工程学院,江苏 南京 211800)
塑料是一种以高分子聚合物为主要成分的材料,具有化学稳定性好、绝缘性强、生物安全性高等优点,被广泛应用于包装材料和纺织制造等多个领域[1]。自1950年以来,人类生产的塑料总和已经超过了83亿t,其中90%的塑料为石油基不可降解塑料。塑料的长期大规模使用也带来了塑料垃圾污染问题,即使是回收率相对较高的聚对苯二甲酸乙二醇酯(PET)类塑料,其收集、分类、回收以及转化等各个环节还存在明显的技术障碍[2]。据统计,目前有79%的塑料垃圾未得到有效处理而进入环境中[3]。塑料物理化学结构的稳定性成了“双刃剑”,使其在自然环境下难以分解,造成了长期的生态问题[4]。
2021年2月9日,国家机关事务管理局办公室、住房和城乡建设部办公厅、国家发展和改革委员会办公厅三部门发布《关于做好公共机构生活垃圾分类近期重点工作的通知》,明确提出,到2021年底前,公共机构全面停止使用不可降解一次性塑料制品,对不可降解材料明确定义为聚乙烯(PE)、聚丙烯(PP)、聚苯乙烯(PS)、聚氯乙烯(PVC)、乙烯-醋酸乙烯以及PET等非生物降解高分子材料(表1),且这些材料与聚乳酸、聚对苯二甲酸-己二酸丁二醇酯等可降解塑料混合制成的塑料产品也纳入“不可降解”的范围。可见,实现不可降解塑料的高效、绿色降解及回收利用,进而形成塑料垃圾的处理方案已成为亟待解决的问题。不可降解塑料的有效降解和再造不仅可以解决日益严峻的塑料污染问题,而且更可以有效减少对石油资源的依赖和消耗,符合我国“双碳战略”目标的发展要求。
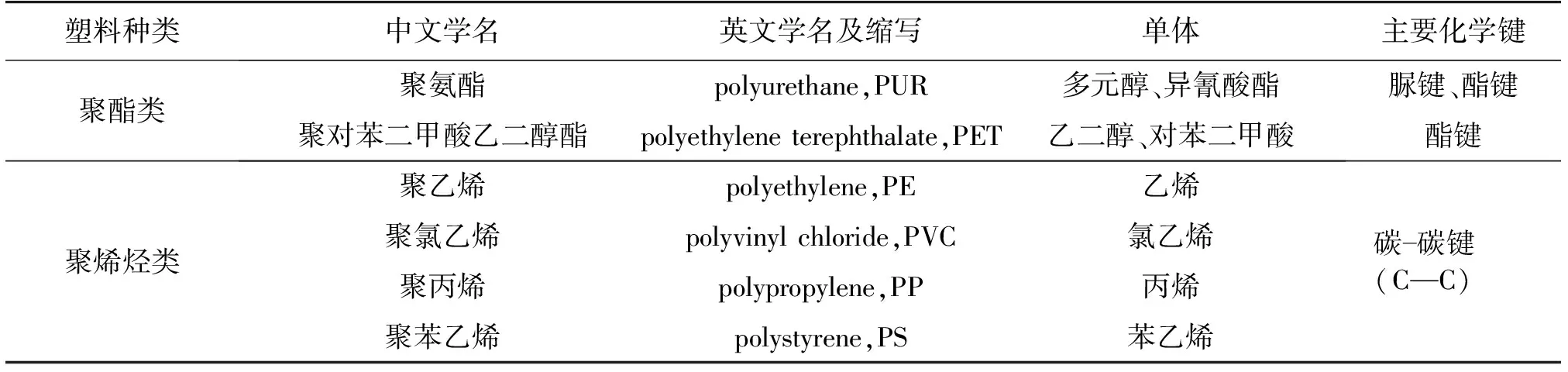
表1 广泛应用的不可降解塑料
塑料废弃物传统的处理方法包括物理法(填埋法)和化学法(焚烧法)。填埋法存在占用土地、破坏土壤结构、影响植物生长和污染地下水等问题[5]。焚烧法会造成CH4、CO、SOx、总悬浮颗粒物(TSP)、NH3和挥发性有机物(VOCs)等污染物的大量排放,焚烧后产生的残渣还会造成重金属二次污染[6]。与传统的物理和化学法相比,生物法可以在较温和的条件下处理塑料废弃物,且不产生额外的污染物。
目前,研究最为广泛的塑料生物降解体系是以聚酯塑料PET为底物、以水解酶为催化剂的酶解模式,主要采用将废弃塑料降解为单体,然后循环利用单体再造新的塑料制品的闭环策略[7]。随着越来越多塑料降解微生物和酶资源被挖掘,特别是自2016年Yoshida等[8]筛选到1株能够天然降解并利用PET的大阪伊德氏杆菌(Ideonellasakaiensis)以来,采用全细胞催化的开环方法实现塑料降解和利用具有实际的可行性,已经被广泛研究并证实。这一策略是指通过降解底盘实现PET解聚到单体,集合高温及多酶级联降解优势,提高解聚效率、减少中间产物积累,再利用下游化学品生产底盘——微生物,以塑料单体为底物来生产不同的化学品,实现塑料废弃物的高值化。这一路线将塑料作为有机碳源,通过生物法转化为高值化学品,如聚羟基脂肪酸酯(PHA),其产品包括但不限于塑料本身的重新合成和生产(图1)。本文主要总结了目前针对不可降解塑料的全细胞催化降解体系的开发和研究进展,总结和比较了塑料废弃物的天然与人工全细胞降解方法,并讨论“降塑再造一体化”的开环升级再造策略,以期为塑料废弃物的研究与再利用提供参考。

BHET—对苯二甲酸双(2-羟乙基)酯;MHET—对苯二甲酸单(2-羟乙基)酯
1 聚酯类与聚烯烃类塑料及其降解潜力
不可降解塑料可大体分为聚酯类塑料和聚烯烃类塑料两大类。聚酯类塑料主要包括PET和聚氨酯(PUR)。PET由对苯二甲酸(TPA)和乙二醇(EG)通过酯键连接而成,具有较好的稳定性、溶剂耐受性、透明性等优良性能,被广泛应用于电子电器、汽车工业、纺织制造和食品包装等领域[9]。PUR全称为聚氨基甲酸酯,是由各种异氰酸酯与多羟基化合物加聚而成的高分子化合物,主要包括聚酯型和聚醚型两类。PUR的热稳定性和力学性能良好,被广泛应用于涂料、包装材料和医用材料等领域。
聚烯烃类塑料是碳-碳骨架塑料,包括PE、PP、PVC和PS等,没有易被氧化和水解的基团,其中,PE和PP是生产和应用最广泛的塑料种类。PE是乙烯的长链聚合物,它以高密度聚乙烯(HDPE)或低密度聚乙烯(LDPE)的形式存在,主要用于制造食品和日用品包装等产品[6]。PP塑料耐冲击、有弹性、耐腐蚀并且耐热性和拉伸性能都较好,主要用于制造编织袋和电器的阻燃性零件。PVC是氯乙烯在引发剂作用下聚合而成的热塑性树脂,具有较好的电绝缘性,主要用于制造电缆和电线等产品的绝缘材料[7]。PS由苯乙烯单体组成,具有较好的化学稳定性和热稳定性,可用于电子产品、汽车配件和玩具等产品的制造。
由于PET内部是由酯键连接而成的,而自然界中存在着角质、软木脂、半纤维素和木质素等含有酯键的天然聚合物及其相应的降解体系,所以PET的生物降解与其他塑料相比更具可行性。Alisch等[10]最初使用天然的酯酶和脂肪酶来降解PET,但结果发现,酯酶只能用来改善PET膜的表面亲水性,这是因为脂肪酶的催化活性中心附近存在“盖子”结构,阻碍了聚酯链与酶的结合,所以PET水解效率较低[11]。随后,研究人员从微生物中分离出具有PET降解活性的角质酶[12]。因为角质酶的催化活性中心不存在“盖子”结构,有利于酶识别PET底物,所以角质酶比其他酶表现出较高的PET降解能力。近年来,PET的生物降解研究在微生物和水解酶机制方面取得了显著进展,与其他塑料相比,PET的生物降解处于更高的技术就绪水平(technology readiness level,TRL)。2020年,法国CARBIOS公司宣布建立具有万吨级处理能力的从PET酶法解聚到再生rPET的生产示范线,尽管其成本仍较高,但该技术的落地说明了生物法是未来循环经济模式下塑料降解和回收的绿色途径。随着更多的PET降解酶、PET天然降解菌被发现,以及水解酶的催化机制得到更详细的阐明,PET降解工程酶和人工底盘也逐渐被报道[8,13-15]。
由于PUR材料的组成和结构多样,特别是含有的脲基、酯基、醚基以及丁二烯基等基团差异较大,PUR塑料的降解比PET更有挑战性。到目前为止,已经筛选到能够降解PUR的菌株,但总体来说,微生物资源依旧匮乏。不同于聚酯类塑料是由单体通过酯键或脲键聚合而成,PE和PP等聚烯烃类塑料主要由更为惰性的碳碳键(C—C)连接而成,因此其生物降解更为困难。尽管如此,国内外科学家仍在昆虫幼虫的肠道[16]、土壤[17]及海洋垃圾中发现并分离了可以降解PE、PS等聚烯烃类塑料的微生物,这为聚烯烃的全细胞降解提供了可行的方案。
2 天然全细胞催化降解塑料的体系
2.1 PET塑料天然全细胞催化体系
PET是一种人工合成的芳香族聚酯,但其分子内部由酯键连接而成,这就为PET的生物降解提供了可能。研究人员从堆肥、沉积物、土壤、废水和活性污泥等环境样品中筛选到多种PET降解微生物,主要包括腐皮镰孢菌(Fusariumsolani)[18]、特异腐质霉(Humicolainsolens)、嗜热子囊菌(Thermobifidafusca)[19-20]和绿色糖单孢菌(Saccharomonsporaviridis)[21]等。
Yoshida等[8]利用低结晶度(1.9%)的PET薄膜在含有PET废弃物的废水、土壤等环境中筛选PET降解微生物,最终发现1株细菌I.sakaiensis201-F6,该菌可以附着在PET表面形成生物膜,在30 ℃下反应6周,几乎完全降解60 mg PET底物。I.sakaiensis所产的PET水解酶(PETase)和单羟乙基对苯二甲酸酯水解酶(MHETase)可以协同降解PET为TPA和EG单体,其中PETase可能会黏附在PET表面以启动其生物降解。此外,I.sakaiensis不仅能够降解PET,还具有代谢PET降解单体的完整途径,这种对PET的同化作用更有利于从环境中去除PET塑料废弃物的污染,因此,I.sakaiensis在PET生物降解和生物修复方面均具有应用潜力[22]。随后,PETase特殊的结构特征和PET降解机制也得到解析[23-24]。除此之外,通过蛋白质工程改进PETase和MHETase这2种酶的催化活性和热稳定性也成为目前的研究热点。例如,Cui等[25]提出了新型蛋白质稳定性计算设计策略(GRAPE),并基于计算机蛋白质设计对PETase进行了稳定性改造,获得了鲁棒性显著增强的从头设计的酶。Knott等[26]利用不同长度的Linker构建了PETase-MHETase嵌合酶体系,结果发现,与游离酶相比,嵌合酶体系的PET降解性能均有一定的提升。由于自然界中的微生物可以通过酶的协同作用高效降解“顽固”的天然聚合物,多酶协同系统也可能在未来的混合塑料降解中发挥出潜在优势。
除了I.sakaiensis外,最近还有其他天然PET降解细菌或真菌被分离和鉴定。例如,Liu等[27]在污泥中筛选到1株Delftia属的WL-3菌株,该菌株可以在7 d内将5 g/L对苯二甲酸二乙酯(DET)降解掉94%,并将其作为唯一碳源生长,具体过程:先通过2个酯键的水解将DET转化为TPA,再将TPA转化为原儿茶酸(PCA)并进一步矿化。此外,菌株WL-3能够在较宽的pH(6.0~9.0)和温度(20~42 ℃)范围内稳定降解DET,最适pH和温度分别为7.0和30 ℃。将菌株WL-3与PET一起孵育 2个月后,使用扫描电镜观察PET薄膜表面和液体培养基中的变化后发现,菌株WL-3附着在PET表面并形成一层薄的生物膜,去除生物膜后,在PET薄膜表面观察到明显的凹坑和空洞。Da Costa等[28]从巴西瓜纳巴拉湾河口分离到1株解脂耶氏酵母(Yarrowialipolytica),该酵母能够降解PET并将其作为碳源合成自身物质,而且PET降解过程的中间产物BHET是该酵母脂肪酶合成的最佳诱导剂,在250 r/min培养条件下添加BHET后酵母脂肪酶产量达到(385±5.8)U/L,比对照组增加了3倍。由于脂肪酶是工业领域的通用生物催化剂,解脂耶氏酵母在PET生物转化方面显示出巨大潜力。
截至目前,虽然已经从自然环境中发现了PET天然全细胞催化体系,但PET降解微生物资源依然不足,降解效率仍相对较低,还无法满足大规模PET废弃物处理的需求。一方面亟待开发针对性的环境微生物筛选和定向进化方法。例如,近期Qiao等[29]提出了对PET降解微生物或酶进行高通量筛选的荧光活化液滴分选技术(FADS),并基于该技术从PET纺织厂的废水中筛选到9种不同属的PET降解微生物。FADS可广泛用来从各种环境中发现新的PET降解微生物和酶,在PET降解微生物资源的挖掘方面显示出巨大的潜力。然而,该方法目前还不能用于高温条件下的酶或微生物的筛选,所以还需基于现有基础对该技术进一步升级和开发。拉曼激活细胞分选(RACS)作为一种无标记、无损且高通量的单细胞分选技术,已经广泛用于胞内大分子化合物合成水平的筛选,在PET降解微生物或酶的高通量筛选方面具有很大的应用潜力[30-31]。另一方面,需要投入更多的努力,从这些微生物中寻找可以高效降解PET的酶,用于开发酶催化降解体系或人工全细胞降解体系。
2.2 PUR天然全细胞催化体系
PUR内部由酯键或者脲键连接而成,因此可以利用微生物的脲酶、酯酶和蛋白酶来解聚[32]。目前发现的PUR降解的真菌主要是枝孢菌属,而细菌主要以假单胞菌属和芽孢杆菌属为主。例如,Osman等[33]从固体废弃物倾倒场分离出1种PUR降解真菌Aspergillussp.S45,它以线性聚酯型PUR膜为唯一碳源,在30 ℃反应28 d后,PUR膜的质量损失达15%~20%。Khan等[34]从土壤中分离出1种新型PUR降解真菌,并鉴定为塔宾曲霉(Aspergillustubingensis),该菌的菌丝体可以在聚酯型PUR材料上定植,并导致材料表面形貌发生变化,在室温下的液体反应体系中反应2个月,可以降解约90%的PUR膜。Mathur等[35]从塑料垃圾堆放场的环境中分离出1株新的真菌Aspergillusflavus,它能够利用聚酯型PUR作为唯一的碳源生长,该菌株与PUR材料共同孵育30 d后,PUR降解率达到60.6%。
目前,PUR降解微生物资源仍较为匮乏,而且已有的PUR降解微生物几乎无法降解硬段氨基甲酸酯重复结构单元。除此之外,PUR微生物降解机制和单体利用的代谢途径也有待进一步解析。
2.3 聚烯烃塑料的天然全细胞催化体系
聚烯烃类塑料化学结构稳定,内部主要由碳碳键—C—C—或者—C—H键构成,其大分子量的长链结构形成空间位阻,使其无法进入微生物细胞。除此之外,聚烯烃类塑料具有高度疏水性,这降低了微生物和酶对底物的可及性,增加了塑料生物降解的难度[36]。目前,PE、PP和PS等聚烯烃类塑料的生物降解也已有相关的报道。
PE是产量最大和应用范围最广的一类塑料,可分为高密度聚乙烯(HDPE)和低密度聚乙烯(LDPE)。目前已报道的PE生物降解研究主要以LDPE为底物。Yang等[16]发现印度谷螟(Indianmealmoths)幼虫能够啮食LDPE,因此利用印度谷螟幼虫降解LDPE后,在其肠道中分离出2种塑料降解细菌YT1和YP1,分别属于阿氏肠杆菌(Enterobacterasburiae)和芽孢杆菌(Bacillussp.),这2株菌与LDPE膜孵育28 d后,可以在LDPE表面形成生物膜,并且使LDPE膜的疏水性降低。进一步研究发现,YT1和YP1能够在60 d内分别降解约6.1%和10.7%的LDPE薄膜(初始100 mg)。Réjasse等[37]利用同位素标记的HDPE喂食转基因大蜡螟(Galleriamellonella)幼虫,通过傅里叶变换红外光谱技术检测发现,在幼虫组织中没有出现生物同化现象,但在消化道中检测到了微弱生物降解状态的HDPE微塑料颗粒。该研究证明了该转基因大蜡螟幼虫可以降解HDPE,但无法真正地消化代谢HDPE。Paco等[38]利用海洋真菌Zalerionmaritimum对LDPE进行降解,在14 d内造成的质量损失达56.7%。Harshvardhan等[39]以LDPE作为唯一碳源,筛选到能够降解LDPE的细菌,其中,在30 d内短小芽孢杆菌M27的LDPE降解率为1.5%、沼泽考克氏菌M16的LDPE降解率为1%、枯草芽孢杆菌H1584的LDPE降解率为1.75%。Gao等[40]自近海海洋垃圾中筛选到1株海洋真菌AlternariaalternataFB1,该真菌在PE塑料表面具有较强的定植能力,将菌株与LDPE薄膜一起孵育1个月左右,PE表面产生明显的降解孔洞;结合X线衍射、凝胶渗透色谱、红外光谱、高效液相色谱及质谱等手段多方面证实了该真菌能够有效降解PE,解聚效率高达95%。
除了PE之外,其他聚烯烃类塑料的降解微生物也有发现。Yang等[41]在黄粉虫(Tenebriomolitor)幼虫肠道中分离出1株具有PS降解能力的细菌Exiguobacteriumsp.,将其与PS一起孵育60 d后,PS的降解率为7.4%左右。另外,从土壤中分离到的微生物对于经过热处理[42]或紫外照射[17]的PP表现出一定的降解能力,对未经处理的PP几乎没有降解能力,这说明预处理有助于提高PP的生物可降解效率。
此外,能够同时降解多种塑料污染物的菌株或菌群也得到研究和分离。Luo等[43]分别利用PS、LDPE、聚酯型PUR作为唯一碳源喂养大麦虫幼虫35 d后,幼虫对3种碳源的平均消耗率分别为1.41、0.30和0.74 mg/d。同时幼虫肠道微生物群落显示出显著的相对丰度变化:其中,PE喂养组中的柠檬酸杆菌属(Citrobacter)丰度增加,PS喂养组中的单胞菌属(Dysgomononas)和鞘氨醇杆菌属(Sphingobacterium)丰度增加,聚酯型PUR喂养组中的红树杆菌属(Mangrovibacter)丰度增加。Auta等[44]自红树林的沉积物中筛选塑料降解微生物,最终分离到的2株名为Bacilluscereus和Bacillusgottheilii的细菌可在以不同种类微塑料作为唯一碳源的合成培养基上生长;同时发现,在40 d内,B.cereus对PE、PET和PS微塑料颗粒造成的质量损失分别为1.6%、6.6%和7.4%;B.gottheilii对PE、PET、PP和PS微塑料颗粒造成的质量损失分别为6.2%、3.0%、3.6%和5.8%,表现出了修复微塑料污染环境的潜力。
与PET降解微生物相比,可用于聚烯烃类塑料降解的微生物资源则相对缺乏。由于塑料的质量损失和表面结构变化有可能归因于塑料中化学添加剂的降解,因为化学添加剂通常占聚合物的很大一部分,因此仅仅基于质量损失和材料表面形貌观察的实验结果往往不能作为可靠的聚烯烃塑料降解证明。所以聚烯烃类塑料降解还存在着降解机制尚不明晰、降解产物不易检测的技术难题,因此有待进一步开发更先进的检测技术并对降解途径中的关键酶进行鉴定及功能解析。
3 人工全细胞催化体系
在各种石油基塑料中,PET塑料的结构和水解机制研究得较为透彻,因此研究人员将PET作为人工全细胞催化降解的主要研究对象,通过基因工程等手段构建适用于PET水解酶异源表达的底盘细胞,以进一步提升水解酶的表达量和热稳定性,从而弥补天然宿主的不足,大幅提高PET的生物降解效率。按照使用的全细胞催化剂生长温度的不同,可以将现有的PET人工全细胞降解体系分为嗜中温和嗜高温催化体系两大类。
3.1 嗜中温人工全细胞催化体系
3.1.1 人工微生物混菌催化体系
人工微生物混菌体系具有功能模块化的优势,有利于整个体系催化能力的优化。例如,Qi等[45]利用红球菌(Rhodococcusjostii)、恶臭假单胞菌(Pseudomonasputida)和2种外泌表达PET水解酶PETase和MHETase的工程化枯草芽孢杆菌(Bacillussubtilis)构建了PET降解的人工微生物混菌体系,结果发现:工程化枯草芽孢杆菌构成的双菌体系可以降解PET膜,在7 d内质量损失达13.6%;进一步通过添加红球菌获得了3种微生物的混菌体系,可减少TPA对酶解体系引起的反馈抑制作用,PET膜的质量在3 d内损失了31.2%,比双菌体系提高了约17.6%;最后,通过引入恶臭假单胞菌将PET水解后产生的另一种单体成分EG进行转化,从而进一步消除反馈抑制作用。由此可见,由前3种微生物组成的混菌体系的PET降解效率最高,引入恶臭假单胞菌后形成的4种微生物混合体系在TPA和EG的生物转化上更有优势。
Liu等[46]也构建了PET降解的人工混菌体系,首先构建能够外泌表达I.sakaiensis来源的PETase的Yarrowialipolytica工程菌株,以降解PET产生TPA。随后,他们筛选到1株可以代谢TPA的Pseudomonasstutzeri,并在该菌中重组表达了聚-β-羟丁酸(PHB)合成基因簇phbCAB,实现TPA进一步转化为PHB。结果发现:基于工程化的Y.lipolytica和P.stutzeri构建的人工混菌体系在12 h内可以完全水解5.16 g/L的BHET,并在54 h内积累36.6 g/L的PHB,228 h内水解PET产生0.31 g/L TPA。
除此之外,利用人工混菌体系对PUR进行降解的研究也有报道。例如,Fernandes等[47]利用黑曲霉(AspergillusnigerATCC16404)和铜绿假单胞菌(PseudomonasaeruginosaATCC9027)形成的混菌体系对聚酯型PUR进行降解,结果发现,2株菌在PUR降解过程中可以发挥协同作用,有效提高了PUR的降解效率。由此可见,人工微生物混菌体系在塑料降解和转化方面的巨大潜力为复杂聚合物的生物降解提供了新的思路。
3.1.2 海洋微藻催化体系
每年至少有800万t塑料废弃物进入海洋,占海洋垃圾总量的80%。由于已知的塑料降解酶及其生产菌株多来源于陆地微生物系统,不能很好地适应海洋生长条件,为此,开发适用于海洋中塑料污染降解处理的海洋微藻全细胞催化体系也成为重要的研究方向。三角褐指藻(Phaeodactylumtricornutum)是一种海洋光合单细胞生物,可以在盐水环境消耗CO2并快速生长,且具有相应的遗传操作系统[48]。Moog等[14]使用三角褐指藻作为底盘细胞,对来源于I.sakaiensis的PETase进行了表达外泌,获得了海洋微藻PET全细胞降解催化剂,该工程藻株可以在30 ℃下的盐水环境中降解PET,这一研究证明了硅藻系统在未来PET海水污染的生物修复中的应用潜力。然而,由于三角褐指藻需要SiO2作为营养物质且在较低的温度和高盐度下才能生长,这些特性限制了其应用范围。莱茵衣藻(Chlamydomonasreinhardtii)是光合微生物的GRAS模式生物,非常适用于环保应用,具有多种优势[49-50]。Kim等[51]使用另一种单细胞光合微生物莱茵衣藻作为底盘来生产PETase,在实验中选择了莱茵衣藻CC-124和CC-503这2个代表性藻株进行PETase异源表达,分析后发现:CC-124是更为适合的PETase表达底盘;同时,为了验证莱茵衣藻产生的PETase的催化活性,将细胞裂解物和30 mg PET粉末在30 ℃下共同孵育4周,通过高效液相色谱检测到9.12 mg降解产物TPA,转化率达到35.17%;另外使用扫描电镜还观察到PET薄膜表面出现孔洞和凹痕等形貌变化。这一研究实现了PETase在绿色微藻中首次成功表达,进一步证明了海洋微藻体系作为塑料降解全细胞催化平台的可行性。
3.1.3 酵母表面展示催化体系
酵母表面展示技术可以将外源蛋白与锚定蛋白以融合蛋白的形式展示在酵母细胞表面,从而实现外源蛋白的表达、纯化和固定化于一体,简化工艺,节约成本,在生物催化领域显示出强大的优势[13]。Chen等[52]成功地将PETase展示在毕赤酵母细胞表面,从而开发了一种基于酵母的人工全细胞生物催化剂,结果发现,在酵母表面功能性展示PETase,可以有效提高酶的稳定性,与纯化的游离PETase相比,表面展示PETase的酵母全细胞生物催化剂对高结晶PET的转化率增加了约36倍。此外,该全细胞生物催化剂重复使用性好且对化学溶剂耐受性较好,并具有降解不同商业高结晶PET瓶的能力。这一研究证实了通过在模式微生物表面展示PETase,构建全细胞生物催化剂是实现PET降解与再造的重要途径之一。
3.2 嗜高温人工全细胞催化体系
PET是应用最广泛的合成聚酯,对PET材料特性和界面催化反应机制分析后发现,PET生物降解水平提高的关键在于酶-底物相互作用及匹配性、酶制剂的热稳定性、高温条件下的催化效率以及降解中间体的及时去除[53]。其中,高温条件下的高效酶解催化至关重要。这是由于PET生物降解的最关键因素之一是玻璃化转变温度,即PET在升温过程中由玻璃态向高弹态或者在降温过程中由高弹态向玻璃态转变时的温度。当温度接近玻璃化转变温度时,PET塑料的状态会发生改变,非晶态部分具有更高的柔性。PET聚酯链的摆动性增加可有效促进聚酯链进入酶催化活性中心,从而提高PET降解效率[54]。一般PET的玻璃化转变温度在80 ℃左右[55],在水溶液中,由于水分子在聚合物链之间扩散的作用,玻璃化转变温度下降至60~65 ℃[56]。目前,能够在大于60 ℃的高温条件下高效降解PET的天然微生物尚未见报道,因此需要人工开发适用于PET降解的嗜热底盘细胞。
目前,已报道多种具有较高降解效率的高温PET水解酶。例如,HiC角质酶来源于特异腐质霉(Humicolainsolens),在70 ℃下反应96 h,几乎可以完全水解结晶度为7%的PET薄膜[57]。Then等[58]利用来源于ThermobifidafusaDSM43793的TfH催化降解PET薄膜,在55 ℃下反应3周,使结晶度为10%的PET薄膜质量损失50%。来自T.fusaKW3菌株的TfCut2角质酶能够在65 ℃下降解低结晶度PET材料[59]。Wei等[60]自嗜热放线菌ThermomonosporacurvataDSM43183中分离到2种具有聚酯降解能力的水解酶Tcur1278和Tcur0390,其中Tcur1278表现出更佳的热稳定性,可以在60 ℃条件下降解PET颗粒;此外,来源于枝叶堆肥宏基因组的LCC角质酶在pH 8.0、50 ℃条件下,PET降解效率达到12 mg/(h·mg)。
在天然PET降解酶的基础上,研究人员通过催化条件优化或者蛋白质工程进一步提高了酶的热稳定性。例如,Then等[58]通过向TfH中添加Ca2+、Mg2+来提高酶的热稳定性,最终在65 ℃反应48 h,对低结晶度PET膜的降解率达13%。Tournier等[61]利用二硫键策略对LCC进行了改造,将其金属离子结合位点附近的氨基酸残基替换成了含硫基的氨基酸,获得的突变体的Tm提高了9.8 ℃,通过进一步突变,最终获得的四氨基酸残基的突变体LCCICCG在10 h内最终实现了至少90%的PET解聚,TPA生产强度为16.7 g/(L·h)。在此基础上,Zeng等[62]通过解析LCCICCG和PET底物类似物的晶体结构,揭示了角质酶的PET结合模式;根据结构信息进行蛋白质理性设计,进一步构建了几种Tm接近99 ℃且PET水解活性提高的突变体,结果发现,这些突变体在解聚无定形和高结晶度PET方面均表现出比突变体LCCICCG更高的效率。
IsPETase作为一种PET中温水解酶在高温条件下活性较低。研究人员基于IsPETase所具有的灵活而开放的底物结合区域的特点,对其开展了一系列的蛋白质工程改造。例如,Son等[63]经过3个氨基酸残基的突变获得ThermoPETase(S121E/D186H/R280A),它的Tm比野生型的提高了8.8 ℃,PET降解能力提高了14倍。Cui等[25]通过GRAPE计算方法获得的十氨基酸残基突变体DuraPETase,其Tm提高了31 ℃,PET降解能力提高了300倍以上。
高温条件对PET的高效降解至关重要[54-55]。虽然有天然或改造的高温PET水解酶的报道较多,但嗜热微生物比嗜中温细菌的遗传改造难度更大,所以可用于PET降解的人工高温全细胞催化体系相对缺乏。热纤梭菌是一种典型的嗜热细菌,最适培养温度在60 ℃左右[64],且已具有相对成熟的遗传改造工具平台[65-67]。作为一种天然高效的木质纤维素降解菌株,在前期的研究中,热纤梭菌已被应用于秸秆等天然废弃聚合物的全细胞催化技术的开发,继而衍生出整合生物加工和整合生物糖化等技术体系,并应用于木质纤维素的生物质转化领域[68-69]。笔者所在实验室基于前期在热纤梭菌遗传改造方面的技术优势,通过基因工程改造实现嗜热角质酶LCC在热纤梭菌中异源外泌表达,首次构建了PET人工嗜高温全细胞降解体系,在60 ℃条件下,该热纤梭菌工程菌株在14 d内将超过60%的无定形PET薄膜转化为可溶性单体,其降解性能明显高于先前报道的使用嗜中温细菌或微藻的全细胞PET生物降解体系[15]。因此,热纤梭菌是重要的合成生物学嗜热微生物底盘,未来可用于PET废弃物生物降解平台的开发。由于热纤梭菌能够天然降解木质纤维素,因此该菌在涤棉混纺废品的生物回收中也极具潜力[53]。
除了热纤梭菌以外,满足高温水解酶的生产及催化需求的嗜热底盘细胞和相应的全细胞催化体系研究较少,但针对Thermotogasp.[70]、Caldicellulosiruptorsaccharolyticus[71]和Thermoanaerobacterethanolicus[72]等,研究者们也建立了相应的遗传改造平台。因此,这些高温菌株具有应用于PET全细胞催化体系开发的潜力。
3.3 PET降解多酶复合体的构建
在自然环境下,微生物已进化出复杂的纤维素酶体系来降解木质纤维素。例如,以热纤梭菌为代表的厌氧微生物能够分泌一种多酶复合体——纤维小体。该多酶复合体可以通过支架蛋白(scaffold protein)将各种纤维素酶组装在一起,通过挂壁模块展示在细胞表面,还可以利用碳水化合物结合模块吸附在纤维素底物上行使催化功能。纤维小体可以发挥酶与酶之间的协同效应、酶与细胞的协同效应以及酶与底物的协同效应,从而高效降解木质纤维素底物。目前,纤维小体的基本架构和降解机制都已经得到深入的解析[73-74],与此同时,人工纤维小体也在合成生物学中得到广泛应用[75-76]。
已知PET生物降解过程中产生的中间产物BHET和MHET会抑制PET水解酶的活性[77-78],如果基于纤维小体架构,将PET水解酶和中间产物水解酶组装成一个人工多酶复合体,从而获得可实现底物级联催化的分子机器,这将是解决中间产物抑制问题的一种良好策略(图1)。此外,利用蛋白质多聚体、纳米颗粒或者膜蛋白来构建仿纤维小体架构的思路也值得借鉴[79]。
4 聚酯类塑料的开放升级再造策略
传统的物理和化学处理技术致力于将塑料废弃物分解为分子结构单元,再重新加工聚合成纤维和瓶子等再生塑料制品。生物降解技术更易与生物回收技术相耦合,旨在利用微生物将塑料降解的产物合成高附加值化学品,且不局限于塑料产品范围内,因为这是一种更为开放的升级再造策略,更符合低碳经济的发展理念。目前塑料废弃物升级再造主要集中在PET和PUR两大类塑料。
PET的生物降解产物主要包括终产物TPA、EG以及MHET和BHET等少量中间产物,经微生物转化为聚羟基脂肪酸(polyhydroxyalkanoate,PHA)和生物基聚氨酯、原儿茶酸(protocatechuic acid)和乙醇酸(glycolic acid)等产品[80-81](图1)。例如,Kenny等[82]自塑料瓶生产厂区的土壤中分离到3株可以利用TPA作为唯一碳源生长并能够合成积累PHA的细菌。不仅如此,进一步通过发酵优化使PHA产量达到2.61 g/L,且在发酵体系中同时添加TPA和生物柴油生产中产生的废甘油(WG),可以提高菌株对TPA的利用率[83]。
近年来,研究人员针对恶臭假单胞菌开发了成熟的遗传改造技术[84-86],将其打造为鼠李糖脂、萜类化合物、聚酮化合物、非核糖体肽以及氨基酸衍生物等应用广泛的化学品生产平台[87-88]。例如,Tiso等[89]对恶臭假单胞菌进行改造后将其用于生产3-羟基脂肪酸的二聚体——羟基烷酰氧基链烷酸酯(HAA),进一步将它用于生物或化学催化转化。与许多其他含有脂肪酸的分子相比,HAA可以分泌到胞外,不依赖于细胞裂解,简化了纯化步骤[90]。在此基础上,Tiso等[80]进一步利用假单胞菌工程菌株将PET水解产物TPA和EG转化为HAA,并进一步合成PUR。除此之外,TPA可以由重组大肠杆菌转化为原儿茶酸,并进一步合成没食子酸、邻苯三酚、儿茶酚、黏康酸和香草酸等高附加值产品[81]。EG还可以由氧化葡萄糖酸杆菌(Gluconobacteroxydans)或者恶臭假单胞菌转化为乙醇酸[91-92]。
PUR的主链相对于PET的更加复杂,降解产物多样化,可能包括醇、酸、胺和芳烃等,对下游的生物转化提出了挑战[93-94]。已知野生型恶臭假单胞菌KT2440能够以1,4-丁二醇(1,4-BDO)为唯一碳源生长,但速度非常缓慢。Li等[95]通过对恶臭假单胞菌KT2440进行实验室适应性进化,分离到了几株生长速率和生物量显著提高的菌株,并进一步通过蛋白质组学和基因组重测序分析了可能的1,4-BDO的代谢途径,以扩大恶臭假单胞菌在塑料升级再造中的适用性。Utomo等[46]设计了3种分别具有己二酸、1,4-BDO和EG利用功能的恶臭假单胞菌工程菌株,并构建了由3种工程菌株组成的混菌降解体系,最终将PUR单体转化为鼠李糖脂。
5 结论与展望
我国早在2007年底提出了最早的“限塑令”,《国务院办公厅关于限制生产销售使用塑料购物袋的通知》要求自2008年开始限制一次性塑料制品中用量最大、使用最多的塑料购物袋的使用。2020年1月19日,国家发展和改革委员会、生态环境部公布了《关于进一步加强塑料污染治理的意见》,又进一步加强了对更多种类的塑料制品的限制。2021年2月9日,国家机关事务管理局办公室、住房和城乡建设部办公厅、国家发展和改革委员会办公厅共同发布《关于做好公共机构生活垃圾分类近期重点工作的通知》,明确定义了不可降解塑料的范围和类型,再次证明了我国限制塑料使用、保护环境安全的决心。
近几年,国家自然科学基金委和科技部等部门启动了多项废塑料微生物降解项目,包括与欧盟环境科技领域共同资助的项目,在塑料机械预处理、特定塑料类型的酶设计、人工塑料降解微生物菌群构建、塑料降解单体和低聚物的高值转化(如PHA)、加工过程的毒素去除和产品回收等方面开展攻坚研究。可见,我国政府对塑料降解技术的开发和应用寄予厚望。与基于酶制剂的塑料降解技术相比,全细胞催化技术的天然菌株及工程底盘的开发仍处于实验室初期阶段,但已经展现出了广阔的发展和应用前景。
5.1 新型天然降解微生物的分选与实验室定向进化
除了通过开发基于荧光或拉曼信号的分选技术以实现塑料天然降解菌的高通量分选外,还需要建立与之相对应的实验室进化技术。塑料是人造聚合物,自然界中几乎没有天然“专职”降解塑料的酶,已报道的水解酶均为“兼职”降解塑料。现有的分子设计和理性改造取得了巨大成功,而在现有酶的基础上开展实验室压力条件下的非理性改造,推动酶的进化,有望进一步获得具有更高比酶活、底物亲和力以及鲁棒性的突变体。
除此以外,可以通过非理性手段对现有的水解酶表达底盘细胞进行定向进化,结合先进的分选技术,获得满足塑料高效降解的全细胞催化体系。这些非理性手段包括诱变技术(例如室温常压等离子体)、适应性实验室进化技术(例如微滴微生物培养系统)、随机组装策略(例如多重自动化基因组工程)等。
5.2 人工全细胞催化剂的理性构建
已开发的以热纤梭菌为嗜热底盘的PET全细胞降解体系,满足高温水解酶的生产及催化需求,表现出较高的PET降解效率,具有开发和应用前景。新型高温酶的发现和开发,为高温人工全细胞催化剂的构建提供了有力的酶资源支撑。除了酶的甄选外,还需要通过理性改造手段进一步提高菌株发酵的鲁棒性。另外,通过探索菌株代谢水平、培养基组分、表达载体、连接肽和信号肽等因素对异源蛋白表达外泌条件的优化,有助于不断优化全细胞催化剂的PET降解性能。
此外,针对PUR等降解途径尚不明确的塑料,应利用从基因组到代谢组的多组学分析手段,综合分析微生物代谢水平、能量水平、氧化还原水平等与塑料底物的响应关系,从而解析塑料降解途径和同化途径,指导人工全细胞催化降解体系的构建。
5.3 塑料降解和再造的集中式工程化应用
农作物秸秆也是固体废弃物的一种,目前已经形成了比较成熟的从原料收集到高值转化的综合体系,这与其天然属性密切相关。塑料废弃物的回收利用更为复杂和困难。借鉴农作物秸秆的管理体系,除了开发更为高效的塑料生物降解技术外,还需在如何建立完善的塑料回收系统、提高收集效率、建设回收基础设施、建立回收法规制度、建立工程化的应用体系等环节进行研究,同时,形成不同环节间的有机整合意义重大。国内外科研单位、企业与政府也越来越关注塑料降解技术集中式工程化落地应用的可行性与技术的经济性。通过建立“塑料—单体—高值化产品”的完整产业链,实现塑料废弃物的绿色降解及升级再造,将有效减少化石能源的使用,助力我国“双碳”目标的实现。
