预氧化煤低温氧化放热和动力学特性研究
2022-08-13闫国锋黄兴利闫振国
闫国锋, 黄兴利, 闫振国
(1. 陕西黄陵矿业集团有限公司,陕西 延安 727306;2. 陕西黄陵二号煤矿有限公司,陕西 延安 727306;3. 西安科技大学 安全科学与工程学院,陕西 西安 710054)
0 引言
煤炭是我国重要的化石能源,给社会发展和人民生活带来了极大便利,但煤自燃特性严重制约了煤炭资源的利用和发展。煤自燃不仅造成煤炭资源大量浪费,而且释放大量CO2,CH4和NO等温室气体,加剧了全球气候变暖,严重影响了我国碳中和目标的达成。当煤矿井下煤自燃失控造成火灾时,通常采用封闭火区的方法隔绝氧气,以防火势进一步扩散,导致封闭火区内部形成大量氧化煤。氧化煤是指新鲜煤样与氧气接触发生氧化反应,煤温升高到一定温度又降至常温后形成的煤样。由于氧化煤经历过一次氧化过程,当其再次氧化时,表现出的自燃特性与原始煤样有很大差异,导致氧化煤自燃风险增大[1]。例如,封闭火区启封过程易发生爆炸、采空区遗煤火灾频发及扑灭的煤田火灾经过一段时间再次复燃等现象都表明氧化煤自燃风险增大。为解决上述问题,有必要对氧化煤自燃特性进行研究。
许多学者对氧化煤自燃特性进行了研究。文献[2]为解决采空区大量氧化煤的遗煤自燃问题,利用程序升温实验探究了不同氧化温度的氧化煤自燃过程中气体产生规律。文献[3]将煤样从环境温度加热到80,120,160,200 ℃,不同温度下氧化10 h,并采用程序升温和傅里叶红外光谱实验研究了氧化煤指标性气体产生和特征官能团变化特性,确定了不同氧化程度氧化煤自燃倾向性规律。文献[4]对比分析了不同粒径原煤、初次氧化煤与二次氧化煤氧化特性,发现二次氧化煤中自由基浓度高于原煤和初次氧化煤。文献[5]探究了不同初始氧化温度下浸水长焰煤的氧化自燃特性,结果表明经过120 ℃预氧化后,氧化煤样中还原性官能团含量高于原煤,且有着比原煤更强的自燃倾向性。文献[6]采用激光导热仪实验探讨了预氧化煤复燃过程中的传热规律。文献[7]采用多种实验方法讨论了氧化煤复燃过程中官能团变化规律和放热特性,发现预氧化可导致原煤孔隙和官能团增加,煤氧反应能力提高。文献[8]利用电子顺磁共振实验探究了不同粒径的煤样在二次氧化过程中煤中自由基的变化特性。上述研究都是在较低的氧化温度(<200 ℃)和空气条件(氧气体积分数21%)下制取的预氧化煤为研究对象,但是缺乏对预氧化煤氧化过程中动力学特性的分析。
针对上述问题,本文以不同氧化温度(100,200,300 ℃)和氧气体积分数(21,15,5%)条件下制取的预氧化煤为研究对象,并着眼于低温氧化阶段,利用C80微量热仪对预氧化煤低温氧化反应的放热和动力学特性进行研究。
1 实验装置及方法
1.1 预氧化煤制备
将采自山西省保德煤矿工作面的新鲜原始煤煤块粉碎,并筛选出粒径为0.150~0.178 mm的煤粉。将煤粉放入真空干燥箱中,并在30 ℃的真空环境下干燥24 h后取出密封保存。煤样的工业分析和元素分析见表1。在氧气体积分数为21,15,5%的氧氮混合气下,将马弗炉内煤样温度分别升高到100,200,300 ℃后,停止升温并恒温2 h,以确保煤样被充分氧化,得到在不同温度和氧气浓度条件下氧化的9种预氧化煤。

表1 实验煤样的工业分析和元素分析Table 1 Proximate and ultimate analysis of experimental coal samples %
1.2 热实验
采用C80微量热仪测量预氧化煤低温氧化阶段的热特征,从而确定其动力学特性。实验条件:称取1 500 mg预氧化煤置于煤样罐中,并通入氧气体积分数为21%的氧氮混合气,通气稳定流量为100 mL/min,升温范围为30~300 ℃,升温速率为0.8 ℃/min。
1.3 热动力学计算方法
基于预氧化煤低温氧化过程的热流曲线来计算热动力学参数。非等温热动力学方程为
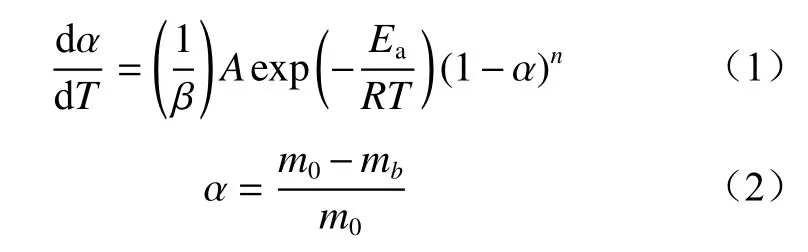
式中:α为转化率;T为煤温,K;β为升温速率,β=0.8 ℃/min;A为指前因子,s–1;Ea为活化能,J/mol;R为摩尔气体常数,R=8.314 J/(mol·K);n为反应级数;m0为预氧化煤的原始质量,g;mb为预氧化煤在b时刻的质量,g。
预氧化煤质量变化和预氧化煤放热量变化的关系为[9]

式中:Q为预氧化煤实际放热量,J;q为预氧化煤的反应热,J/g。
在低温氧化阶段预氧化煤质量变化忽略不计,即mb=m0。将式(2)和式(3)代入式(1)中,并对等式取自然对数,可得
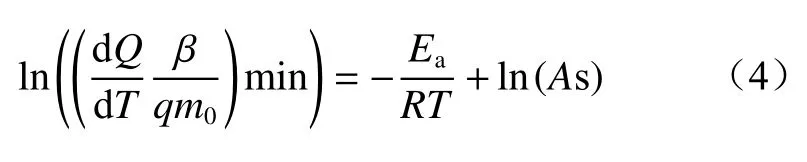
2 实验结果及分析
2.1 预氧化煤低温氧化放热特性
根据C80热流曲线和其一阶导数曲线选取特征温度,并根据选定的特征温度将预氧化煤低温氧化过程划分为缓慢氧化阶段(30 ℃-t1)、加速氧化阶段(t1-t2)、快速氧化阶段(t2-300 ℃)3个特征阶段,如图1所示,其中t1为热流>0时对应的温度,t2为热流增长率最大值对应的温度。可看出缓慢氧化阶段整体为负值,加速氧化阶段和快速氧化阶段整体为正值,这表明煤低温氧化反应缓慢氧化阶段表现为吸热,加速氧化阶段和快速氧化阶段表现为放热。

图1 特征温度和特征阶段Fig. 1 Characteristic temperatures and stages
2.2 热实验结果
预氧化煤和原煤样热流曲线如图2所示。可看出所有煤样的低温氧化反应先进行吸热(热流<0),然后随着温度升高逐渐开始放热(热流>0)。预氧化煤低温氧化过程的热流整体小于原煤样。在相同的氧气浓度下,预氧化煤的热流随氧化温度升高逐渐降低;在相同的氧化温度下,预氧化煤的热流随氧气浓度升高逐渐降低。这是由于氧化温度和氧气浓度的升高加快了煤氧复合反应,导致预氧化煤在预氧化过程中消耗的活性结构增多。此外,当氧化温度升高到300℃时,在预氧化煤的热流曲线上并没有表现出热流增长率最大值,这说明太高的氧化温度严重影响了预氧化煤的低温氧化反应进程,导致增长率最大值向更高的温度区间移动。这是由于预氧化煤中参与氧化反应的活性结构被过度消耗,需要外界提供更高的温度,激活更多的活性结构才能维持原本的反应进程。
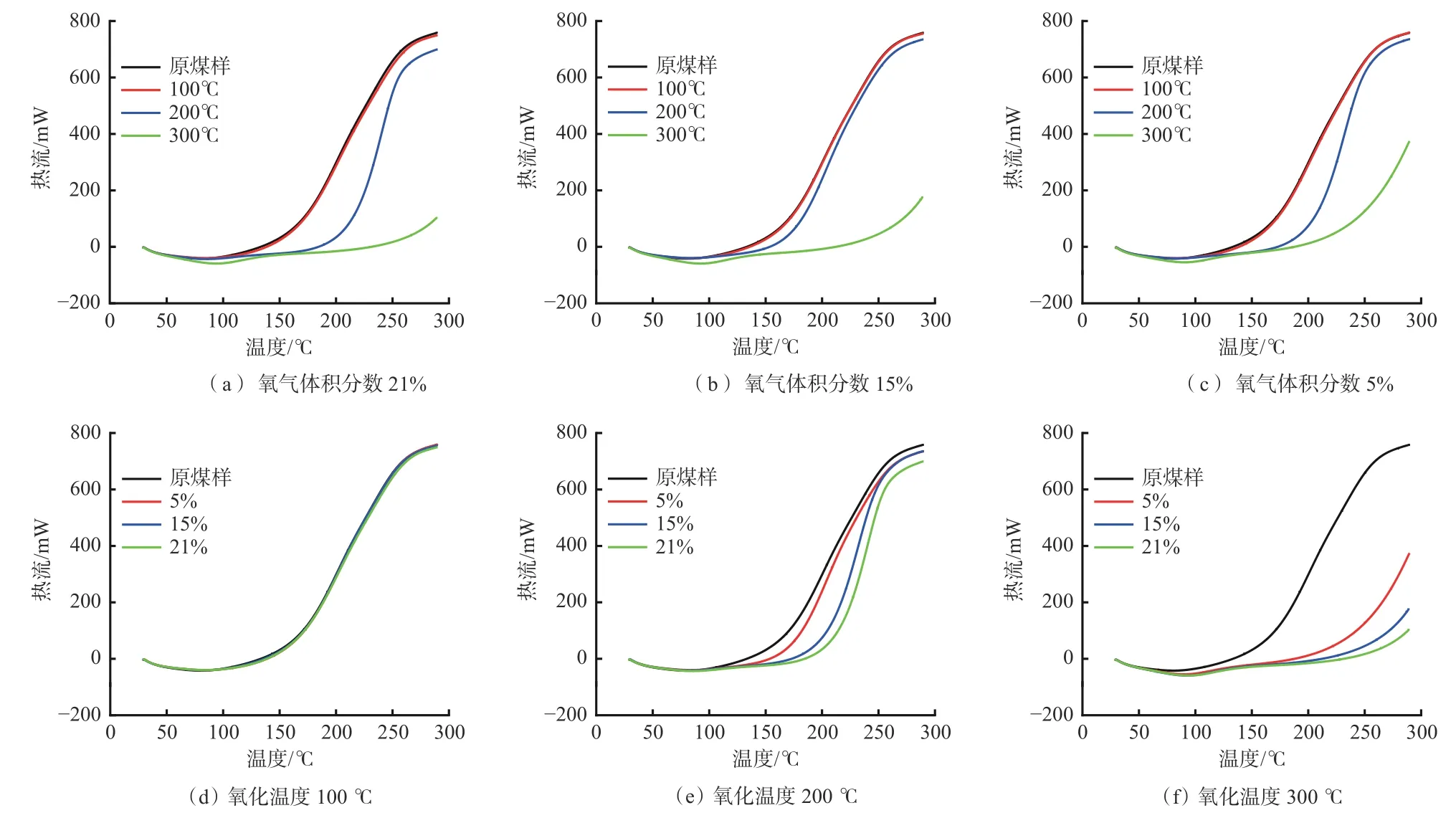
图2 预氧化煤和原煤样热流曲线Fig. 2 Heat flow curves of pre-oxidized coal and raw coal samples
预氧化煤和原煤样特征温度见表2。由于300 ℃预氧化煤的热流曲线严重滞后于原煤样,其热流曲线上并没有表现出增长率最大值,所以其t2不在表中显示。由表2可看出,预氧化煤的t1和t2都大于原煤样,且表现出随氧化温度升高逐渐增大,随氧气浓度降低逐渐减小的趋势,表明预氧化煤的低温氧化进程滞后于原煤样,且滞后程度随着氧化温度和氧气浓度的升高增大。这是由于在预氧化过程中预氧化煤已经进行了一定强度的煤氧复合反应,消耗了部分参与反应的活性结构[10],导致低温氧化反应过程中相同的温度下活性结构的数量减少,反应的放热强度小于原煤样,反应进程滞后,且氧化温度和氧气体积分数越高,活性结构消耗越多。此外,氧化温度相较于氧气体积分数对预氧化煤反应进程的影响更大,尤其当氧化温度为100 ℃时,不同氧气体积分数预氧化煤的t1和t2基本相等。表明氧气体积分数对预氧化煤低温氧化反应的影响在较高的氧化温度下才体现。这是因为当温度较低时,煤中被激活能够参与反应的活性结构较少,氧气体积分数的改变并不会对后续反应产生较大影响;而随着温度升高,活性结构增多,此时氧气体积分数的改变才会对反应产生较大影响。
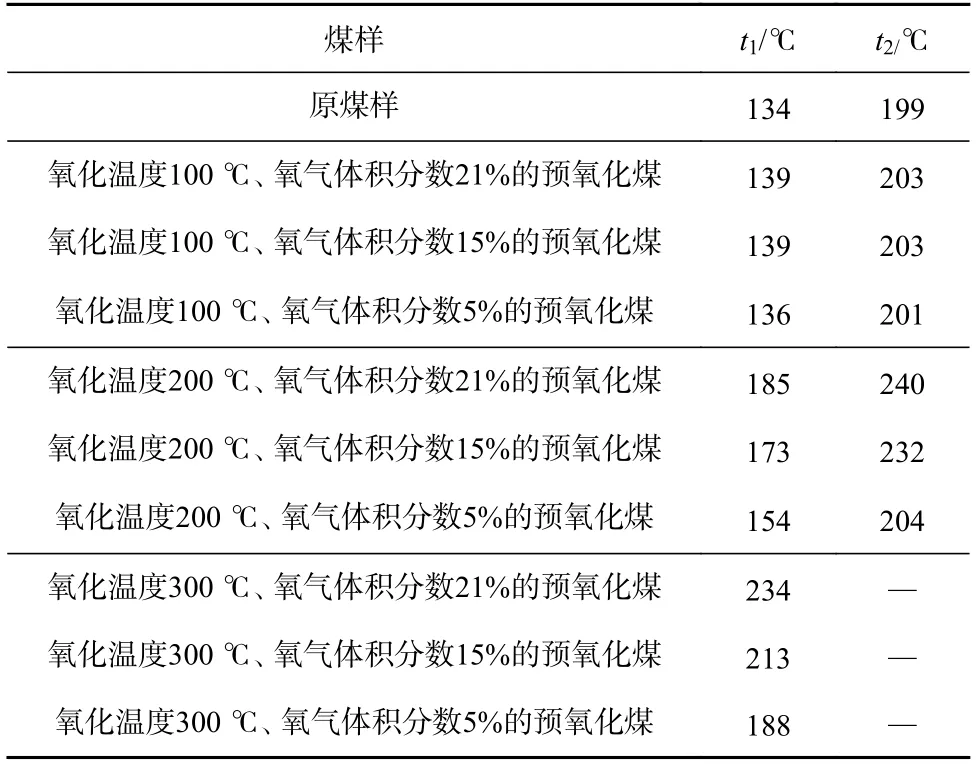
表2 预氧化煤和原煤样特征温度Table 2 Temperature characteristics of pre-oxidized coal and raw coal samples
2.3 热动力学特性
为了计算热动力学参数(活化能和指前因子)[11],在30~300 ℃的升温范围内每隔5 ℃选取一个点来计算ln((dQ/dT)(β/qm0)min)和T-1的值,并利用线性拟合将计算值进行拟合,结果如图3所示。由于预氧化煤低温氧化过程的缓慢氧化阶段表现为吸热,所以只计算加速氧化阶段和快速氧化阶段的热动力学参数。此外,氧气体积分数分别为21%和15%、氧化温度为300 ℃的预氧化煤低温氧化过程整体表现为吸热(Q<0),导致式(4)不适用于这2种煤样。

图3 预氧化煤和原煤样活化能拟合曲线Fig. 3 Fitting curves of activation energy of pre-oxidized coal and raw coal samples
从图3可看出,氧化温度为100 ℃的预氧化煤的活化能拟合曲线与原煤样基本一致,但随着氧化温度升高,两者的拟合曲线差异逐渐明显,表明预氧化煤发生氧化反应的难易程度差别于原煤样。
预氧化煤和原煤样低温氧化反应动力学参数见表3。氧气体积分数为5%、氧化温度为300 ℃的预氧化煤特征温度t2未在热流曲线上体现,难以计算出不同阶段的活化能,故不在表3中显示。且因为300 ℃的预氧化煤反应热远小于其他煤样,表明自燃风险低于其他煤样,所以无需再计算活化能。
通过预氧化煤热流曲线对时间进行积分可得预氧化煤低温氧化反应的放热量,在预氧化煤质量相等的情况下,反应热与实际放热量呈正相关。从表3可看出,预氧化煤低温氧化反应的反应热低于原煤样。表明预氧化煤低温氧化反应的放热量小于原煤样,这是因为预氧化煤已经进行了一定强度的煤氧复合反应,释放了部分热量,导致放热量较低。随着氧化温度升高,预氧化煤低温氧化反应的放热量逐渐降低,当氧化温度升高至300 ℃时,出现放热量<0(吸热)的现象。这是由于太高的氧化温度致使预氧化煤提前释放了更多热量。另外,在相等的氧化温度下,预氧化煤的放热量随氧气浓度降低逐渐增大,氧气浓度的降低抑制了煤氧复合反应,造成提前释放的热量减少[12]。氧化温度为100 ℃时,不同氧气浓度下预氧化煤的反应热基本相等,而随着氧化温度的升高,氧气浓度对反应热的影响才逐渐明显。表明氧气浓度对预氧化煤低温氧化反应的影响在较高的氧化温度下才体现。
从活化能数据可看出,预氧化煤低温氧化加速氧化阶段的活化能高于原煤样,表明预氧化煤氧化反应进入加速氧化阶段的门槛提高。这是因为在预氧化过程中,预氧化煤中的甲基、亚甲基、羟基等在煤氧复合反应初期参与反应的活性分子已被部分消耗[13],导致预氧化煤进行低温氧化反应时,相较于原煤样活性分子所占比例减小,发生反应的难度提高。但是,预氧化煤低温快速氧化阶段的活化能却低于原煤样,表明预氧化煤更容易进入快速氧化阶段。这是因为在预氧化过程中,温度随着煤氧复合反应的进行不断升高,预氧化煤中较为稳定的芳香环等大分子结构从普通状态变为活化状态的能量已经被部分给予[14]。所以,当预氧化煤低温氧化反应达到快速氧化阶段时,芳香环等大分子结构变为活化状态所需的能量降低,更容易发生反应。
指前因子越大表示预氧化煤低温氧化反应的反应速率越快[15],预氧化煤低温加速氧化阶段和快速氧化阶段的指前因子都高于原煤样,说明预氧化煤低温氧化反应更迅速,这是因为预氧化煤中的分子结构已经被不同程度活化,导致其低温氧化反应速率加快。
2.4 氧化温度和氧气体积分数对活化能的影响
预氧化煤低温加速氧化阶段和快速氧化阶段活化能随温度和氧气浓度变化规律如图4所示。从图4(a)可看出,在加速氧化阶段下活化能随氧化温度升高而增大,随氧气浓度升高呈先降低后升高趋势。表明氧气体积分数升高对预氧化煤低温氧化反应没有表现出一致的影响。这是因为氧气浓度升高导致煤氧复合反应加强,小分子活性结构消耗加剧,但同时也会使部分活性结构不同程度的活化。从图4(b)可看出,在快速氧化阶段不同氧化温度下,氧气浓度升高对预氧化煤活化能的影响不同。当氧化温度为100 ℃时,活化能随氧气浓度升高呈先降低后升高趋势,而氧化温度为200 ℃时则相反。这是由于氧化温度较低时,氧气浓度升高导致大分子结构活化程度大于消耗程度,导致活化能减小,而随着氧气浓度继续升高,煤氧复合反应加剧,消耗程度大于活化程度,导致活化能又增加。
综上表明,预氧化煤低温氧化过程的活化能没有随氧化温度和氧气浓度的变化表现出明显的规律性。这是因为煤低温氧化过程是一个极其复杂的过程,包含物理吸附、化学吸附及复合反应,氧在每种反应下有着不同的作用。在加速氧化阶段和快速氧化阶段主要进行化学吸附和复合反应,此过程中一部分煤与氧发生化学吸附生成不稳定化合物,化合物再分解吸收热量;一部分煤与氧发生复合反应放出热量,且化学吸附和煤氧复合是同时进行的平行反应。氧气浓度和氧化温度的升高,造成这2种反应强度动态改变,因此活化能没有表现出较强的规律性。
3 结论
(1) 预氧化煤的t1和t2都大于原煤样,且预氧化煤随氧化温度升高逐渐增大,随氧气浓度降低逐渐减小。预氧化煤低温氧化反应的放热量低于原煤样,且随着氧化温度和氧气浓度升高,放热量逐渐降低。
(2) 当氧化温度为100 ℃时,不同氧气浓度预氧化煤的t1,t2及低温氧化过程的反应热基本相等。随着氧化温度升高,氧气浓度对t1,t2及反应热的影响才逐渐明显。但是,太高的氧化温度导致预氧化煤低温氧化反应进程严重滞后且反应放热量<0。
(3) 预氧化煤低温加速氧化阶段的活化能高于原煤样,快速氧化阶段的活化能低于原煤样。由指前因子看出,预氧化煤低温氧化反应相较于原煤样更为迅速。
(4) 在加速氧化阶段下活化能随氧化温度升高而增大,随氧气浓度升高呈先降低后升高规律。而快速氧化阶段不同氧化温度下氧气浓度升高对预氧化煤活化能的影响不同。当氧化温度为100 ℃时,活化能随氧气浓度升高呈先降低后升高趋势,而氧化温度为200 ℃时则相反。
