累及下腔静脉及腹部多脏器多次复发腹膜后去分化脂肪肉瘤诊疗经验及文献分析
2022-08-13吴茂洁胡瀚魁张晓璐赵纪春
吴茂洁,胡瀚魁,张晓璐,张 林,黄 斌,赵纪春
四川大学华西医院血管外科/四川大学华西护理学院,四川 成都 614000
腹膜后脂肪肉瘤(retroperitoneal liposarcoma,RPL)是一种少见的恶性肿瘤,由于腹膜后腔隙的特殊解剖位置,患者早期无明显症状,通常确诊时肿瘤体积已经较大,给手术切除带来了难度,尤其复发的RPL,常累及腹膜后及腹腔多脏器及大血管,行根治性手术切除较为困难。本文报道1例术后多次复发腹膜后去分化脂肪肉瘤累及下腔静脉及腹部多脏器患者并文献复习,系统阐述其病因、发病机制及治疗方案,以期为临床治疗提供参考价值,现报道如下。
1 病历资料
患者男性,57岁,因“发现腹部包块3个月”2014年2月就诊于贵州当地医院(图1),行开腹肿瘤切除术。术后因腹痛、发热于2016年9月入院治疗,确诊为肠瘘并伴有腹膜炎及肿瘤复发(图2),遂行部分肠切除肠吻合术及肿瘤切除术。2019年4月15日再次出现发热,持续37.5 ℃左右,无畏寒、恶心、呕吐,腹部计算机断层扫描成像(computer tomography,CT)检查示右肝下间隙、右侧髂窝见不规则混杂密度肿块,约14.0 cm×10.9 cm×15.9 cm,不均匀强化,相邻肾周筋膜及腹膜增厚,与右侧髂腰肌分界不清(图3),考虑肿瘤复发,于四川大学华西医院行腹膜后肿瘤切除术、右侧输尿管探查松解、小肠修补、右侧腹膜后淋巴脂肪组织清扫术。术后病理学检查示间叶组织恶性肿瘤(肉瘤)、去分化脂肪肉瘤,术后恢复良好。2021年6月13日,患者无明显诱因出现阵发性下腹部撕裂样疼痛,伴腰背部刺痛,同时体重下降6 kg。2021年7月入院呈恶病质状态,腹腔极度膨隆,腹壁静脉扩张。查体示右腹压痛,可触及包块,质硬,活动度差,大小约20 cm×16 cm,腹腔极度膨隆,腹壁静脉扩张。实验室检查示中度贫血及低蛋白血症。增强CT提示右下腹巨大复发性肿瘤累及下腔静脉及腹部多脏器,不全肠梗阻及腹腔大量积液(图4)。既往病理切片经四川大学华西医院会诊后诊断为间叶组织恶性肿瘤(肉瘤),主要成分为梭形细胞肉瘤,其旁可见去分化脂肪肉瘤成分。经四川大学华西医院多科会诊后于2021年7月31日行原腹部正中切口至剑突下至耻骨联合处行肿瘤切除术。术中见腹腔广泛粘连,腹腔中等量腹腔积液,胆囊水肿,胆囊内可扪及结石,胃及全肠道高度水肿,分离肠粘连后见肿瘤主要位于右侧腹膜后区域,上方与胆囊及右肾上腺分解不清,内侧侵犯十二指肠水平段及左肾静脉平面以下腔静脉壁,右肾及肾血管被肿瘤完全包裹,后方包裹右侧输尿管,侵犯腰大肌及髂腰肌,腰丛神经被肿瘤包裹;肿瘤下方侵犯远端回肠约40 cm,包裹右侧髂总动脉及右侧精索。术中联合泌尿外科、胰腺外科行腹膜后巨大肿瘤切除+肾下腔静脉切除+左肾静脉成形术+右髂总动脉修补+右肾切除+右侧精索切除+右肾上腺部分切除+十二指肠水平段切除+十二指肠降段-空肠侧侧吻合+远端回肠切除吻合+空肠中段浆肌层修补+胆囊切除。术后CT示肿瘤大小约为25 cm×20 cm×10 cm(图5)。解剖组织呈黄色鱼肉样,质硬,部分钙化。术后病理检查示腹膜后去分化脂肪肉瘤,法国国立癌症中心联盟(French Federation of Cancer Center Sarcoma Group,FNCLCC)分级3级,免疫组织化学染色示肿瘤细胞呈CD34(灶 性+)、STAT6(-)、desmin(灶 性+)、SMA(-)、EMA(-)、CD117(-)、S-100(-)(图6)。荧光原位杂交技术(fluorescence in situ hybridization,FISH)检测结果示鼠双微粒体2(murine double minute 2,MDM2)基因扩增。术后患者恢复良好,随访半年(2022年2月)病情稳定,未见肿瘤复发、肠瘘、腹膜炎等并发症(图7)。
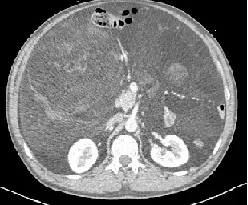
图1 2014年2月的腹部CT
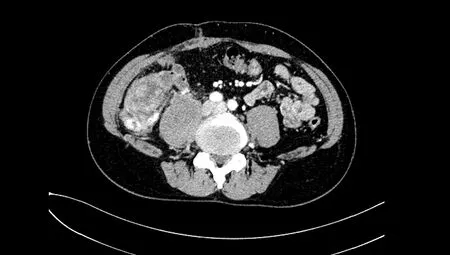
图2 第一次术后肿瘤复发(2016年9月)的腹部CT
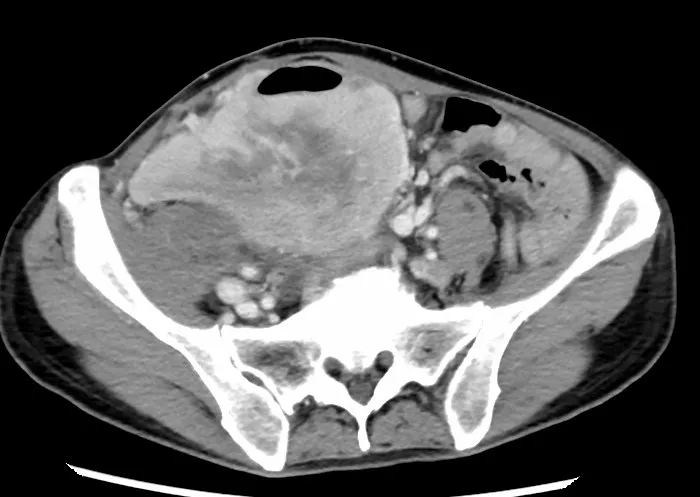
图3 第二次术后肿瘤复发(2019年4月)的腹部CT
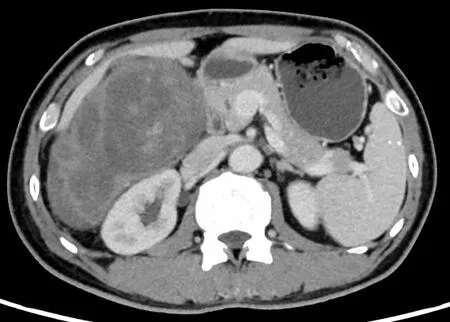
图4 第三次术后肿瘤复发(2021年7月)的腹部CT
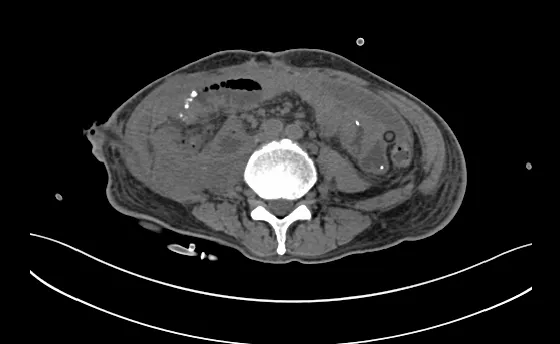
图5 第三次复发肿瘤切除术后(2021年8月)的腹部CT
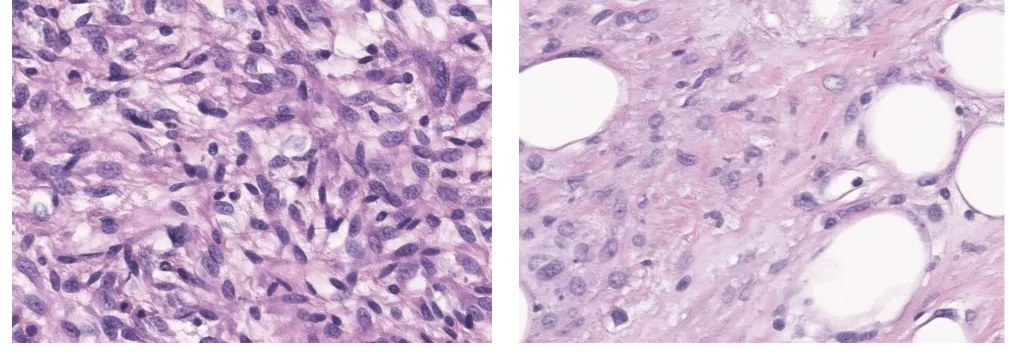
图6 腹膜后去分化脂肪肉瘤免疫组织化学染色
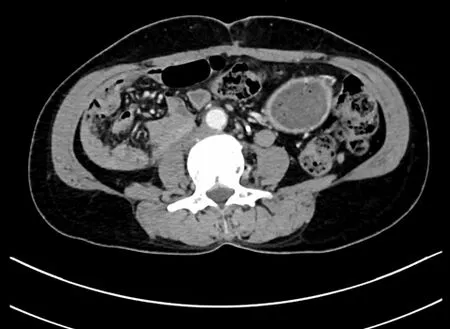
图7 随访半年(2022年2月)腹部CT
2 讨论
软组织肿瘤约占成年人肿瘤的1%,包括50多个亚型,其中12%~15%发生在腹膜后,而脂肪肉瘤约占70%[1]。中国癌症中心统计,脂肪肉瘤占所有软组织肿瘤的5.75%[2]。脂肪肉瘤起源于原始的间充质细胞,主要由脂肪细胞组成[3],可发生在任何存在脂肪的区域,但常见于四肢及腹膜后,中老年人多见,但无明显性别差异[4]。2018年,美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南将脂肪肉瘤分为4种亚型,即高分化型脂肪肉瘤/非典型性脂肪瘤、黏液性脂肪肉瘤、去分化脂肪肉瘤、多形性脂肪肉瘤[5]。Dalal等[6]发现,高分化型最常见(46%),其次是黏液样(28%)、去分化型(18%)和多形性亚型(8%)。去分化脂肪肉瘤多数为新发,少数来自于高分化脂肪肉瘤复发,且个体较大并呈现多结节性[4]。从严格的形态学角度来看,去分化脂肪肉瘤的传统定义为高分化脂肪肉瘤/非典型性脂肪瘤向高级别非脂肪瘤性肉瘤的肿瘤转变或进展[7],治疗脂肪肉瘤的关键在于早期精确地诊断和完整的手术切除[8]。
2.1 诊断
RPL的典型特征为腹部巨大肿块,早期一般无症状或症状较轻,因此早期诊断比较困难[9]。由于腹膜后腔隙可扩展的解剖特点,就诊时大部分患者已发展至晚期,肿块直径通常>20 cm[8]。一般情况下,患者因为肿瘤生长较大,出现腹部包块或肿瘤压迫胃肠道、泌尿系统、神经系统等相应的压迫症状而就诊[10]。肿瘤生长可压迫胃肠道,从而出现饱腹感、厌食、恶心、呕吐、腹胀、腹痛、腹泻及便秘等消化系统症状[11],也可压迫肾脏和膀胱引起肾积水等尿路梗阻表现或尿频、尿急不适[12],而巨大的肿瘤甚至可以压迫胸腔导致呼吸困难[13]。
腹部超声检查因其无创、费用低等特点可作为该病的初步筛查手段,可估算肿瘤的大小和数量[8]。腹部增强CT可初步判断肿瘤的病理类型和恶性程度,去分化脂肪肉瘤表现为密度不均匀的脂肪团块,发现肿瘤内的实性结节[14]。核磁共振(magnetic resonance imaging,MRI)对软组织成像效果较好,对腹主动脉、下腔静脉、输尿管等肿瘤侵袭性改变具有重要诊断价值。鉴于以上检查的成像特点,大西洋腹膜后肉瘤工作组(Transatlantic Retroperitoneal Sarcoma Working Group,TARPSWG)建议将腹部超声作为腹膜后去分化肉瘤的初步筛查手段,怀疑该病的患者均需行腹部增强CT和MRI检查[15]。对于RPL的诊断,欧洲医学肿瘤学会(European Society for Medical Oncology,ESMO)建议除了采取影像学诊断外,在条件允许下应当采用不小于14~16 G穿刺针活检[16],巨大的RPL患者除外[10]。本例患者多次复发,既往病理检查已经证实为去分化脂肪肉瘤,但仅进行了影像学检查,并没有行穿刺活检。
2.2 治疗
完全切除是治疗腹膜后去分化脂肪肉瘤的金标准,一旦诊断为腹膜后去分化脂肪肉瘤,无论大小都应当手术切除[10]。1998年,Lewis等[17]在一项针对500例RPL患者的单中心研究中发现,完全手术切除肿瘤且切缘为阴性的患者的中位生存期为103个月,然而,未完全切除肿瘤的患者的中位生存期仅为18个月左右。研究表明,未完全切除的RPL患者的5年、10年生存期分别为16.7%、8.0%[18]。研究显示,去分化脂肪肉瘤具有侵袭性局部生长及切除后局部复发的特点,远处转移相对少见,且由于不受控制的局部复发导致患者的病死率明显高于转移率,其局部复发率为40%,转移率为15%~30%[4]。上述研究结果充分说明完全切除在治疗腹膜后去分化脂肪肉瘤中的重要性。由于RPL手术时通常已经体积较大,考虑到手术的复杂性,目前主张开放性手术为主[10]。本例患者既往肿瘤多次复发并伴有手术切除病史,术前行胸腹部CT,无全身转移,复发的肿瘤与周围组织粘连紧密,因此采取开放手术,术中取原腹部正中切口并将切口延伸到剑突下及耻骨联合。对于肿瘤晚期患者,肿瘤与不可切除的重要器官紧密粘连的患者,或预计肿瘤全切后将会产生并发症的患者,仍可行手术治疗,尽可能切除肿瘤,减小肿瘤体积以减轻压迫症状,延长患者生存时间,提高其生活质量[19]。对于复发的腹膜后脂肪瘤患者,应当再次手术治疗[8]。
除手术切除外,部分学者建议术后辅助额外的放射治疗。Lee等[20]在一项针对77例RPL患者治疗的研究中发现,进行额外放射治疗后的局部复发率为38%,而未进行额外放射治疗的局部复发率为48%。其他研究表明,对于局部复发的腹膜后去分化脂肪肉瘤,未行放射治疗的患者3年局部复发率为49%,接受放射治疗的患者3年局部复发率为34%[21-22]。然而,增加了放射治疗并没有获得统计学意义的显著益处[10]。研究显示,接受新辅助放疗(先放射治疗缩小肿瘤体积再手术切除)的患者的总生存期为129.2个月,而辅助放疗(先手术切除再放射治疗)为84.3个月[22]。对于患有器官侵犯的肿瘤患者,术前适当的放射治疗可以缩小肿瘤体积,尤其是对于复发的去分化脂肪肉瘤,有利于手术切除[1,4]。未来需要联合多中心随机对照试验进一步明确放疗的有效性。
同放射治疗一样,虽然化疗不是治疗腹膜后去分化脂肪肉瘤的标准治疗方法,但当肿瘤无法切除或无法完整切除,或对放射治疗不敏感时,其仍然可作为一种治疗选择[23-24]。Gronchi等[25]在一项针对83例RPL患者采用新辅助化疗的Ⅰ/Ⅱ期临床试验中发现,切除肿瘤前接受3个周期的异环磷酰胺化疗联合放射治疗获得了一定的效果,证明了化疗的可行性,只是患者的长期预后仍然较差。因此,对于复发性腹膜后去分化脂肪肉瘤,化疗一定要慎重。
未来治疗腹膜后去分化脂肪肉瘤可能是多模式的,以手术切除为主,辅助以放射治疗、化疗,可减少肿瘤复发,改善患者生活质量,延长患者生命。因此,未来应关注该病的分子病理机制,开发出新的针对该病的靶向药物以改善患者的预后。
研究显示,肿瘤分级是影响RPL预后的唯一独立危险因素[25]。RPL常表现为瘤周脏器及脂肪浸润,联合脏器及腹膜后脂肪切除可提高切除率,但随着联合创伤的增加,手术风险及术后并发症随之增高[26-27]。本研究结果显示,本例患者既往3次行腹膜后肿瘤切除手术,本次因肿瘤再次复发于本院就诊,术中可见腹腔广泛粘连及中等量的腹腔积液,胃肠道高度水肿,肿瘤侵袭十二指肠水平段及左肾静脉平面以下腔静脉壁,并包裹右肾及肾血管和右侧输尿管,回肠远端、右侧腰大肌、髂腰肌、腰丛及右侧髂总动脉及精索受累,肿瘤波及范围广,手术难度大。肿瘤切除后第10天因腹腔引流管引流出血性液体而怀疑肠瘘可能,口服亚甲蓝,腹腔引流管引流出蓝色引流液后证实肠瘘,予以抑酸、保护胃肠、抗感染、营养支持治疗,血浆引流量减少,至拔管前未发生腹腔出血,患者恢复良好,顺利出院。出院后随访半年,患者病情稳定,未见肿瘤复发、肠瘘、腹膜炎等并发症。
综上所述,对于腹部非特异性症状的患者,尤其是合并腹部巨大包块的患者,应当高度怀疑RPL的可能。腹部超声可以作为常规的腹部筛查,而腹部增强CT及MRI可以初步判定腹部包块的性质及与周围软组织结构的关系。一旦考虑腹膜后去分化脂肪肉瘤,无论是初发还是复发,应首先考虑手术切除。联合脏器及腹膜后脂肪切除可提高切除率,所以需要手术医师具备丰富的普外科工作基础并多学科团队配合。由于腹膜后去分化脂肪肉瘤容易局部复发,尤其是多次复发性的病例,术后需要制定密切的随访体系,定期随访。随着科技的进步,未来治疗腹膜后去分化脂肪肉瘤可能是多模式的,手术切除联合新辅助可减少肿瘤复发,改善患者生活质量,延长患者生命。
