骨形态发生蛋白受体-ⅠA的单核苷酸多态性对后纵韧带骨化的影响
2022-08-12权学民赵昌松赵汝岗
权学民,张 耀,张 强*,赵昌松,王 浩,赵汝岗,马 睿
1.首都医科大学附属北京地坛医院骨科,北京 100015
2.首都医科大学附属北京天坛医院骨科,北京 100050
后纵韧带骨化症(OPLL)的特征是异位骨形成替代韧带组织[1-2]。OPLL在亚洲人中的发生率高于欧洲人和美国人,有报道[3]显示,OPLL在日本的发生率为1.9% ~ 4.3%,在中国为0.44% ~ 8.92%。目前OPLL的发生机制仍未完全阐明,遗传因素和环境因素在其发生过程中均起作用。既往研究[4-9]表明,遗传因素是OPLL的主要因素,并且和环境因素相互作用。骨形态发生蛋白(BMP)是转化生长因子-β(TGF-β)超家族的成员,BMP结合骨形态发生蛋白受体 -ⅠA(BMPR-ⅠA)、BMPR-ⅠB 和 BMPR-Ⅱ,通过Smad信号转导通路刺激成骨细胞分化[10-11]。BMPR-ⅠA是BMPR家族的一种亚型,在BMP信号转导通路中起着重要调节作用[12-14]。既往研究[10]表明,BMPR-ⅠA在异位骨化的发生、发展中起着重要作用。本研究旨在探讨BMPR-ⅠA在OPLL发展中的作用,评估其是否为OPLL的易感基因,现报告如下 。
1 材料与方法
1.1 主要试剂和仪器
DNA纯化试剂盒(Promega公司,美国);C3H10T1/2细胞(北京协和细胞库,中国);引物和pcDNA3.1-BMPR-ⅠA质粒(Invitrogen公司,美国);ABI 3730XL POP7 DNA测序分析5.2系统(Applied Biosystems公司,美国);Lipofectamine 2000转染试剂盒、胎牛血清和培养基(Invitrogen公司,美国);BMPR-ⅠA特异性单克隆抗体(Santa Cruz公司,美国);P-Smad1/5/8和Smad4多克隆抗体(CST公司,美国);碱性磷酸酶(AKP/ALP)测试盒和骨钙素(OST)测试盒(南京建成生物工程研究所,中国)。
1.2 材料获取
选择首都医科大学附属北京地坛医院和天坛医院收治的292例OPLL患者和586名非OPLL者(表1)。OPLL的诊断主要基于影像学检查,包括X线、CT和MRI。OPLL分型由侧位X线片和CT确定。根据影像学和实验室检查,排除强直性脊柱炎和其他代谢性疾病(如骨软化症、骨质疏松症、弥散性特发性骨骼肥大症或甲状旁腺功能亢进症)。本研究经医院伦理委员会审核批准(KY2011-005-01),所有参与者知情同意并签署知情同意书。
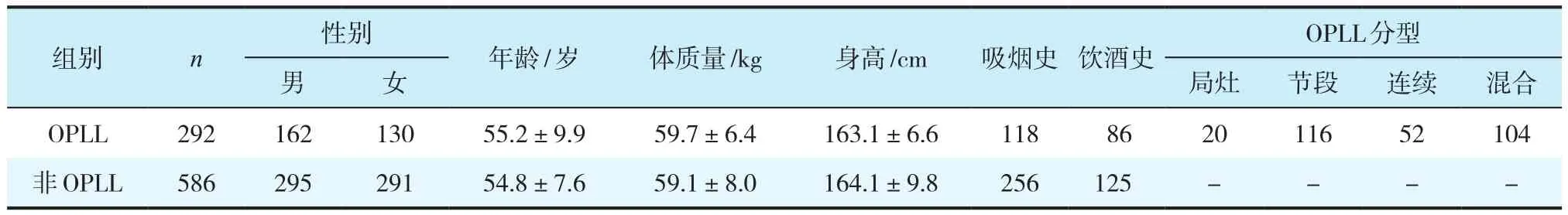
表1 2组患者一般资料
1.3 BMPR-ⅠA的单核苷酸多态性(SNP)扩增和基因分型
使用DNA纯化试剂盒分离DNA,通过PCR扩增整个BMPR-ⅠA编码序列,通过ABI 3730XL POP7 DNA测序分析5.2系统对PCR产物进行基因分型,相关引物见表2,排除杂合度未知且等位基因频率低于5%的SNP位点。
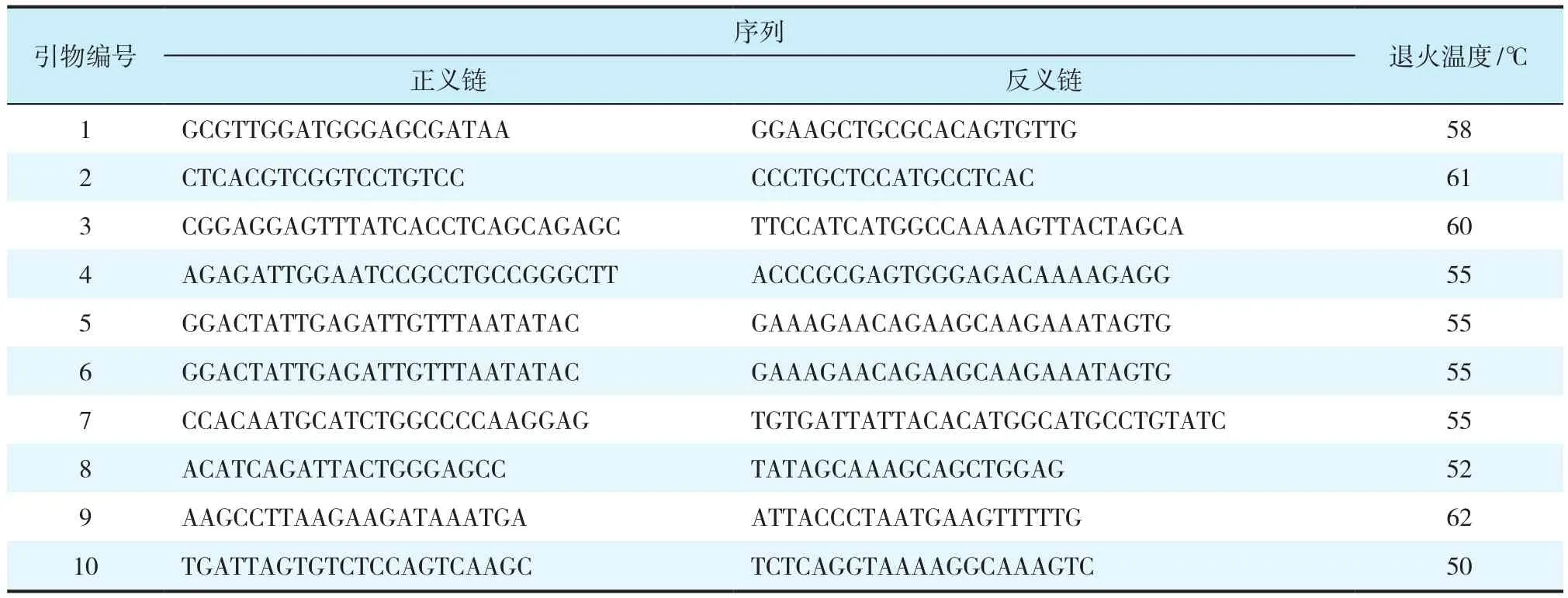
表2 BMPR-ⅠA引物序列
1.4 细胞模型构建
取第10代C3H10T1/2细胞,按照1.5×104/孔的密度接种于6孔板内,待细胞生长至60% ~ 80%汇合时,使用Lipofectamine 2000通过pcDNA3.1-BMP2质粒进行转染。随机将细胞分为6组:正常组、空载体组、野生型组、rs34755052单突变组、rs11528010单突变组和双突变组。
1.5 蛋白质印迹法检测各组BMPR-ⅠA、P-Smad1/5/8和Smad4的表达
用PBS缓冲液清洗3次,加入RIPA裂解液和蛋白酶抑制剂,匀浆器匀浆、4℃下12 000×g离心10 min(g=9.806 65 m/s2),取上清测定蛋白浓度,取等量蛋白提取物通过SDS-PAGE进行分离,电泳转移到硝酸纤维素膜上。将膜在5%脱脂牛奶的1×Tris缓冲盐水和1×TBST中封闭1 h,然后与特异性单克隆抗体在室温下孵育4 h,与二抗在室温下孵育1 h,通过化学发光进行显色,使用Kodak Image Station扫描并分析。
1.6 检测ALP和OC活性
将细胞转入50 mmol Tris(pH 7.40)中,并通过超声裂解。采用酶联免疫吸附法,37℃时以10 mmol对硝基苯基磷酸酯为底物的测定缓冲液(100 mmol Sigma221缓冲液含10 mmol MgCl2,pH 10.3)中测试细胞裂解物的ALP和OC活性。使用OD405的光密度读取反应混合物,并使用对硝基苯酚的标准曲线(P-NP 500 nmol/ml,Sigma)作为参考。
1.7 统计学处理
采用SPSS 25.0软件对数据进行统计分析,符合正态分布的计量资料以±s表示,Hardy-Weinberg平衡以及基因型和等位基因分布采用χ2检验,组间比较采用独立样本t检验;以P< 0.05为差异有统计学意义。
2 结 果
2.1 2组BMPR-ⅠA的SNP位点基因型和等位基因分布
共鉴定12个既往报道过的BMPR-ⅠA的SNP位点,其中,rs34755052(C/T)和rs11528010(C/A)的频率组间差异有统计学意义(P< 0.05,表3)。2个位点的基因型和等位基因分布比较,rs34755052(C/T)中“CC”“CT”和“TT”基因型差异有统计学意义(P< 0.05,表3),且OPLL组中“C”“T”等位基因的频率低于非OPLL组,差异有统计学意义(P<0.05,表3)。rs11528010(C/A)中的“CC”“CA”和“AA”基因型差异有统计学意义(P< 0.05,表3),且OPLL组中“C”“A”等位基因的频率低于非OPLL组,差异有统计学意义(P< 0.05,表3)。
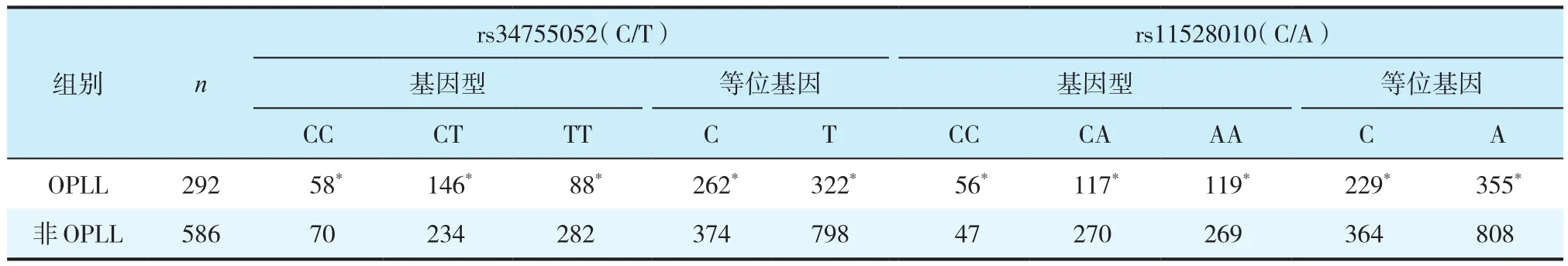
表3 2组rs34755052(C/T)和rs11528010(C/A)的基因型和等位基因分布
2.2 BMPR-ⅠA在各转染组的表达
蛋白质印迹法检测结果显示,野生型组、rs34755052单突变组、rs11528010单突变组、双突变组的BMPR-ⅠA蛋白表达明显高于正常组和空载体组,且各突变组均高于野生型组,差异具有统计学意义(P< 0.05,图1)。

图1 各转染组细胞BMPR-ⅠA蛋白表达
2.3 P-Smad1/5/8和Smad4在各转染组的表达
蛋白质印迹法检测结果显示,野生型组、rs34755052单突变组,rs11528010单突变组、双突变组的P-Smad1/5/8蛋白表达明显高于正常组和空载体组,差异具有统计学意义(P< 0.05,图2);且rs34755052单突变组和双突变组明显高于rs11528010单突变组和野生型组,差异具有统计学意义(P<0.05,图2)。各组P-Smad4蛋白表达差异无统计学意义(P> 0.05,图3)。
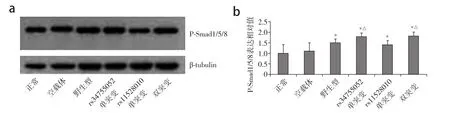
图2 各转染组细胞P-Smad1/5/8蛋白表达

图3 各转染组细胞P-Smad4蛋白表达
2.4 各转染组的ALP和OC活性
野生型组、rs34755052单突变组、rs11528010单突变组和双突变组的ALP活性明显高于正常组和空载体组,rs34755052单突变组高于其他突变组和野生型组,野生型组高于rs11528010单突变组,差异均有统计学意义(P< 0.05,表4)。
野生型组和rs34755052单突变组的OC活性明显高于正常组和空载体组,差异有统计学意义(P<0.05,表4)。
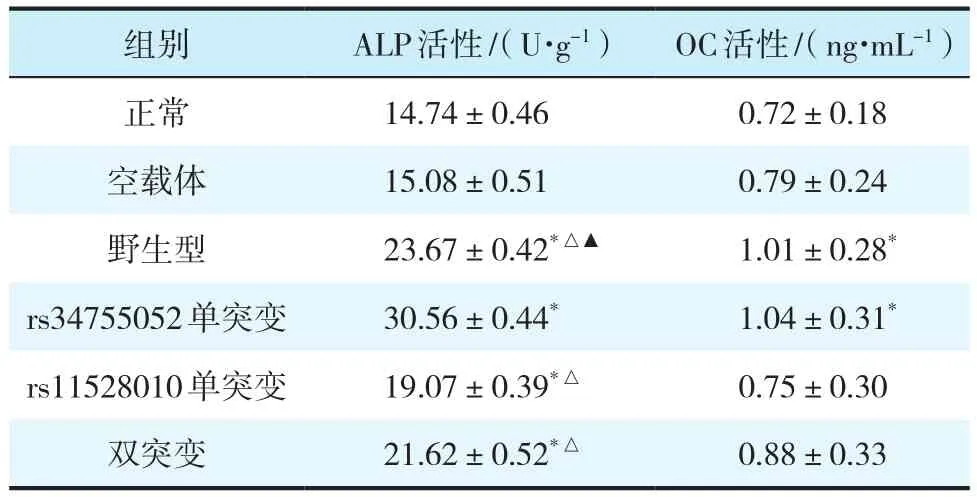
表4 各转染组细胞ALP和OC活性
3 讨 论
BMPR-ⅠA可能在OPLL发展的不同阶段发挥重要作用。首先,病理学研究[15]发现,BMPR在OPLL患者的骨化韧带组织中高表达;其次,免疫组织化学研究[16]表明,骨化基质中存在BMPR-ⅠA;此外,还有研究[17-18]表明,微调水平的BMPR-ⅠA介导的信号对于牙齿和颞下颌关节的发育至关重要。
本研究首先分析了BMPR-ⅠA整个编码区内的遗传变异是否与OPLL发生有关,共鉴定了12个SNP位点,发现OPLL患者和非OPLL者的rs34755052(C/T)和rs11528010(C/A)位点频率不同。比较OPLL患者和非OPLL者2个SNP位点的基因型和等位基因的分布发现,rs34755052(C/T)中“CC”“CT”“TT”基因型有差异,rs11528010(C/A)中的“CC”“CA”“AA”基因型有差异,表明“CT”基因型和“CA”基因型与OPLL的发生有关。但是,鉴于rs34755052(C/T)位于BMPR-ⅠA基因的上游,而rs11528010(C/A)位于BMPR-ⅠA基因的第3外显子,该SNP位点对OPLL遗传易感性的影响尚不确定。既往研究[19]发现,BMPR-ⅠA基因上游有部分转录因子结合位点影响了BMPR-ⅠA的表达,并导致原本具有不良成骨活性的细胞发生钙化。因此,本研究组进一步检测这些SNP位点是否影响BMPR-ⅠA的基因表达和细胞内信号转导。BMP信号通路主要通过Smad介导的信号转导途径发生,在BMP信号通路中,P-Smad1/5/8和Smad4是关键蛋白,而ALP和OC是成骨细胞特异性蛋白[13,20-22]。本研究发现,野生型组和各突变组表达的BMPR-ⅠA蛋白明显高于正常组和空载体组,而各突变组又高于野生型组,表明野生型或突变型载体可以成功转染到C3H10T 1/2细胞中并且可以稳定表达。野生型组和各突变型组表达的P-Smad1/5/8蛋白明显高于正常组和空载体组,其中rs34755052单突变组又高于其他突变组和野生型组,表明BMPR-ⅠA基因的rs34755052(C/T)位点与P-Smad1/5/8蛋白表达呈正相关。野生型组和各突变组ALP活性明显高于正常组和空载体组,其中rs34755052单突变组又高于其他突变组和野生型组,野生型组又高于rs11528010单突变组,表明BMPR-ⅠA基因的rs34755052(C/T)位点与ALP活性呈正相关。野生型组和rs34755052单突变组OC活性明显高于正常组和空载体组,表明BMPR-ⅠA基因的rs34755052(C/T)位点与OC活性呈正相关。综上,rs34755052(C/T)位点通过影响BMPR-ⅠA空间构象的核苷酸变化进而导致蛋白质功能异常。
早期的OPLL可采用非手术治疗,但大多数OPLL患者病情是进展性的,因此,常须手术治疗。近年来问世的新靶点药物或许能够为其提供新的治疗选择。Smad介导的信号通路在BMPR-ⅠA基因的SNP位点诱导OPLL的病理过程中起着重要作用,因此成为OPLL治疗的靶点之一,在以后的研究中,该领域还需要更进一步研究。有研究[23]发现,自然状态下骨化灶轴向长度每年增长约2.0 mm,厚度每年增长约0.2 mm,连续型和/或混合型骨化灶为骨化进展的主要危险因素。与自然进程相比,后路椎板切除融合术、各种前路手术均能减缓OPLL进展,而无内固定的椎板切除术、椎板成形术则会加快骨化进展。本研究中连续型和混合型OPLL患者约占53.4%,须引起重视。但是,该差异是否有其相应的遗传分子机制,尚须进一步研究。
本研究的局限性。首先,尽管C3H10T1/2细胞已被用作人类胚胎成纤维细胞的替代模型用来研究成骨细胞、脂肪细胞和软骨细胞分化的分子机制,但仍会出现不完全相同的表型导致偏差。其次,本研究组没有检测其他成骨基因的表达,例如Runt相关转录因子2(RUNX2)、Ⅰ型胶原蛋白alpha1(COL1A1)和骨桥蛋白(OPN),因此,无法了解其他易感基因及其致病性。此外,尽管BMPR-ⅠA基因中2个SNP位点与OPLL的发生有关,但其发生的详细机制仍然不完全清楚,在后续研究中,需要进一步研究明确BMPR-ⅠA的特定功能。
综上,BMPR-ⅠA是OPLL的易感基因之一。rs34755052(C/T)中的“CT”基因型和rs11528010(C/A)中的“CA”基因型与OPLL的发生有关。BMPR-ⅠA基因上游的rs34755052(C/T)位点与P-Smad1/5/8蛋白表达水平及ALP和OC活性呈正相关。Smad介导的信号通路在BMPR-ⅠA诱导OPLL的病理过程中起着重要作用。
