青黄散加解毒化瘀方治疗骨髓增生异常综合征疗效及对患者血清可溶性细胞间黏附分子-1、转化生长因子-β1的影响
2022-08-12尹婉宜张丽红王建英
尹婉宜,沈 扬,张丽红,马 兵,王建英,杨 柳
(河北医科大学第一医院血液内科,河北 石家庄 050031)
骨髓增生异常综合征(Myelodysplastic syndromes,MDS)是克隆性造血干、祖细胞发育异常,导致恶性转化风险增高,严重威胁患者的身体健康及生命安全[1-2]。目前临床治疗中以缓解或稳定患者病情,从而延长患者生存期为主要治疗目标。目前临床西医诊疗中以地西他滨等药物治疗为主,通过抑制DNA甲基化转移酶活性,阻断恶性细胞快速分裂,临床效果显著[3]。但随着近些年研究的不断分析发现[4-5],部分活动期且血常规偏离正常值幅度较高的MDS患者预后情况不容乐观,病情进展及病死率均较高。中医理论认为[6-7],依据MDS患者临床表现可将其归于中医“血证” “髓毒劳”等范畴,由邪毒入侵、精血素亏所致,可施以解毒化瘀之法。青黄散以青黛等入药,具有凉血解毒之效[8];解毒化瘀方以大黄炭、山苦荬等调剂,消肿解毒的药效显著[9]。有相关学者发现[10],可溶性细胞间黏附分子(sICAM-1)及转化生长因子β1(TGF-β1)作为急性髓系白血病的灵敏指标,随着MDS患者病情进展均出现异常表达。但目前尚无研究以青黄散加解毒化瘀方联合基础西医应用于MDS治疗,能否改善患者血常规及血清sICAM-1、TGF-β1水平尚未可知。基于此,本研究通过选取我院76例MDS患者进行研究,以分析青黄散加解毒化瘀方在骨髓增生异常综合征中的应用效果。
1 资料与方法
1.1 一般资料 选取我院2019年11月至2021年2月收治的76例MDS患者作为研究对象,随机分为试验组和对照组,各38例。试验组女17例,男21例;年龄18~64岁,平均(46.39±5.02)岁;平均病程(29.63±4.17)个月;合并症:高血脂2例,高血压6例。对照组女14例,男24例;年龄18~64岁,平均(47.11±4.87)岁;平均病程(30.15±4.29)个月;合并症:高血压4例,高血脂3例。两组一般资料比较差异无统计学意义(P>0.05)。
病例纳入标准:①均符合《骨髓增生异常综合征的诊断分型与预后判断及疗效标准》[11]中MDS的临床诊断;②均符合《骨髓增生异常综合征中医临床实践指南》[12]中髓毒劳的临床诊断;③中医临床症状表现,主症:脉络瘀血、心悸气滞、目胞浮肿、舌紫瘀斑等;次症:眼花耳鸣、骨蒸盗汗、脉大无力、小便清长,符合中医辨证分型中毒瘀阻滞证;④年龄≥18岁;⑤患者家属签署知情同意书。排除标准:①自行终止研究或转院者;②肝肾功能障碍;③心肌梗死或脑卒中等严重心脑血管病史;④精神病或严重意识障碍,不具备基础沟通能力;⑤合并活动期肺结核、慢性阻塞性肺疾病等呼吸系统传染性疾病;⑥哺乳或妊娠期女性;⑦合并器官或组织恶性病变。
1.2 治疗方法 两组患者入院后均予以饮食及睡眠调整,同时根据贫血或感染等情况予以患者红细胞悬液输注或抗生素抗感染治疗,同时予以护胃、保肝等药物辅助。
1.2.1 对照组:予以西医治疗方案。入院后1~5 d内每日静脉滴注地西他滨注射液(国药准字B20022627)20 mg/m2,连续静脉输注1 h,每4周重复1个周期,维持治疗4个周期后评估临床疗效。
1.2.2 试验组:西医治疗方案同对照组,同时联合青黄散加解毒化瘀方治疗,青黄散为院内自制胶囊或散剂,0.4 g/次,含青黛0.24 g,雄黄0.16 g,外兼热毒炽盛、血瘀出血加大黄炭25 g,生地榆20 g,三七12 g;瘀阻肿毒明显加蒲公英、生薏苡仁各25 g,苦碟子 20 g,白及10 g,诸剂混匀,适量清水浸泡35 min后捞取,加清水800 ml包煎,药液浓缩至200 ml,早晚各口服1次。
1.3 观察指标
1.3.1 中医症候积分:对两组患者治疗前及治疗4个月后的中医症状进行评分,各症状由轻至重评分依次为:主症无(0分)、轻度(2分)、中度(4分)、重度(6分);次症无(0分)、轻度(1分)、中度(2分)、重度(3分),得分为各症状评分之和[13]。
1.3.2 血清学指标:于患者治疗前及治疗4个月后分别采集其空腹外周静脉血4 ml,离心分离(3000 r/min,半径13.5 cm)后,取上清,以酶联免疫吸附法检测血清sICAM-1、TGF-β1水平。sICAM-1试剂盒购自菲恩生物科技有限公司,TGF-β1试剂盒购自上海酶联生物科技有限公司。
1.3.3 外周血常规检测:分别于患者治疗前及治疗4个月后采用TBA-2000FR型全自动生化分析仪(日本东芝)检测患者血小板(PLT)、血红蛋白(Hb)及白细胞计数(WBC)水平。
1.3.4 不良反应:记录两组患者治疗期间胃肠道反应、高血压等不良反应发生率。
1.4 疗效标准 症状基本消失、骨髓检查示原始细胞<0.05,Hb>100 g/L,中性粒细胞数≥1.5×109/L,PLT≥100×109/L为基本缓解。症状基本消失,骨髓原始细胞较治疗前降低≥50%或MDS转化为轻度亚型为部分缓解。症状改善,但骨髓原始细胞较治疗前降低<50%为稳定。症状无改善或加重,病情进展为白血病或死亡为进展。病情控制率=[(基本缓解+部分缓解+病情稳定)例数/总例数]×100%。
1.5 统计学方法 采用SPSS 23.0统计学软件进行分析。计数资料以[例(%)]表示,采用卡方检验;计量资料以均数±标准差表示,用t检验;P<0.05表示差异具有统计学意义。
2 结 果
2.1 两组患者治疗前后中医证候积分比较 见表1。治疗后两组主症及次症评分较治疗前降低,对照组均高于试验组(P<0.05)。

表1 两组患者治疗前后中医证候积分比较(分)
2.2 两组患者临床疗效比较 见表2。试验组临床疗效优于对照组(P<0.05)。

表2 两组患者临床疗效比较[例(%)]
2.3 两组患者治疗前后血清学指标比较 见表3。治疗后,两组患者的血清sICAM-1水平均低于治疗前,且试验组低于对照组(P<0.05);两组治疗后TGF-β1水平均高于治疗前,且试验组高于对照组(P<0.05)。
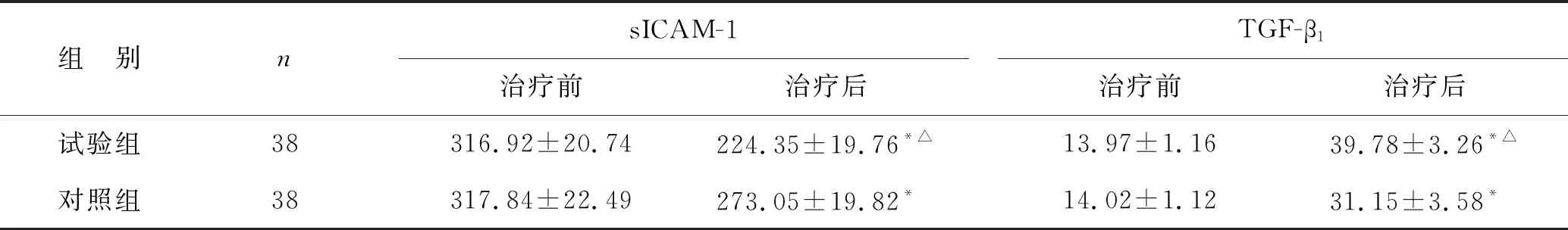
表3 两组患者治疗前后血清学指标比较(ng/ml)
2.4 两组患者治疗前后血常规指标比较 见表4。治疗后,两组PLT、Hb、WBC水平较治疗前升高,试验组PLT、Hb水平均高于对照组(P<0.05)。

表4 两组患者治疗前后血常规指标比较
2.5 两组不良反应发生情况比较 试验组不良反应发生率为10.53%,包括高血压1例,胃肠道反应3例;对照组不良反应发生率为7.89%,包括高血压2例,胃肠道反应1例。两组不良反应发生率比较差异无统计学意义(χ2=0.157,P>0.05)。
3 讨 论
MDS作为血液科常见的克隆性重疾,易表现出显著病态造血,诱发因素较多且致病机制尚未完全明晰,对患者的生命安全造成严重威胁[14-15]。目前,异体造血干细胞移植(Allo-HSCT)作为MDS治愈的唯一手段,受限于供体源匹配,临床治愈率较低,因此目前临床治疗中以缓解或稳定患者病情,从而延长患者生存期为主要治疗目标。地西他滨等常规西医药物虽可在一定程度上通过抑制DNA甲基化转移酶活性,进而抑制MDS及白血病等相关恶性细胞的增殖及分化,但临床疗效有限,患者病情进展率仍较高,预后不佳[16-17]。因此,如何在保证患者给药安全性的同时,进一步改善患者血常规指征,提高患者临床疗效成为近些年临床学者亟需突破的瓶颈。
中医辨证论治理论认为[18-19],MDS究其病症可归属“血证”“髓毒劳”“内伤发热”等范畴,分析其由邪毒侵入所致精血亏损,加之久病失养,劳积内伤所致气血久虚不复,继而血气不畅、血瘀毒积,应施以解毒化瘀、凉血益气之法。青黄散加解毒化瘀方中以青黛、雄黄为主药,外兼热毒炽盛、血瘀出血者加大黄炭、生地榆、三七,瘀阻肿毒明显者加蒲公英、生薏苡仁、山苦荬、白及。青黛可凉血解毒;雄黄可解毒杀虫、燥湿祛痰;大黄炭可凉血止血;生地榆可清热凉血;三七可散瘀止血、消肿定痛;蒲公英可散结消痈、养阴凉血;生薏苡仁可利水除痹、清热排毒;山苦荬可清热凉血、消痈止痛。诸剂合用,共奏解毒化瘀、凉血益气的功效,有助于进一步提升MDS的临床治疗效果。
本研究中试验组治疗后中医症候积分低于对照组,且疾病控制率较对照组更低,临床疗效更为优越,提示青黄散加解毒化瘀方应用于毒瘀阻滞证MDS患者治疗中,有利于促进患者症状恢复,提升临床疗效。现代中医理论研究证实[20],青黛中主要成分靛玉红可导致变性或快速异常分裂细胞溶胀性坏死,具有破坏白血病细胞的作用,均有助于稳定MDS病情进展。另本研究通过对两组患者治疗前后血常规分析,治疗后试验组PLT、Hb水平更高,表明青黄散加解毒化瘀方应用于MDS治疗中,有助于改善患者血常规,促进患者血液细胞水平恢复。本研究中试验组治疗后血清sICAM-1水平低于对照组,且血清TGF-β1水平高于对照组,提示青黄散加解毒化瘀方应用于毒瘀阻滞证MDS患者治疗中,可有效调节细胞免疫因子水平。本研究中两组患者治疗后均未出现严重不良反应,提示青黄散加解毒化瘀方安全性良好。
综上所述,予以MDS患者青黄散加解毒化瘀方治疗,有助于促进症状恢复,改善血常规指标水平,调节血清免疫因子水平,提升临床疗效,且安全性良好。
