长链非编码RNA SNHG20通过miRNA-140-5p调控TLR4-NF-κB轴影响脓毒症心肌损伤
2022-08-12陈文丽干学东
陈文丽 郑 芳 干学东
1湖北省浠水县人民医院心内科 湖北 黄冈 438200;2武汉大学中南医院心内科 湖北 武汉 430071
脓毒症是由细菌感染、手术、创伤等引起的全身炎症反应综合征,进一步发展可导致器官衰竭或死亡[1,2]。研究表明,肿瘤坏死因子(TNF)-α和白细胞介素(IL)-1β等炎症因子通过促进巨噬细胞的过度激活、分化以及刺激巨噬细胞分泌IL-6、IL-8等其他炎症因子,从而对心肌产生负性作用,导致脓毒症心肌损伤[3]。据报道,心肌损伤与脓毒症患者的高死亡率密切相关[4]。因此,阐明脓毒症诱导心肌损伤的发病机制对其今后的防治具有重要意义。
长链非编码RNA(long non coding RNA,lncRNA)是一类长度大于200个核苷酸、不被翻译成蛋白质的RNA,尽管缺乏蛋白质编码功能,lncRNA依然可以在转录和转录后水平调控基因的表达,进而参与多种疾病的进展[5,6]。越来越多的研究发现,多种类型lncRNA广泛参与了心肌损伤的进展。
小核仁RNA宿主基因20(small nucleolar RNA host gene 20,SNHG20)是位于17q25.2的lncRNA,长度为2 183 bp。前人的研究已证实,SNHG20参与了多种病理过程。在本研究中,我们构建了脂多糖(lipopolysaccharide,LPS)诱导的脓毒症心肌损伤模型,发现SNHG20在LPS的诱导下表达上调,同时LPS还以剂量和时间依赖性的方式抑制了miR-140-5p的表达。通过敲低SNHG20在LPS诱导的心肌损伤的表达,我们发现心肌细胞损伤和炎症反应显著减弱。进一步通过生物信息学分析发现,miR-140-5p是SNHG20和Toll样受体4(TLR4)的靶点。由此我们推测,在LPS诱导的脓毒症心肌损伤模型中,SNHG20可以通过抑制miR-140-5p调控TLR4/核转录因子(NF)-κB通路介导的炎症反应。这将从分子层面为脓毒症介导的心肌损伤的临床治疗提供一些新的参考思路。
1 材料与方法
1.1 细胞培养和转染H 9C2心肌细胞购自中国科学院细胞中心(中国上海)。细胞用含10%胎牛血清(fetalbovineserum,FBS;Thermo Fisher Scientific,MA,USA)和1%青霉素/链霉素(Invitrogen,CA,USA)的RPMI1640(Thermo Fisher Scientific,MA,USA)培养液、置于37℃、CO2体积分数为5%的培养箱中培养。在细胞的对数生长期采用0.25%胰 蛋 白 酶(Thermo Fisher Hy Clone,Utah,USA)进行消化传代。
靶向SNHG20的过表达质粒(SNHG20),低表达质粒(Si-SNHG20)及其相应的阴性对照(vector和Si-NC),miR-140-5p模拟物(miR-140-5p mimic),miR-140-5p抑制剂(anti-miR-140-5p)和阴性对照miR-NC由广州复能基因有限公司设计并合成。处于对数生长期的H 9C2细胞接种在24孔培养板中(5×105/孔)中。待细胞生长稳定,采用Lipofectamine 2000(Invitrogen,中国上海)将上述表达载体导入细胞中。
1.2 CCK 8法取对数生长期的H 9C2细胞,使用胰酶消化后,调整细胞密度至2×103/mL后,接种于96孔板,每孔100μL细胞悬液,每组设3个复孔。然后采用CCK 8试剂盒(Beyotime Biotechnology,中国上海)检测细胞活性[以450 nm波长下的光密度(OD)值表示]。
1.3 流式细胞术检测细胞凋亡H 9C2细胞在不同因素处理完毕后,用胰酶消化液消化细胞,通过离心(1 500 r/min,3 min)收集细胞。所得细胞按细胞凋亡检测试剂盒(上海泽叶生物试剂公司,中国,货号:ZY 140626)说明书步骤操作。
1.4 q RT-PCR用TRIzol试剂从H 9C2细胞中提取总RNA。根据制造商的说明书,RNA用PrimeScript™RT Reagent kit(Invitrogen,Shanghai,China)反转录成cDNA。qPCR采用Bio-Rad CFX96定量PCR系统和SYBR,按厂家规程进行。β-actin用于检测的SNHG20、TLR4、IL-6、IL-1β、TNF-α的内参,U6为检测miR-140-5p的内参。采用2(-ΔΔCt)方法进行统计。每个实验重复3次。引物序列见表1。

表1 各基因的引物序列
1.5 Western Blot收集H 9C2细胞,并用冷PBS清洗3次,加入100~200μL RIPA裂解液(Beyotime Biotechnology,中国上海),在冰水中超声裂解细胞,采用Bradford法测定蛋白质浓度。各组取等量蛋白进行10%SDS-PAGE电泳,将凝胶上的蛋白转移至PVDF膜(Millipore,Bedford,MA,USA)上。膜在4℃封闭1 h,加入一抗(浓度为1∶1 000)Anti-p-NF-κB p65 antibody(ab28849),Anti-NF-κB p65 antibody(ab7549),Anti-Caspase3 antibody(ab13847),Anti-Bcl2 antibody(ab182858),Anti-TLR4 antibody(ab13556),Anti-β-actin antibody(ab6276),4℃过夜。再用TBST洗膜2次后,在室温下,与荧光素标记的二抗羊抗兔(ab205718,1∶2 500)室温孵育1 h,以上抗体均来自Abcam,Cambridge,UK)洗膜3次后即用ECL显色剂(Millipore,Bedford,MA,USA)曝光。
1.6 双荧光素酶活性实验野生型SNHG20、TLR4及突变型SNHG20、TLR4的目的片段被构建 并 整 合 入pGL3 vector(Promega,Madison,WI,USA)以构建pGL 3-SNHG20-wild type(SNHG20-WT)、pGL 3-TLR4-wild type(TLR4-WT)以 及pGL 3-SNHG20-mutant(SNHG20-MUT)、pGL 3-TLR4-mutant(TLR4-MUT)reporter vector。将SNHG20-WT、TLR4-WT或SNHG20-MUT、TLR4-MUT与miR-140-5p或阴性对照物共转染。转染48 h后,按照制造商的说明测定荧光素酶活性。所有实验一式三份,重复3次。
1.7 RNA免疫共沉淀(immune-precipitation,RIP)按照制造商的规程,使用Magna RIP RNA结合蛋白免疫沉淀试剂盒进行RIP分析(Millipore,Bedford,MA,USA)。收集处于80%汇合阶段的心肌细胞,并使用RIP裂解缓冲液裂解。然后,使用抗Ago2抗体(Abcam,Shanghai,China)进行Ago2免疫沉淀,并将免疫球蛋白G(IgG)抗体用作阴性对照。最后,分离出免疫沉淀的RNA,并通过qRTPCR分析结合部分中的miR-140-5p、SNHG20、TLR4的丰度。
1.8 数据分析本研究中数据全部采用SPSS 17.0统计分析软件(SPSS Inc.,Chicago,IL,USA)进行分析;计量资料采用均数±标准差(±s)表示,组间比较采用单因素方差分析,如果组间均数有差异,采用Newman-Keuls方法进行组间两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 脂多糖促进了SNHG20的表达并抑制了miR-140-5p的表达为了研究LPS处理对SNHG20和miR-140-5p表达的影响,我们使用不同浓度(0、25、50、100、150μg/mL)的LPS处理H 9C2心肌细胞或心肌细胞暴露于100μg/mL的LPS中不同时间(6、12、24、48 h)。采 用qRT-PCR实 验 检 测SNHG20和miR-140-5p表达,结果显示,LPS以剂量和时间依赖性地方式促进了SNHG20的表达(P<0.05,图1A、1B)。相反,LPS以剂量和时间依赖性的方式抑制了miR-140-5p的表达(P<0.05,图1C、1D)。这表明,SNHG20和miR-140-5p可能和LPS诱导的心肌细胞进展有关。

图1 LPS对SNHG20和miR-140-5p表达的影响
2.2 敲低SNHG20减弱了LPS介导的心肌细胞损伤为了分析SNHG20在LPS介导的心肌细胞损伤中的潜在功能,我们采用si-RNA下调心肌细胞中SNHG20的水平(P<0.05,图2A)。在H 9C2细胞中分别转染SNHG20敲低质粒以及它的阴性对照并采用LPS(100μg/mL)作用于H 9C2细胞24 h。CCK8的结果显示LPS的处理显著抑制了细胞活力,而这种效应被SNHG20敲除减弱(P<0.05,图2B)。采用流式细胞术检测细胞凋亡情况发现,与对照组相比,暴露于LPS的心肌细胞凋亡率明显增加,而这种变化被SNHG20敲除显著削弱(P<0.05,图2C)。Western Blot的结果也显示,LPS显著促进了促凋亡蛋白Caspase3的表达并抑制了抑凋亡蛋白Bcl2的表达。而与LPS+Si-NC组比较,敲低SNHG20后结果则相反(P<0.05,图2D)。进一步通过qRT-PCR检测炎症因子TNF-α、IL-1β、IL-6的水平,发现LPS显著促进了上述因子的表达,而这种效应被SNHG20敲除显著削弱(P<0.05,图2E)。由此可见,LPS诱导了心肌细胞损伤,而敲低SNHG20则减弱了LPS诱导的细胞损伤。
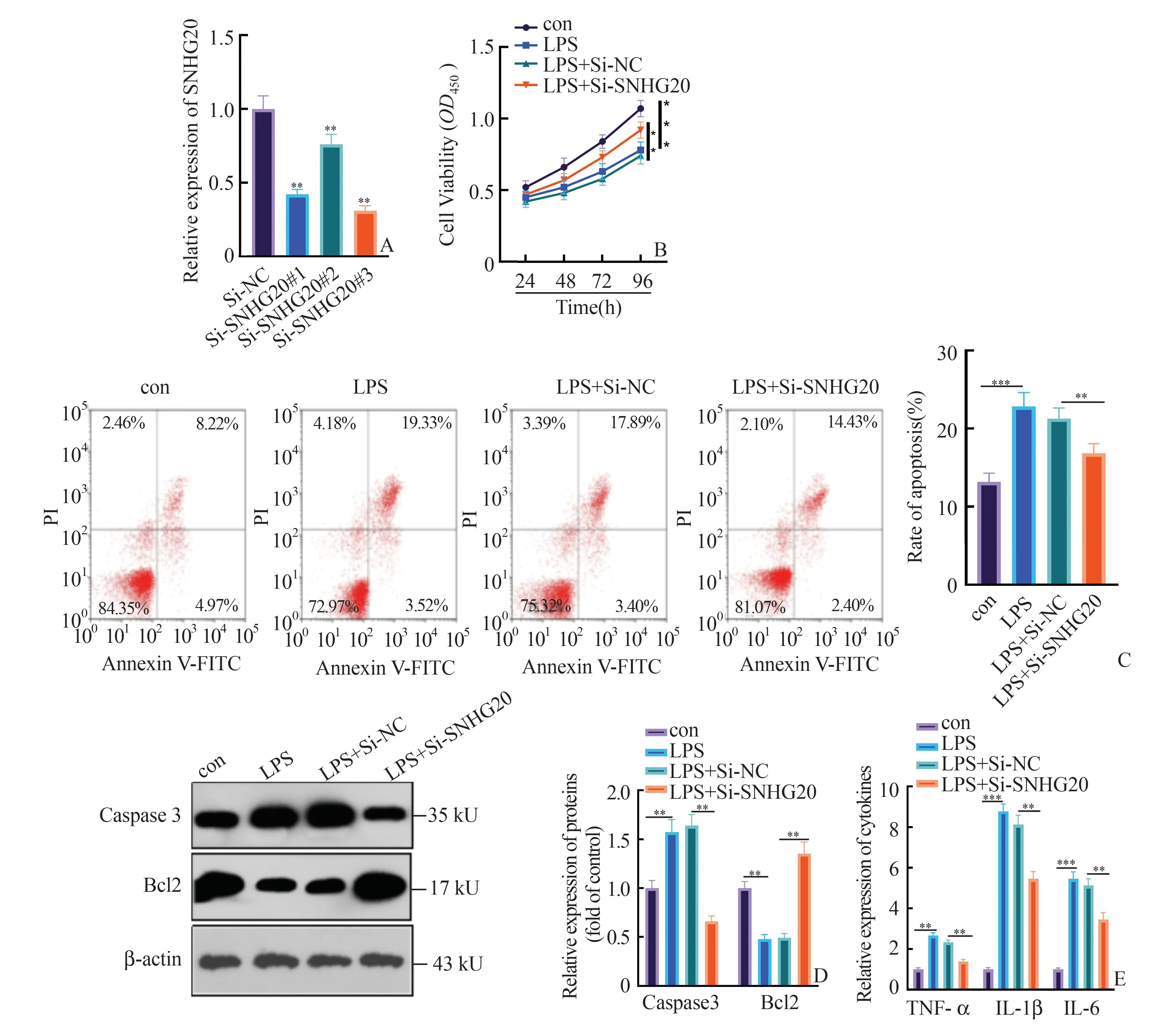
图2 敲低SNHG20减弱了LPS介导的心肌细胞损伤
2.3 SNHG20靶向miR-140-5p通过Starbase数据库(http://starbase.sysu.edu.cn/)我们发现miR-140-5p与SNHG20的结合位点如图3A所示。为进一步明确miR-140-5p与SNHG20之间的关系,我们实施了双荧光素酶活性实验和RIP法。结果显示,miR-140-5p mimic显著抑制了转染SNHG20-WT载体的细胞的荧光素酶活性,而对转染SNHG20-MT载体的细胞的荧光素酶活性无显著影响(P<0.05,图3B)。此外,RIP结果表明,转染miR-140-5p mimic的细胞中可以富集到更多的SNHG20(P<0.05,图3C)。这表明,miR-140-5p是SNHG20的靶点。我们进一步在转染SNHG20过表达质粒或SNHG20敲低质粒的H 9C2心肌细胞中检测miR-140-5p的表达以分析SNHG20对miR-140-5p表达的影响。如图3D所示,SNHG20敲低显著增加了miR-140-5p的表达,而过表达SNHG20则降低了miR-140-5p的表达。有趣的是,我们还发现miR-140-5p负调节SNHG20的表达(P<0.05,图3E)。这表明,SNHG20直接与H 9C2心肌细胞中的miR-140-5p相互作用并下调其表达。

图3 SNHG20靶向抑制了miR-140-5p的表达
2.4 miR-140-5p下调了TLR4-NF-κB通路为了研究LPS处理对TLR4表达的影响,我们在LPS诱导的H 9C2心肌细胞中检测了TLR4的相对基因水平,结果表明,LPS以剂量和时间依赖性地方式促进了TLR4的表达(P<0.05,图4A、4B)。Western Blot的结果也显示,在LPS诱导的H 9C2心肌细胞中TLR4-NF-κB的蛋白表达明显上调(P<0.05,图4C)。通过Starbase数据库(http://starbase.sysu.edu.cn/)我们发现miR-140-5p与TLR4的结合位点如图4D所示。为进一步明确miR-140-5p与TLR4之间的关系,我们实施了双荧光素酶活性实验和RIP法。结果显示,miR-140-5p mimic显著抑制了转染TLR4-WT载体的细胞的荧光素酶活性,而对转染TLR4-MT载体的细胞的荧光素酶活性无显著影响(P<0.05,图4E)。此外,RIP结果表明,转染miR-140-5p mimic的细胞中可以富集到更多的TLR4(P<0.05,图4F)。这表明,miR-140-5p是TLR4的靶点。接着,为了研究miR-140-5p对TLR4表达的影响,我们进一步在转染miR-140-5p模拟物或miR-140-5p抑制剂的H 9C2心肌细胞中检测TLR4的表达(图4G)。如图4H和4I所示,miR-140-5p敲低显著增加了TLR4 mRNA和蛋白的表达,同时NF-κB的磷酸化水平显著增加。而转染miR-140-5p模拟物结果则完全相反。因此,miR-140-5p通过靶向TLR4的3'UTR下调了TLR4-NF-κB的表达。
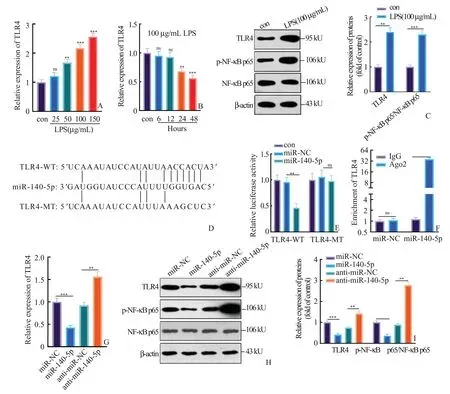
图4 miR-140-5p下调了TLR4-NF-κB通路
3 讨论
在本研究中,我们发现SNHG20在脓毒症诱导的心肌损伤中显著上调;SNHG20还通过miR-140-5p/TLR4/NF-κB轴调控脓毒症介导的心肌损伤。
脓毒症介导的心肌损伤进展迅速,常常伴随全身多器官功能障碍。其中,炎症反应介导的细胞损伤是其核心因素之一[7,8]。TLR4是Toll样受体家族的重要成员,其在病原体识别和天然免疫活化中发挥重要功能。一般来说,TLR4识别位于感染源中的病原体相关分子模式,随后产生细胞因子并发挥有效的免疫调节[9]。而来源于革兰阴性细菌体内的脂多糖,已经被证实可以通过激活TLR4在机体中发挥显著的促炎效应[10]。此外,在脓毒症介导的TLR4通路激活后,通过MyD88依赖和非依赖的途径诱导炎症活化,最终产生大量的炎症因子[11,12]。
近年来,越来越多的研究发现lncRNA可以通过调控脓毒症介导的炎症反应减弱器官损伤。例如,研究发现,lncRNA LINC00472在脓毒症介导的急性肝损伤中表达上调,下调LINC00472可通过调节miR-373-3p/TRIM 8轴改善脓毒症诱导的AHI[13]。此外,lncRNA NEAT 1通过调节miR-144-3p/NF-κB信号通路调控脓毒症诱导的心肌细胞损伤,为脓毒症治疗的研究提供新的理论基础[14]。之前的研究显示,lncRNA SNHG20在神经胶质瘤[15]、乳腺癌[16]等癌症的进展中有重要作用,然而关于其在炎症相关性疾病中的研究还未涉及。鉴于诸多LncRNA在炎症损伤中的重要价值,lncRNA SNHG20又是LncRNA大家族的重要一员,因此我们大胆猜测SNHG20也参与了炎症疾病进展。令人惊喜地是,在本研究中,我们通过qRT-PCR发现,SNHG20在LPS诱导的心肌细胞中显著上调。体外研究也表明,敲低SNHG20显著减弱了心肌细胞的凋亡并促进了细胞活力。由此可见,敲低SNHG20可以通过抑制炎症反应、改善心肌损伤。
miR-140-5p是miRNA中的一员,具有多种细胞生物学功能。Su等[17]在2020年的报道中指出,miR-140-5p通过阻断TLR4/NF-κB通路保护HK-2细胞免受高糖诱导的肾脏损伤。除此之外,miR-140-5p和miR-146a的协同功能通过靶向TLR4/NF-κB信号传导,对骨关节炎软骨细胞中炎症介质的产生具有很强的保护作用[18]。在急性肺损伤中,miR-140-5p通过TLR4/My D88/NF-κB信号通路抑制了其炎症反应[19]。这些研究表明,miR-140-5p通过TLR4/NF-κB信号通路发挥了显著的抗炎能力。在本研究中,我们发现miR-140-5p是SNHG20和TLR4的靶向miRNA。在功能上,miR-140-5p在LPS诱导的心肌损伤中显著下调并受到SNHG20的抑制,敲低miR-140-5p一方面显著促进了TLR4/NF-κB通路的活化和炎症细胞因子的表达,另一方面还可以增强由SNHG20低表达引起的心肌损伤和炎症反应。这些结果进一步证实敲低miR-140-5p可以通过TLR4/NF-κB通路促进炎症反应介导心肌细胞的损伤。
总之,在脓毒症介导的心肌损伤中,上调的SNHG20可以作为竞争性内源性RNA(ceRNA)吸附miR-140-5p,进而导致TLR4/NF-κB通路的活化,后者则通过产生大量的促炎症细胞因子加重心肌损伤。本研究揭示了脓毒症心肌损伤的发病机制,为脓毒症心肌损伤的治疗带来了新的参考依据。
