不同花型及花径切花菊花香挥发物多样性分析
2022-08-12张万博马晓莹陈素梅陈发棣姜一凡
张万博,马晓莹,陈素梅,陈发棣,姜一凡
(南京农业大学园艺学院/农业农村部景观农业重点实验室/国家林业和草原局华东地区花卉生物学重点实验室,江苏 南京 210095)
菊花(Chrysanthemummorifolium)作为中国十大传统名花和世界四大切花之一,集观赏、茶用、药用及食用功能于一体,产量居四大切花之首[1-2]。经过不断杂交选育,全世界已培育出2万多个菊花品种,中国品种总数已超4 000个[3]。根据菊花的生长习性和栽培类型,主要可分为传统菊、切花菊、盆栽型和地被菊[4]。其中,切花菊因具有花型多样、色彩丰富、用途广泛、瓶插寿命长、可周年供应、成本低及高产出等优点,近年来深受消费市场青睐[5]。此外,菊花头状花序中所含的精油挥发性成分也可贡献出包括花香、果香、草香、木香及薄荷香型等在内的多种香气属性[6]。在切花菊产业快速发展的大背景下,除选育品质优良、花色艳丽的新品种外,具备芳香特性也可作为切花菊育种新的重要目标之一。因此,探明已有不同品种的切花菊花香挥发物成分及其释放规律对研究切花菊香气的形成机制及芳香型品种的培育十分重要。
花香是由一系列常温下高蒸汽压、低沸点、低分子量的挥发性有机化合物组成。按照生物合成途径,可将花香挥发物分为萜类化合物、苯丙氨酸/苯环类化合物、脂肪酸衍生物等[7]。近些年随着对挥发物收集与分析方法的不断更新完善和分子生物学技术的快速发展,开花植物如兰花(Cymbidiumssp.)、玫瑰(Rosarugosa)、百合(Liliumsiberia)、茉莉(Jasminumsambac)和栀子(Gardeniajasminoides)等花香成分鉴定、释放规律及调控机制的研究被相继报道[8]。而关于菊属植物花香研究主要围绕不同地域野菊(C.indicum)、茶用型菊花、地被菊及切花菊‘神马’花香挥发物分析、精油分离提取及其生物活性功能验证等展开[9-10],尚缺乏对于切花菊品种花香挥发物成分鉴定及释放差异的研究。
植物释放花香通常会受到花朵性状,如不同的花型花径、花香合成部位、花发育时期及授粉状态、内源生物钟等[11]或外界环境等多重的影响。通过长期的人工杂交选育,菊花头状花序出现不同的生长性状可能会直接或间接地影响其自身某些次生代谢产物的积累,特别是对于种类繁多且不同花型结构及花径大小的切花菊品种,其花香挥发物释放可能会存在差异[12]。因此,本研究选取不同类型切花菊品种,利用动态顶空收集法收集盛花期新鲜切花菊头状花序的花香挥发物,并通过气相色谱-质谱联用仪(GC-MS)分析各挥发性组分的释放量差异,以期为改良菊花气味特征及拓展相关应用产业提供理论基础。
1 材料与方法
1.1 试验材料
所选44个切花菊品种均收集于南京农业大学中国菊花种质资源保存中心温室内,在自然光照下由同一母株扦插无性繁殖,生长温度23~28 ℃,湿度80%。所有样品舌状花全部开放,部分品种露出管状花且花粉自然散出(表1,图1)。按照Su等[4]的方法分类,将44个切花菊品种分为蜂窝型、辐射型、松针型、风车型、迷你型、莲座型、托桂型和单瓣型8种花型。采样时期于2019年及2020年11月完成。

表1 本研究所选44个切花菊品种Table 1 The selected 44 cut chrysanthemum varieties in this study

图1 本研究所选44个切花菊品种Fig.1 The selected 44 cut chrysanthemum varieties in this study
1.2 花香挥发物的收集
采用动态顶空收集法收集切花菊花香挥发物。试验均选在晴朗天气进行,随机采摘切花菊头状花序(带5 cm左右花茎)插入装有30 mL去离子水的锥形瓶中,立即带回实验室。收集切花菊花香挥发物于玻璃容器(高为30 cm,瓶口直径为10 cm)中,供给瓶内0.7 L·min-1活性炭纯化空气,平衡20 min后连接装填有Porpark Q(美国沃特世科技有限公司)吸附硅胶的吸附柱,用200 μL含0.001%(体积分数)乙酸壬酯(色谱纯,西格玛奥德里奇上海贸易有限公司)内标的二氯甲烷(色谱纯,上海麦克林生化科技有限公司)洗脱后待进样测定。设立空白顶空收集瓶作为对照组,所有样品收集时间统一为10:00—13:00。称取切花菊样品鲜重,使用游标卡尺(MNT-150T,上海美耐特实业有限公司)测量10朵处于盛花期头状花序的最大横径,并将切花菊品种花径大小分为3类(≤40 mm、40~60 mm、≥60 mm)。试验重复3次,且每组收集花香的头状花序数量保持一致。
1.3 气相色谱-质谱联用技术(GC-MS)分析
使用安捷伦三重四极杆气相色谱质谱联用仪(Agilent Intuvo 9000/7000D,美国安捷伦科技有限公司)分析鉴定花香挥发物成分。以流速为1 mL·min-1氦气于HP-5MS色谱柱(30 m×0.25 mm×0.25 μm)上分离。设置花香不分流模式,进样口温度为260 ℃,梯度升温程序在40 ℃时开始,然后以5 ℃·min-1速率升至250 ℃,并保持20 min。MS条件:离子源温度为230 ℃,电离能为70 eV,质谱扫描范围为40~500 amu。
根据挥发物保留时间计算保留指数,并与数据库NIST17(National Institute of Standards and Technology 17)中检索化合物参考值比对定性。保留指数使用C7—C40碳氢化合物标准品(色谱纯,美国Sigma-Aldrich公司)计算得出。花香释放速率计算公式:释放速率(ng·g-1·h-1)=(样品挥发物峰面积/内标挥发物峰面积)×内标物含量/(顶空收集时间×每组样品鲜重)。
1.4 数据处理方法
采用Excel 2016软件计算各种花香挥发物释放速率,采用GraphPad Prism 8.0软件对不同品种挥发物释放量进行比较分析和相关性分析;使用TB tools(0.66版本)软件绘制不同切花菊挥发物成分热图;使用SPSS 19.0软件对44个切花菊品种主要花香挥发物进行主成分分析(PCA)。
2 结果与分析
2.1 切花菊花香挥发物成分分析
采用动态顶空收集法和GC-MS分析菊花自然状态下花香挥发物的释放情况。结果表明:在保留各品种挥发物成分占总量1%以上的基础上共鉴定出55种挥发性化合物,包含42种单萜及其含氧衍生物,9种倍半萜类化合物,以及2种苯环类化合物和2种脂肪酸类化合物。不同切花菊品种花香释放速率存在较大差异,其中Cm37(‘南农紫峰’)花香挥发物释放速率最高,达1 392.84 ng·g-1·h-1(图2-A)。萜类化合物是大部分切花菊花香的主要成分,特别是单萜类化合物,其总释放速率占总量的55.16%~100%。但Cm29(‘南农紫点点’)和Cm19(‘南农粉风车’)所含苯环类化合物较高,分别占该切花菊品种总释放速率的85.26%、72.19%(图2-B)。

图2 44个切花菊品种花香挥发物总释放速率(A)及各种类成分比例(B)Fig.2 Total emission rate(A)and composition percentage(B)of floral volatiles in 44 cut chrysanthemum varieties
2.2 不同花型切花菊花香挥发物释放差异
对8种花型切花菊不同类别挥发物成分的总释放速率分布进行比较(图3),结果显示不同花型切花菊的花香释放速率存在较大差异。虽然迷你型切花菊总挥发物平均释放速率高于其他花型(图3-A),但莲座型萜类化合物,特别是单萜类化合物的总释放速率(159.93~1 392.84 ng·g-1·h-1)更高(图3-B)。莲座型单萜总释放速率与迷你型倍半萜总释放速率均高于其他花型(图3-C、D)。另外,迷你型切花菊苯环类化合物的释放速率更高(图3-E)。脂肪酸衍生物的比较结果显示,托桂型切花菊总释放速率更高(图3-F)。
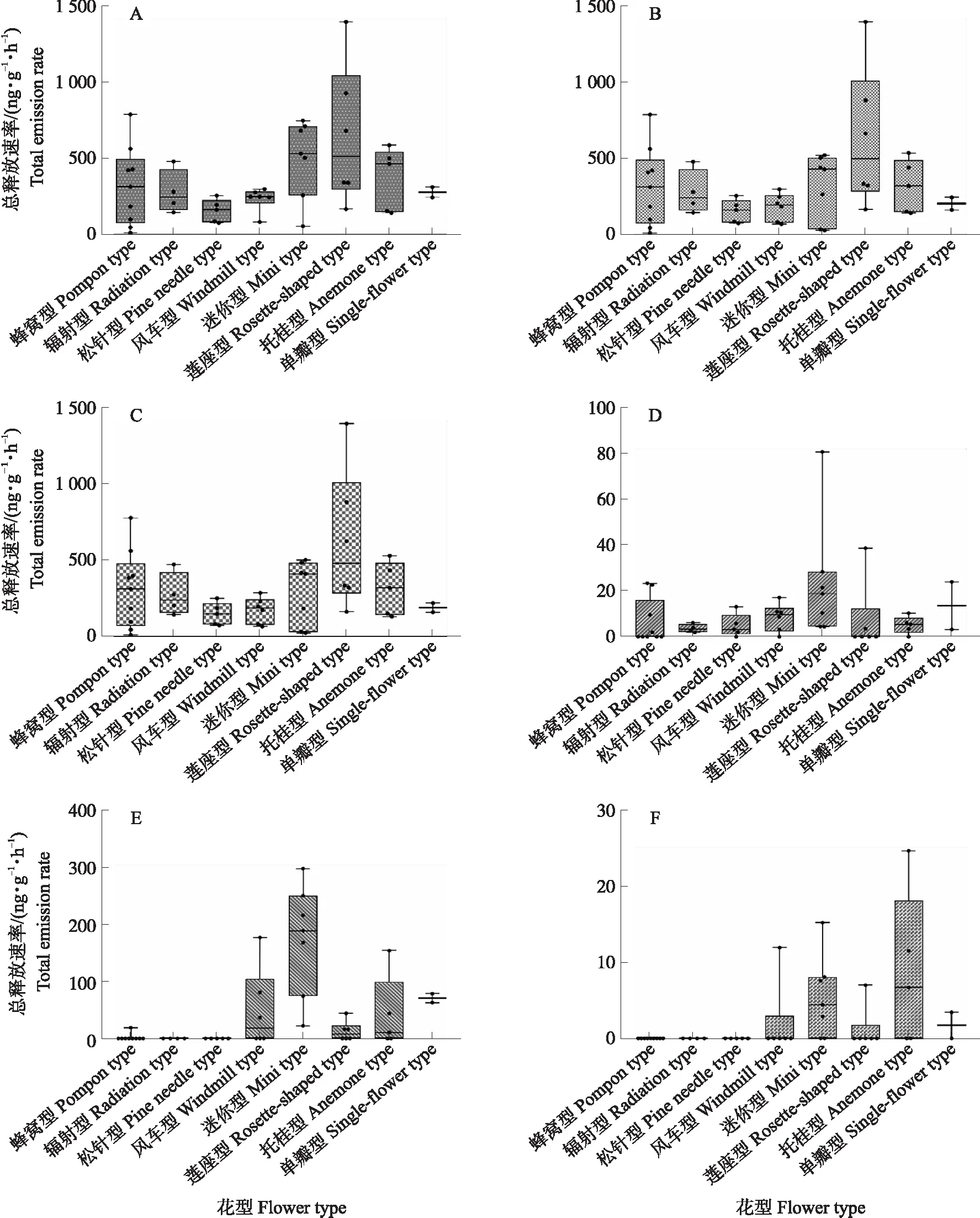
图3 不同花型切花菊花香挥发物总释放速率Fig.3 Total emission rate of floral volatiles from different cut chrysanthemum types A. 花香挥发物Floral volatiles;B. 萜类化合物Terpenoids;C. 单萜类化合物Monoterpenoids;D. 倍半萜类化合物Sesquiterpenoids;E. 苯环类/苯丙氨酸类化合物Benzenoids/phenylpropanoids;F. 脂肪酸类化合物Fatty acid derivatives.
2.3 不同花径切花菊花香挥发物释放差异
如图4所示:随着切花菊花径增加,花香平均总释放速率呈现下降趋势。花径≤40 mm的切花菊所含单萜类化合物、倍半萜类化合物及苯环类化合物平均释放速率均较高。另外,大部分花径≤40 mm的切花菊释放出较高平均水平的脂肪酸类化合物。

图4 不同花径切花菊花香挥发物总释放速率Fig.4 Total emission rate of floral volatiles from different cut chrysanthemum diameters A. 花香挥发物Floral volatiles;B. 萜类化合物Terpenoids;C. 单萜类化合物Monoterpenoids;D. 倍半萜类化合物Sesquiterpenoids;E. 苯环类/苯丙氨酸类化合物Benzenoids/phenylpropanoids;F. 脂肪酸类化合物Fatty acid derivatives.
2.4 花香挥发物成分聚类热图分析
如图5所示:基于花香挥发物成分的释放速率可将不同切花菊品种分为4个类群,同一类群中不同花型切花菊分布较为分散。但在类群Ⅲ中,迷你型品种Cm32(‘南农岱雪’)、Cm33(‘南农峨眉’)、Cm34(‘南农粉云’)、Cm37(‘南农紫峰’)和托桂型品种Cm41(‘南农小金星’)出现聚集情况,说明其具有较为相似的花香释放模式。从花香挥发物成分的分类情况上看,桧烯(sabinene)、桉树醇(eucalyptol)、樟脑(camphor)释放速率较高且在大部分切花菊品种中均有出现,特别是在Cm32(‘南农岱雪’)、Cm33(‘南农峨眉’)和Cm37(‘南农紫峰’)中释放速率极高值。顺式-乙酸菊烯酯(cis-chrysanthenol acetate)、萜品油烯(terpinolene)、Filifolone、反式-菊烯醇(trans-chrysanthenol)、(2E,3Z)-2-亚乙基-6-甲基-3,5-二烯醛[(2E,3Z)-2-ethylidene-6-methyl-3,5-heptadienal]是类群Ⅰ和类群Ⅱ中切花菊品种的重要花香挥发物组分。苯环类化合物,如苯甲醛(benzaldehyde)和苯乙醛(benzeneacetaldehyde)则多次出现于类群Ⅰ、Ⅲ、Ⅳ的切花菊品种中,且在所有迷你型切花菊品种中均被检测到。

图5 所选切花菊花香成分释放速率聚类热图分析Fig.5 Clustering heatmap analysis of volatile components in chrysanthemum materials不同颜色字代表8种花型。Different color fonts represent eight flower types.
2.5 花香挥发物成分主成分分析(PCA)
基于花香挥发物成分在不同切花菊品种的出现次数,试验选定重复出现30次以上的9种花香挥发物进行主成分分析。如图6-A所示:前2个主成分因子合计贡献率达63.9%,以此来作为坐标轴绘制主成分因子载荷图;同样,在对44个品种进行主成分分析时,以第1主成分(贡献率50.96%)和第2主成分(贡献率为27.19%)绘制二维散点图(图6-B)。结果显示,以 9种主要的花香挥发物成分分析为例,可将其分为3组,而与之对应的44种切花菊也被分为3个类群。其中樟脑可以将组Ⅰ的品种与其他品种分开来,桉树醇和Filifolone可以区分组Ⅱ的品种和其他品种,而桧烯、萜品油烯、菊油环酮(chrysanthenone)、桃金娘醛(myrtenal)、顺式-乙酸菊烯酯、乙酸冰片酯(bornyl acetate)可以区分组Ⅲ的品种和其他品种。不同花型或是花径的切花菊品种花香释放分布不一致,未在某一花型或花径范围内出现聚集现象。

图6 切花菊挥发物主要成分主成分分析(PCA)Fig.6 Principal component analysis(PCA)of the main volatiles in 44 cut chrysanthemums A. 9种主要挥发物在PC1与PC2上的载荷图(c1. 香桧烯;c2. 桉树醇;c3. 萜品油烯;c4. Filifolone;c5. 菊油环酮;c6. 樟脑;c7. 桃金娘醛;c8. 顺式-乙酸菊烯酯;c9. 乙酸冰片酯);B. 44个切花菊品种花香挥发物PCA得分分布图(按图5颜色标注)。A. Loading plot of Eigenvector load values of 9 main volatiles on PC1 and PC2(c1.Sabinene;c2. Eucalyptol;c3. Terpinolene;c4. Filifolone;c5. Chrysanthenone;c6. Camphor;c7. Myrtenal;c8. cis-chrysanthenol acetate;c9. Bornyl acetate);B. PCA score distribution of floral volatiles from 44 cut chrysanthemum varieties(The label color is the same as in Fig.5).
3 讨论
作为菊花重要的观赏器官,不同舌状花及管状花花数、花瓣大小及花器官组成了形态各异的花型及大小不一致的头状花序[4]。菊花具有丰富的核内变异特性[12-13],使得不同花型切花菊可能产生包括挥发物在内的更多种类次生代谢物质。本研究发现不同花型切花菊花香的释放速率存在较大差异,这与先前报道的不同菊花品种中花香挥发物释放量不同相似[14-15]。在本文选定的44个切花菊品种中,大部分迷你型系列品种释放速率较高,而花径较大的松针型系列切花菊品种释放速率相对较低,可能是由于迷你型头状花序上管状花数量较多,而松针型切花菊主要以舌状花为主。Sun等[14]对不同花型菊花挥发物分析后得出蜂窝型可以产生较多的花香挥发物,这与本研究结果的差异可能是因收集挥发物的菊花品种不同所致。另外,花径在40 mm以下的切花菊释放出更高水平的花香挥发物,这与花径较小的野菊及地被菊头状花序中积累的花香挥发物含量较高的趋势类似[9]。因此,培育管状花明显的切花小菊可作为芳香型菊花的育种目标之一。此外,主成分分析显示9种主要花香挥发物质可将44个切花菊品种分为3个类群,但每组中的菊花品种在花型或花径分布上较为分散,表明其与花香释放的相关性较弱。这可能是由于菊花杂交过程中复杂的遗传背景、舌状花或管状花上花香释放的组织细胞形成结构或数量差异以及有无产生花粉等因素所致有关[10]。
萜类化合物是菊花花香的主要挥发物性组分之一[16]。本研究中自然状态下切花菊释放出较多种类的单萜及其氧化物,且释放量占花香释放量的比例较高,例如桧烯、萜品油烯、桉树醇、菊油环酮、樟脑、反式菊烯醇、顺式乙酸菊烯酯和乙酸冰片酯均出现在不同花型及花径大小的切花菊品种中。同样在野菊、茶用菊、观赏菊品种中也检测到了相同的花香挥发性成分[17-19]。从单萜化合物对花香香气评价的影响上看,本试验所选切花菊品种中几乎不含有先前报道中的柠檬烯(limonene)、芳樟醇(linalool)、(E)-β-罗勒烯[(E)-β-ocimene]及香叶醇(geraniol)等具备花香香气特征的挥发物成分[20],而是以莰烯型(camphene type)单萜氧化物及菊烯醇型(chrysanthenol type)为主的挥发物组成[21]。这2种类型的单萜化合物已被证实在菊花精油中多与木香和草香香型具有较强的相关性,这可能是导致降低切花菊嗅觉吸引力,使其并未呈现出芳香性植物特征的原因之一[6]。然而,本研究结果显示Cm19(‘南农粉风车’)、Cm25(‘南农彩点点’)、Cm29(‘南农紫点点’)和Cm31(‘南农极点’)释放出以苯甲醛及苯乙醛为主的苯环类花香组分,这可为培育芳香型切花菊品种提供可能。在风信子(Hyacinthusorientalis)、鸢尾(IristectorumMaxim.)及岩蔷薇(Cistusladanifer)中,苯甲醛呈现出多种果香型香气[22];而苯乙醛给人以强烈的风信子特征香气[20],由此推测出迷你型“点点”系列切花菊可作为改良菊花气味特征的候选亲本品种。对于更多切花菊品种的花香感官属性有待于进一步的系统评价。
近年来,分子育种逐渐成为改良菊花性状的重要方法之一[23]。随着植物源挥发性萜类物质生物合成途径研究的不断深入,某些单萜及单萜氧化物已被证实在菊属植物甚至是菊科植物中,如野菊、除虫菊(Tanacetumcinerariifolium)和洋甘菊(Matricariarecutita),可通过一步或多步生化反应催化形成[24-26]。因此,导入外源基因或沉默甚至敲除相关代谢途径上的影响菊花香气属性的关键基因可为花香的遗传改良提供新的有效办法。在杂交培育菊花新品种的背景下,充分了解不同花型及花径切花菊花花香释放的多样性,不仅可为挖掘潜在的调控菊花花香关键基因提供基础,也可对控制菊花花香气成分生物合成途径中关键酶基因的克隆及功能验证提供理论依据[27]。未来,可运用多组学对花香关键调控基因进行挖掘,并结合基因工程技术对切花菊花香品质进行改良,为切花菊相关应用产业的开发提供依据。
