鼠伤寒沙门氏菌感染机制及其检测方法研究进展
2022-08-11吴娅芳王英林田亚晨黄志强姜嘉烨黄笑天马文文
吴娅芳, 王英林, 田亚晨, 黄志强, 姜嘉烨, 黄笑天, 马文文, 刘 箐
上海理工大学健康科学与工程学院,上海 200093
沙门氏菌是一种常见的食源性致病菌,在世界范围内的细菌性食物中毒事件中,由沙门氏菌引起的食物中毒死亡人数高达3 300万[1]。据世界卫生组织报告,沙门氏菌感染是造成腹泻病的主要原因之一,每年约有5.5亿人患病[2]。沙门氏菌分布十分广泛,常寄居于蔬菜、蛋类、禽类肉制品等食品中。目前已鉴定的沙门氏菌血清型超过2 650多种[3],且从食品分离株中最常见的血清型是鼠伤寒沙门氏菌(Salmonellatyphimurium)[4-5]。近年来,鼠伤寒沙门氏菌感染禽类肉制品问题愈加严重,该致病菌不仅阻碍畜牧业的发展,而且危害人类健康。通过对鼠伤寒沙门氏菌逃避先天免疫机制及其在宿主间转移、扩大感染等方面进行研究,可以为预防鼠伤寒沙门氏菌感染以及疫苗、药物研发提供新的思路。此外,鼠伤寒沙门氏菌是食源性致病菌重点监控对象之一[6],对食品中鼠伤寒沙门氏菌进行准确、快速检测也是预防和控制沙门氏菌的有效措施。随着光谱、纳米等技术的发展,各种高通量、高灵敏的检测方法也应运而生,为实现食品中鼠伤寒沙门氏菌的快速检测提供了新的手段。因此,本综述主要从鼠伤寒沙门氏菌感染机制及其检测技术两个方面进行阐述,以期为鼠伤寒沙门氏菌的防治提供研究基础与方向。
1 鼠伤寒沙门氏菌感染机制
1.1 鼠伤寒沙门氏菌逃避先天免疫的机制
鼠伤寒沙门氏菌通过逃避宿主防御系统的生存机制来对抗宿主攻击,从而增加发病率和死亡率。黏附在宿主表面的鼠伤寒沙门氏菌利用宿主的信号通路对宿主细胞骨架结构重排并破坏正常的上皮细胞刷状边界,诱导膜皱褶的形成[7]。膜皱褶可以将病原体内吞到一个低酸碱度和营养缺乏的隔室中,即SCV(Salmonellacontaining vacuole)。鼠伤寒沙门氏菌分泌蛋白SopB已被证明可以激活细胞膜上的宿主激酶蛋白AKT1,进而磷酸化AS160。而AS160是一种潜在的rab14-GTPase激活蛋白,其磷酸化形式无法与吞噬体膜结合,rab14在SCV中保持激活状态,从而抑制SCV与溶酶体融合[8]。入侵之后,鼠伤寒沙门氏菌毒力岛-2(SPT-2)编码的T3SS(type III secretion system)可以转移SCV,将其定位在紧邻高尔基体的宿主细胞核周区,有助于菌体拦截宿主内吞作用和胞吐囊泡作用,以便获取营养物质和膜片段[9]。此外,SPI-2 T3SS在SCV内被诱导,可以防止抗微生物宿主因子输送到SCV,改变宿主细胞骨架组织,影响囊泡运输,维持SCV的完整性,从而保证沙门氏菌在宿主细胞内始终被SCV包裹着并进行生存、繁殖[10]。
1.2 鼠伤寒沙门氏菌感染与宿主之间的关系
1.2.1调节宿主细胞的迁移
SseI是由侵入细胞内的鼠伤寒沙门氏菌表达的一种分泌型效应物,通过SPI-2-T3SS转运进入宿主细胞胞质溶胶[11]。有研究证实SseI是通过调节巨噬细胞和树突细胞(DC)的迁移来维持小鼠长期全身性的感染[12]。而抑制迁移需要宿主因子含有GTPase激活蛋白1的IQ基序(IQGAP1),它是宿主细胞迁移的重要调节因子。当SseI与IQGAP1结合,就会抑制对激活T细胞至关重要的有效抗原呈递细胞DC向趋化因子CCL19/21迁移(见图1)[13]。虽然SseI调节迁移的确切机制仍不清楚,但它能够阻断宿主免疫细胞向T细胞的迁移,从而削弱了宿主清除全身细菌的能力。
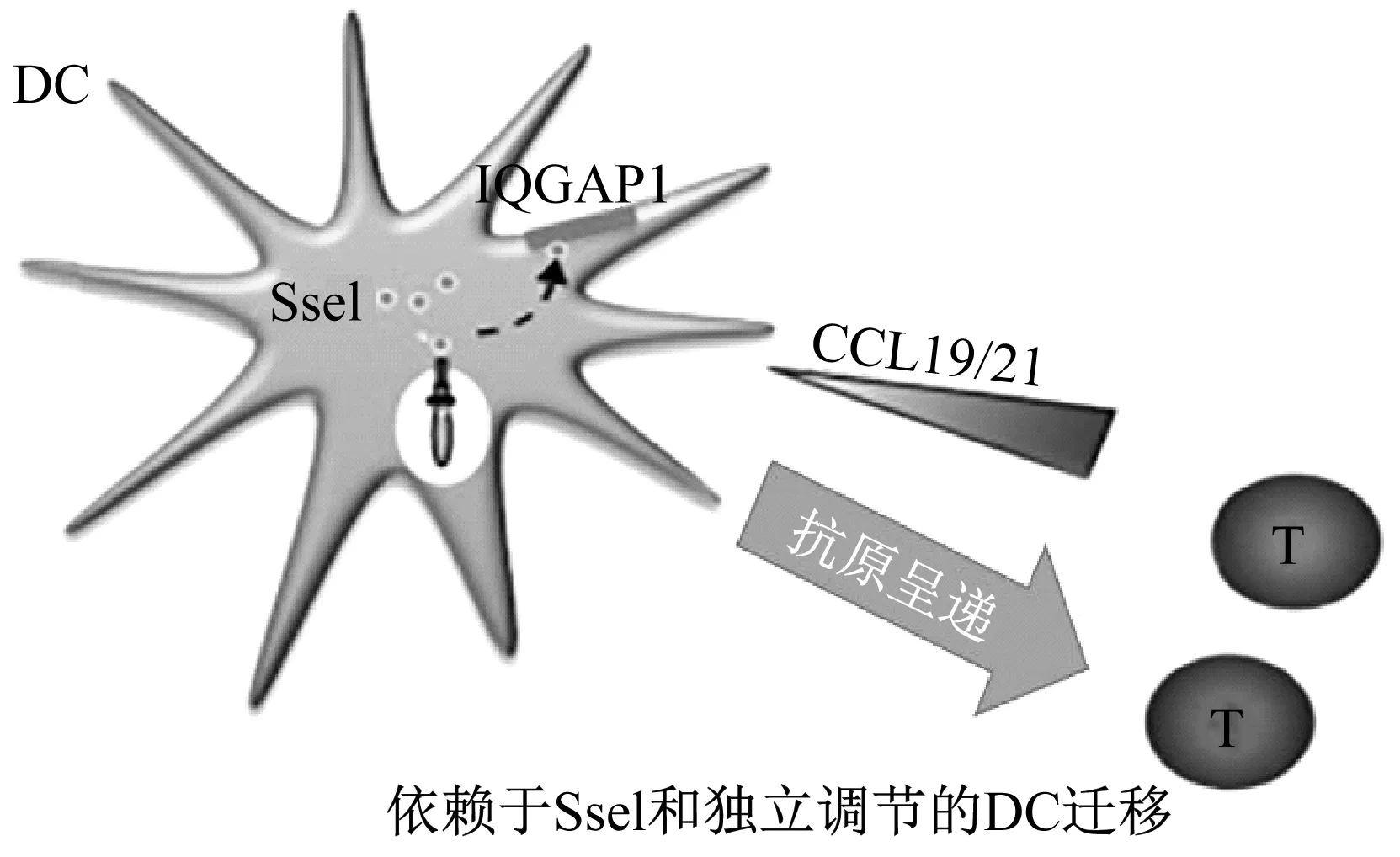
图1 沙门氏菌抑制适应性免疫反应[13]
1.2.2宿主细胞的凋亡和鼠伤寒沙门氏菌的扩大感染
在宿主细胞感染初期,鼠伤寒沙门氏菌毒力岛-1(SPI-1)编码的SipB蛋白与细胞凋亡诱导的执行因子Caspase(cysteine protease)家族的Caspase-1结合,使其活化[14]。Caspase-1的活化不仅促使细胞凋亡,还是引起肠道组织炎症的主要原因之一[15]。此外,有报道称,如果沙门氏菌感染源自Caspase-1基因敲除小鼠的巨噬细胞,那么在感染初期Caspase-2也会诱发细胞凋亡[16]。Caspase-2的活化可能也和SipB蛋白有关。Caspase与SipB蛋白结合机制尚不清楚,有学者认为可能是SipB蛋白直接贯穿SCV膜与Caspase结合。在感染晚期,SPT-2的表达产物会诱导巨噬细胞的凋亡[17]。细胞凋亡发生在肝脏和脾脏,死细胞被相邻的吞噬细胞吞噬,通过细胞内增殖进一步扩大了感染的范围,所以细胞凋亡对于沙门氏菌扩大感染是必要的。
2 检测方法研究进展
对鼠伤寒沙门氏菌简单、快速、准确的检测是预防和控制沙门氏菌感染的有效手段。目前,沙门氏菌的检测方法主要包括传统分离方法、免疫学方法、分子生物学方法以及近年来多学科交叉发展起来的新型检测方法,如生物传感器技术、光谱技术、纳米技术等。这些方法为沙门氏菌快速、准确、灵敏的检测提供了新的方向。本文对鼠伤寒沙门氏菌的检测方法进行了概述,为鼠伤寒沙门氏菌的预防和监控以及新型检测技术的研发提供一些参考。
2.1 传统分离方法
传统培养方法是根据病原菌的生长繁殖特性,利用选择性培养基对细菌进行筛选和分离,再结合生物特性对其进行鉴定。根据(GB 4789.4—2016)《食品安全国家标准 食品卫生微生物学检验 沙门氏菌检验》[18],其具体流程包括8 h~18 h的预增菌、18 h~24 h的增菌、选择性平板分离、生化试验和血清学鉴定五个步骤。传统分离方法准确性高,对仪器要求低,是鉴定鼠伤寒沙门氏菌的金标准。但是操作繁琐,检测周期一般长达4 d~7 d,不适用于即时现场检测。细菌抗原表位的改变或丢失,也会导致同种血清型沙门氏菌的抗原性不同,降低检测灵敏度,从而出现假阴性[19]。另外,由于存在细菌“活的不可培养”状态(viable but non-culturable, VBNC)的情况,从而导致实验结果出现假阴性[20]。因此,构建更加准确、快速、便捷的检测方法对于鼠伤寒沙门氏菌的预防具有重大意义。
2.2 免疫学检测技术
免疫学检测技术是通过抗原抗体特异性结合来检测目标致病菌。目前,该技术广泛用于鼠伤寒沙门氏菌的检测。根据检测原理的差异性可以将免疫学检测技术分为标记免疫学检测技术和非标记免疫学检测技术。大致分为酶联免疫技术、荧光免疫技术、免疫磁珠分离技术和放射性免疫技术等。
2.2.1酶联免疫吸附检测法(Enzyme-Linked Immuno Sorbent Assay, ELISA)
酶联免疫吸附技术是目前较为成熟的一种检测方法,其基本原理是将抗体(抗原)吸附在固相载体表面,依次加入受检样品和酶标记的抗原(抗体),它们通过特异性结合形成抗原抗体复合物,用洗涤的方式将未结合的物质除去,然后加入酶反应底物,底物经酶催化变为有色物质,最后根据颜色的深浅对样本进行定性或定量分析。该检测方法周期较短、灵敏度高。WANG W等[21]制备针对鼠伤寒沙门氏菌鞭毛蛋白和脂多糖的单克隆抗体,建立了基于抗鼠伤寒沙门氏菌脂多糖的双抗体夹心ELISA法对目标菌进行检测,检出限达到104CFU/mL。 CHUNGLOK W等[22]利用单壁碳纳米管(SWCNTS)构建的标记平台来固定辣根过氧化物酶(HRP)标记的鼠伤寒沙门氏菌抗体,形成的Ab/SWCNTs/HRP偶联物用于ELISA试验。该检测方法的检测灵敏度比传统ELISA方法提高了1 000倍。
2.2.2免疫层析检测技术(Immunochromatography Assay, ICA)
免疫层析法的基本原理是将特异性抗体固定在硝酸纤维素膜上的某个区域,然后将干燥的一端插入待检样品中,在毛细血管力的作用下,样品向前移动,当到达固定有抗体的区域时,抗原与抗体发生特异性结合,若用胶体金或者酶染色,则会出现肉眼可见的条带,从而得出检测结果。相较于ELISA,免疫层析法操作简单,方便快捷。WU Y X[23]等构建了一种能够检测沙门氏菌的广谱性胶体金试纸条。将制备的抗鼠伤寒沙门氏菌单克隆抗体用胶体金标记,因为该抗体可以与自身配对,所以也用作捕获抗体,从而形成一个三明治检测平台。该试纸条可以检测18种沙门氏菌种,与其他14种食源性病原菌无交叉,对鼠伤寒沙门氏菌的检测限达到4×105CFU/mL,具有较高的广谱性和特异性,但其灵敏度有待提高。REN Y R[24]等开发了一种基于盐诱导聚集金纳米颗粒的免疫层析试纸条来检测样品中的鼠伤寒沙门氏菌,该方法的检测线为103CFU/mL,灵敏度较上种提高了100倍。
2.3 分子生物学检测技术
分子生物学检测技术是通过检测分子水平的核酸序列来横向比较不同物种、同物种不同个体、同个体的不同细胞或不同生理(病理)状态的差异[25]。随着现代分子生物学技术的快速发展,人们能够深入到分子层面对食源性致病菌进行诊断。常见的分子生物学检测技术主要包括聚合酶链式反应(Polymerase Chain Reaction, PCR),环介导等温扩增技术(loop-mediated isothermal amplification, LAMP),核酸探针技术和基因芯片技术等。这些检测技术具有稳定的准确性、较高的灵敏度和特异性,被广泛用于食源性致病菌的检测。
2.3.1PCR
PCR技术是由Kary Mullis在1985年发明的一种体外扩增特定DNA片段的检测方法,将微量DNA片段进行成倍增加。具体流程包括:变性、退火和延伸。常见的PCR方法包括实时荧光PCR技术、免疫PCR技术、多重PCR技术和逆转录PCR。XU J X[26]等利用多重PCR技术检测肉类中的鼠伤寒沙门氏菌,检测限达100 CFU/25 μL。相较于传统培养方法,该技术检测时间短,可同时检测多种不同类型的致病菌。GWAK S H[27]等将过滤、DNA浓缩和实时PCR技术联合使用,建立了一种快速检测甘蓝中鼠伤寒沙门氏菌的方法。这种联合方法能够在5 h内快速检出食品中(1~4) CFU/25 g的活菌。因此,该方法有望促进分子生物学检测技术的发展,从而实现快速检测。
2.3.2LAMP
LAMP法是一种新型核酸扩增技术,其基本原理是对靶基因上的六个区域设计四条引物,在恒温条件下,15 min~60 min内实现109~1010倍的扩增,通过肉眼观察白色扩增产物即焦磷酸镁白色沉淀的有无来判断靶基因是否存在。与传统PCR相比,不需要热变性、温度循环和电泳观察等步骤。LAMP法具有快速、灵敏、准确性高等特点。DEHGHANI Z[28]等将铂/钯纳米颗粒(Pt/Pd NP)和DNA适配体双修饰的磁珠与LAMP技术相结合,来检测食品中鼠伤寒沙门氏菌的含量。该方法可以快速检测食品中的鼠伤寒沙门氏菌,检测线低至(3~10) CFU/mL,为鼠伤寒沙门氏菌的检测提供了一个全新的思路。CHUN H J[29]等将LAMP技术和后反射Janus粒子(RJP)相结合,开发了一种检测鼠伤寒沙门氏菌的分子生物传感器。RJPs作为光信号探针可以与LAMP产物结合,扩增的LAMP产物浓度与结合的RJPs数量成正比。因此,通过测量荧光强度可以得到鼠伤寒沙门氏菌的浓度,其检测限为102CFU/mL。该方法具有高特异性、快速和简便的特点,并为解决传统LAMP不能定量的问题提供新的思路。
2.4 新型检测技术
2.4.1生物传感器检测技术
生物传感器,是一种对生物物质敏感并将其浓度转换为电信号进行检测的仪器。它主要由三个部分组成:识别元件、信号转换器和放大器。识别元件由特定与所需要的分析物相互作用的生物材料组成(包括酶、抗体、抗原、微生物、细胞、组织、核酸等生物活性物质),信号转化器(如氧电极、光敏管、场效应管、压电晶体等)能够将生物响应转换为可测量的信号,产生的信号则由放大器进行放大[30]。生物传感器检测沙门氏菌是以抗原抗体的特异性识别、核酸或适配体对菌体的特异性识别为基础,将生物信号放大并转化为光学或者电化学信号,通过建立化学信号与沙门氏菌浓度之间的关系达到检测的目的[31]。生物传感器根据其结构上使用的识别元件以及其信号转换器的不同进行分类,可以分为酶传感器、免疫传感器、电化学生物传感器、基因传感器、光敏传感器等[32]。CHAI等[33]针对鸡蛋壳表面的鼠伤寒沙门氏菌设计了一种噬菌体磁弹性(ME)生物传感器。该传感器根据细菌附着在传感器表面后的共振频率变化来检测蛋壳上的鼠伤寒沙门氏菌,并在20 min内完成对蛋壳样品表面的鼠伤寒沙门氏菌的检测。SPR生物传感器是一种利用表面等离子体共振实时监测抗体-抗原相互作用的光学检测仪器。它通过分析物与固定在SPR传感器上的生物识别分子相结合的方式导致折射率变化,由生物分子的含量与折射率的线性关系反映样品中沙门氏菌的浓度[31]。BHANDARI D等[34]开发了一种基于SPR检测莴苣叶中鼠伤寒沙门氏菌的传感器,该传感器利用了双抗体夹心的原理,将针对鼠伤寒沙门氏菌鞭毛蛋白的单克隆抗体(MAb 1E10)固定在传感器表面,然后用另一株捕获抗体(MAb 1C8)与检测样品孵育半小时,孵育过程中形成鼠伤寒鞭毛蛋白-MAb 1C8复合物。将鞭毛蛋白-MAb 1C8复合物引入传感器中进行培养,培养过程中固定在传感器表面上的MAb 1E10会捕获不同浓度的鞭毛蛋白-MAb 1C8复合物,从而构建鞭毛蛋白浓度与SPR响应的剂量关系曲线(见图2[34])。该方法检测人工污染的长叶莴苣样品检出4.7×105CFU/mL。在提高检测灵敏性方面,XU Y等[35]设计了一种Ω型光纤局部SPR生物传感器用于鸡肉样品中鼠伤寒沙门氏菌的快速检测,检测限达到128 CFU/mL,是一种灵敏度相对较高的检测方法。
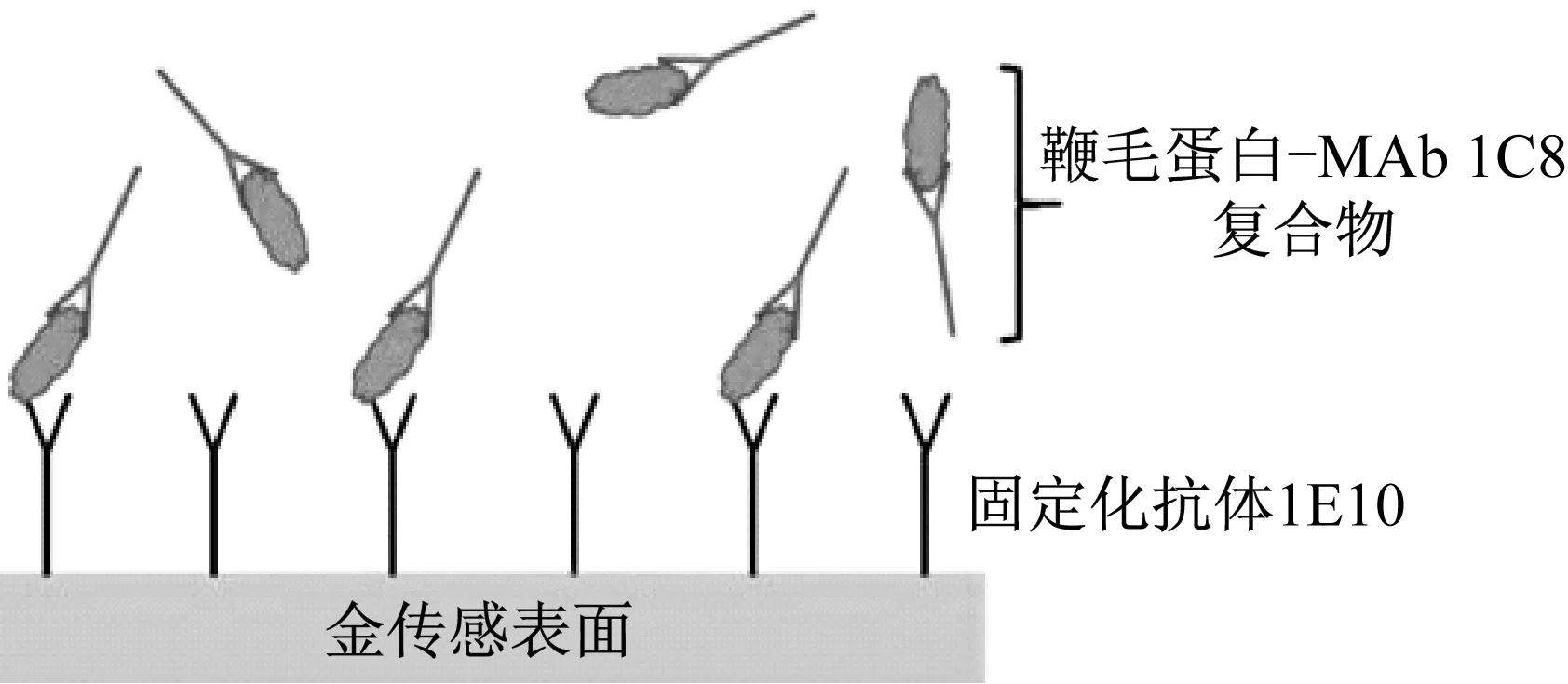
图2 基于表面等离子体共振生物传感器检测鼠伤寒沙门氏菌示意图[34]
2.4.2光谱技术
光谱技术,是指利用光与物质的相互作用研究分子结构及动态特性的一门技术,即通过获取光的发射、吸收与散射信息来获得与样品相关的信息。基于光学原理的鼠伤寒沙门氏菌检测是将光学材料与电子材料、生物学结合起来,利用如抗体、适配体等特定识别分子来分析待测样品,以材料光学特性的变化反映细菌浓度的变化,实现对鼠伤寒沙门氏菌的检测。光学材料应用于食品中致病菌检测方面的技术包括光学生物传感器技术、荧光纳米免疫层析试纸条技术等。将光谱技术与常规检测技术相结合,具有便捷,灵敏度高的优点。SRINIVASAN S等[36]开发了一种基于荧光筛选的鼠伤寒沙门氏菌无标记适配体传感器。罗丹明(rhodamine,RB)与适配体和AuNPs共存时,RB荧光由于荧光共振能量转移(fluorescence resonance energy transfer, FRET)而发生猝灭。鼠伤寒沙门氏菌加入体系后与适配体特异性结合,RB荧光强度增强。样品中鼠伤寒沙门氏菌浓度与荧光强度有良好的线性关系,检出限为464 CFU/mL。ZHANG等[37]开发了一种基于EuPSNs的荧光免疫层析试纸条。将EUPSN-单克隆抗体与鼠伤寒沙门氏菌进行孵育,孵育过程中标记病原菌。然后将标记的病原体放置在试纸条(预喷涂抗体)上,形成三明治结构(抗体-病原体-抗体),并使用发光阅读器对IST条带进行分析。该试纸条对鼠伤寒沙门氏菌的检测限为103CFU/mL,检测时间小于1.5 h,是一种快速、高灵敏度的检测方法。FANG S Y等[38]构建了一种新型倏逝波双色荧光适配体传感器。基于双色倏逝波荧光原理和微/纳米尺寸效应的机理可用于同时检测大肠杆菌O157:H7和鼠伤寒沙门氏菌。将520 nm和635 nm的激发光交替引入光纤纳米探针,交替激发两种荧光标记的适配体Cy3-apt-E.coli和Cy5.5-apt-S.typhimurium,并由一个基于时间分辨效应的光电探测器同时进行检测。由于倏逝波的穿透深度有限,且细菌和纳米孔的尺寸差异显著,纤维纳米探针能够有效区分游离核酸传感器和与病原菌结合的核酸传感器。随着病原菌浓度的增加,更多的核酸适配体与各自的靶菌特异结合,从而导致较低的荧光强度。根据细菌数量与荧光强度之间的线性关系,可以对两种致病菌进行定量分析。该检测方法对大肠杆菌O157:H7和鼠伤寒沙门氏菌的检测限分别340 CFU/mL和180 CFU/mL。倏逝波双色荧光适配体传感器可以实时检测两种病原菌,而无需繁琐的培养、浓缩和分离步骤,较其他生物传感器更为方便、快捷。
2.4.3纳米技术
随着纳米技术的迅速发展,各种纳米材料由于其独特的磁性、光学和其他相关性质,为不同的目标分析物提供了高效的化学/生物传感平台[39-42]。纳米材料的表面体积比较大,有利于分析物通过共价或非共价的方式附着在各种识别部分,从而控制和改变其性质[43-44]。由于尺寸和表面结构的良好可控性,纳米材料的分析性能(如成本、反应动力学、准确度和重复性等)得到显著提高,更容易实现仅需少量样本量的快速现场检测[45-47]。与传统的病原体检测方法相比,基于纳米材料的检测方法具有成本低、快速、准确度高等优点,特别是在高通量筛选、无标签和实时响应方面,能够充分满足食品行业、医院和监管机构的需要。ZHENG Z等[48]构建了一种基于磁性纳米材料的磁性和光热效应的快速检测鼠伤寒沙门氏菌的方法(图3[48])。鼠伤寒沙门氏菌和磁性纳米材料与抗鼠伤寒沙门氏菌抗体偶联物进行孵育,通过膜过滤去除游离磁性纳米材料和磁分离步骤去除非特异性细菌,然后用激光笔照射鼠伤寒沙门氏菌保留膜上的磁性纳米材料,使其产生温度变化。根据温度变化反映鼠伤寒沙门菌的浓度,其检测限为300 CFU/mL。CHO I H等[49]基于磁性纳米粒子Fe3O4设计了一种原位荧光免疫磁传感器,使其能够同时检测鼠伤寒沙门氏菌在内的三种病原体。目标细菌被IMBs和抗体结合的有机荧光团捕获并鉴定,形成三明治复合结构。随后,在蛋白酶K的作用释放荧光物质,通过荧光颜色和强度反映病原菌的种类和浓度。与传统的免疫检测方法相比,该磁珠的表面积大,有利于对目标细菌的捕获,是一种快速、灵敏的检测方法。
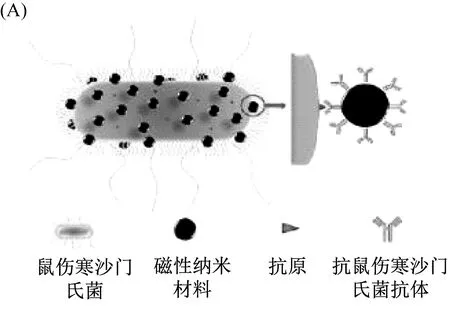
图3 (A)免疫磁性纳米材料识别鼠伤寒沙门氏菌示意图;(B)基于免疫磁纳米材料光热效应的鼠伤寒沙门氏菌捕获、热传感器检测和灭活程序[48]
传统检测技术准确性高,但仍有较多缺陷。以胶体金免疫层析试纸条为例,胶体金产品存在批次差异大,灵敏度低,标记物不稳定等问题,而且该技术的特异性高度依赖捕获抗体的质量,而捕获抗体获取过程本就极为繁琐[50]。此外,传统检测技术检测周期长,对操作人员以及环境要求较高。因此,随着单一检测技术弊端的出现,新型检测技术逐渐进入人们的视野。该方法在一定程度上可以弥补单一检测技术产生的缺陷。将传统检测技术与其他分析检测方法相结合,极大地丰富了鼠伤寒沙门氏菌检测技术的内容,例如将发光纳米材料与免疫层析试纸条相结合,通过检测荧光强度,实现对病原菌的定量检测,解决了传统胶体金免疫层析试纸条只能定性或半定量的问题。新型检测技术的诞生,促进了鼠伤寒沙门氏菌检测技术的迅速发展,但在实际应用中仍然存在较多缺陷。表1总结了现有检测技术的优缺点。

表1 传统检测技术和新型检测技术优缺点
3 总结与展望
鼠伤寒沙门氏菌作为一种胞内病原菌,在逃避免疫系统清除以及在宿主细胞内繁殖方面有着非常灵活的表现。目前,针对鼠伤寒沙门氏菌的防治,主要采用抗生素治疗和疫苗预防。常用的鼠伤寒沙门氏菌抗生素药物是氟喹诺酮类或广谱头孢菌素[51]。虽然抗生素的杀菌能力强,特异性高,但是由于近年来抗生素的滥用,出现了沙门氏菌的耐药性增强,耐药谱变宽等问题[52]。与此同时,大剂量使用抗生素也会破坏宿主肠道菌群的平衡。这表明采用传统抗生素治疗方法的效果大不如前,而且会直接影响肉制品的卫生与安全,最终危及到人类自身健康。因此,深入了解鼠伤寒沙门氏菌的感染机制,开发新型绿色药物来防治鼠伤寒沙门氏菌的感染对公共安全与经济发展有着重大意义。
随着鼠伤寒沙门氏菌在畜禽类及其制品中的感染逐渐增多,人们对鼠伤寒沙门氏菌的关注度随之提高,同时也促进鼠伤寒沙门氏菌检测方法的发展。以准确度为标杆,传统方法处于检测技术中的领先地位,但由于其检测周期长这一弊端,在一些即时检测现场并不能发挥作用。生物传感器技术、光谱技术、纳米技术和噬菌体库检测技术等新型检测技术的出现,为鼠伤寒沙门氏菌的即时检测提供了有力的技术支撑,但仍需不断地完善改进。因此,开发方便、快捷的检测技术是食源性致病菌检测技术的发展方向,也是当今社会的迫切需要。相信在不久的将来,会出现更多快速、便捷、特异性强、高灵敏度、高通量和低成本的鼠伤寒沙门氏菌检测技术,为人们的食品安全保驾护航。
