新冠病毒Nsp1蛋白结构与功能的生物信息学分析及原核表达
2022-08-11张德玖李卓禧陈晓聪杨娅男徐本锦
刘 玲,李 璟,范 蕾,宣 焱,杜 淼,张德玖,李卓禧,陈晓聪,杨娅男,徐本锦
2019年12月,由新冠病毒(SARS-CoV-2)引起的肺炎疫情在中国武汉暴发,患者表现为发热、咳嗽、肺部磨玻璃样病变等呼吸系统病变,或伴随腹泻等消化系统症状[1-2]。截止2021年9月28日,新冠肺炎累计确诊病例已超过2.31亿例,累计死亡病例超过475万例[3]。新冠疫情的迅速蔓延给全球医疗体系带来了严峻考验。因此,揭示SARS-CoV-2的传播机制及其关键蛋白的结构与功能成为遏制疫情的关键。
SARS-CoV-2属β冠状病毒,是一种包膜单股正链RNA病毒[4-5]。其基因组约30 kb,由一个5′帽子和5′非翻译区(5′UTR),10个开放读码框(open reading frames,ORFs)以及一个多聚腺苷酸化的3′非翻译区(3′UTR)组成[6]。ORF1a和ORF1b是SARS-CoV-2的2个主要ORF,约占病毒基因组的70%(图1)。ORF1ab通过核糖体移码被翻译成多聚蛋白pp1a或pp1ab[7-8],最后被加工成16种非结构蛋白(non-structural protein,NSPs),NSPs具有多种酶活性,参与病毒RNA复制和转录调控。
Nsp1由ORF1a的5′ 末端编码(图1),是感染细胞中产生的第1种冠状病毒蛋白[9],其主要功能是通过结合核糖体抑制宿主基因表达[10-11]。目前,国内外有关SARS-CoV-2 Nsp1蛋白结构与功能方面的研究报道仍然较少。本研究利用生信分析手段对SARS-CoV-2 Nsp1的性质、翻译后修饰、结构域等进行了系统分析,还对其进行了同源性分析、进化分析及原核表达。本研究有助于揭示Nsp1在SARS-CoV-2侵染宿主细胞中的作用机制,同时有助于加快针对Nsp1的靶向药物研发。

图1 SARS-CoV-2基因组结构示意图Fig.1 Schematic of SARS-CoV-2 genome organisation
1 材料与方法
1.1 材料 限制性核酸内切酶NdeI、XhoI购自NEB,pET-22b空质粒为本实验室保存,DNA分子量标准购自宝生物(大连),蛋白分子量标准、质粒提取、凝胶回收试剂盒以及感受态细胞购自全式金公司,其它生化试剂购自国药。
1.2 载体构建及原核表达 用XhoI和NdeI对pET-22b空质粒和Nsp1基因同时双酶切,回收酶切产物后将Nsp1基因与载体连接,转化Top10感受态细胞并进行菌落PCR验证。Nsp1蛋白的诱导表达步骤参照文献执行[12]。
1.3 生信分析 对Nsp1蛋白的理化特性、跨膜螺旋、亲/疏水性等进行全面分析,相关分析网站如表1所示。Nsp1蛋白的多序列比对与系统进化分析参照文献执行[12]。

表1 生物信息分析网址Tab.1 Bioinformatics analysis websites
2 结 果
2.1 Nsp1的理化特性 Nsp1由180个氨基酸残基构成(共20种),相对分子量19.78 kDa,等电点5.36,负电性氨基酸残基数(Asp + Glu)为27,正电性氨基酸残基数(Arg+Lys)为19,占比最高的残基是甘氨酸(12.20%),其次是缬氨酸和亮氨酸(均为11.70%)。见表2。Nsp1的分子式为C872H1383N247O270S4,原子总数为2 776,消光系数12 950(mol/L)-1cm-1。在哺乳动物细胞中的半衰期约30 h,在酵母中超过20 h,在E.coli内超过10 h。Nsp1的不稳定指数约28.83,脂肪系数达89.72,平均亲水性指数-0.378。
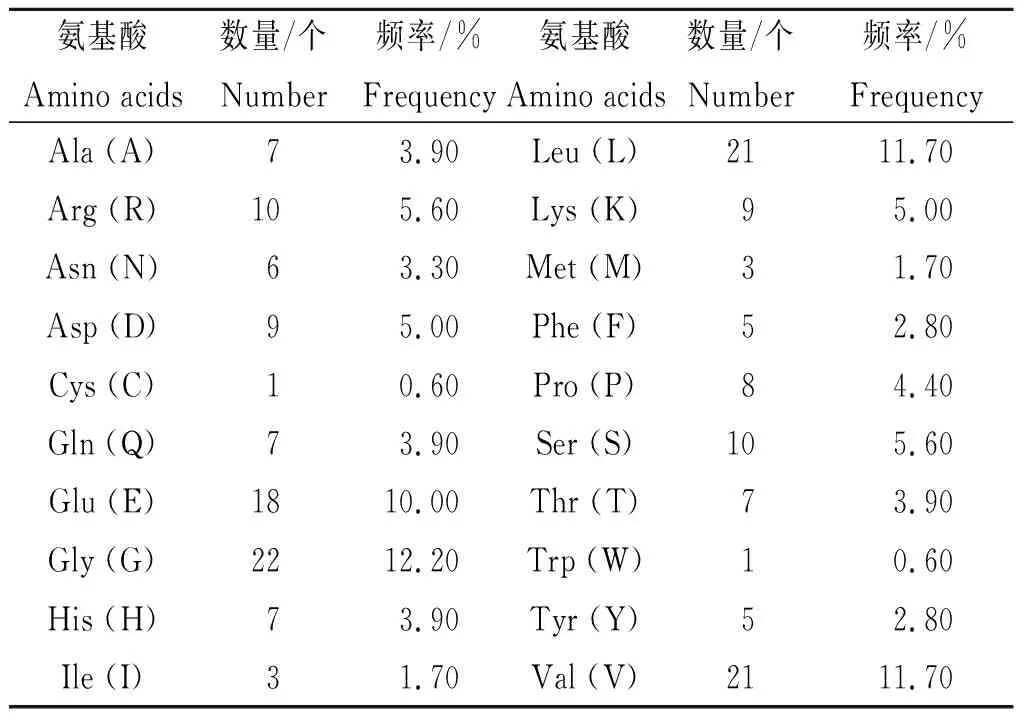
表2 新冠病毒Nsp1蛋白的氨基酸组成Tab.2 Amino acid composition of SARS-CoV-2 Nsp1 protein
2.2 Nsp1蛋白跨膜结构分析 在线预测Nsp1的跨膜结构,结果显示该蛋白无跨膜区(图2)。
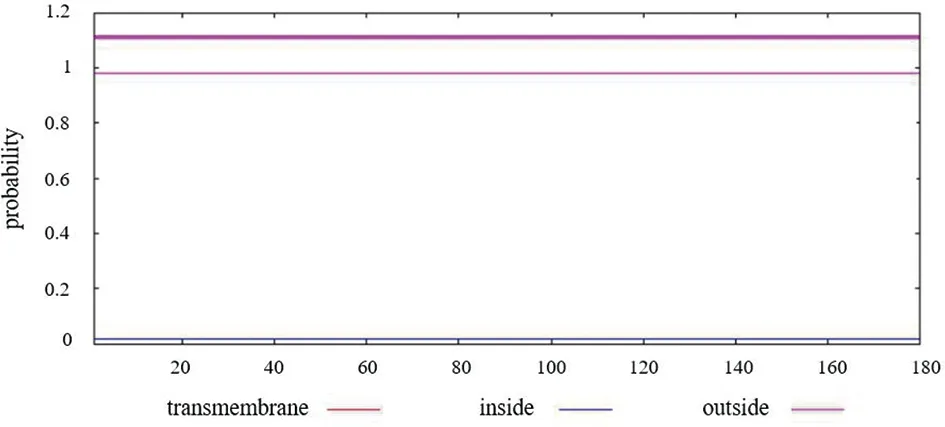
图2 新冠病毒Nsp1蛋白的跨膜结构预测Fig.2 Transmembrane structure prediction of SARS-CoV-2 Nsp1 protein
2.3 Nsp1的亲水与疏水特性 结果表明,Nsp1的L88疏水特性最强,分值1.878,N162亲水特性最强,分值-2.611;含有亲水氨基酸112个,疏水氨基酸60个,平均亲水指数-0.378,提示Nsp1是一个亲水蛋白(图3)。

图3 新冠病毒Nsp1蛋白亲水/疏水性分析Fig.3 Hydrophobic/hydrophobic analysis of SARS-CoV-2 Nsp1 protein
2.4 Nsp1的磷酸化修饰预测 Nsp1存在12个磷酸化修饰位点,其中S17、S34、S40、S74、S100、S135、S142和S166为丝氨酸修饰位点,T151为苏氨酸修饰位点,Y68、Y97和Y154为酪氨酸修饰位点(图4、表3)。

图4 新冠病毒Nsp1蛋白的磷酸化位点Fig.4 Phosphorylation sites of SARS-CoV-2 Nsp1 protein

表3 Nsp1蛋白的磷酸化位点及对应的激酶Tab.3 Phosphorylation sites of Nsp1 protein and corresponding kinases
2.5 Nsp1蛋白亚细胞定位与信号肽预测 预测得知56.5%的Nsp1在细胞质,30.4%存在于细胞核,线粒体、分泌小泡和细胞骨架中各占4.3%。对N端前70个残基进行分析后发现,Nsp1蛋白不含信号肽(图5)。

图5 新冠病毒Nsp1蛋白信号肽预测Fig.5 Prediction of SARS-CoV-2 Nsp1 protein signal peptide
2.6 Nsp1蛋白糖基化位点预测 没有信号肽的蛋白质不太可能暴露于N-糖基化机制,因此可能不会被糖基化(在体内)。利用NetNGlyc 1.0 Server预测后发现,Nsp1蛋白可能不会被N-糖基化修饰(图6)。

图6 新冠病毒Nsp1蛋白N-糖基化位点Fig.6 N-glycosylation site of SARS-CoV-2 Nsp1 protein
O-糖基化修饰预测发现,Nsp1有3个可能的O-糖基化修饰位点:S40、S74和T163(图7)。
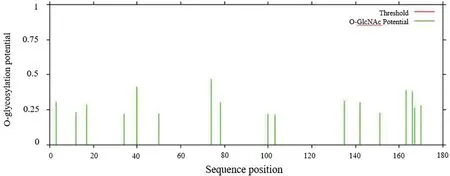
图7 新冠病毒Nsp1蛋白O-糖基化位点Fig.7 O-glycosylation sites of SARS-CoV-2 Nsp1 protein
2.7 Nsp1蛋白二级结构分析 使用Prabi网站对Nsp1蛋白的二级结构进行分析。结果显示,Nsp1中α-螺旋占25.56%,延伸链占20.56%,β-转角占8.89%,无规则卷曲占45.00%(图8)。

图8 新冠病毒Nsp1蛋白二级结构Fig.8 Secondary structure of SARS-CoV-2 Nsp1 protein
2.8 Nsp1蛋白的相互作用网络 最新的蛋白质组学分析显示[13],Nsp1与6个蛋白存在相互作用,分别是:DNA引物酶小亚基(PRIM1),DNA引物酶大亚基(PRIM2),DNA聚合酶α复合物催化亚基(POLA1),DNA聚合酶α复合物辅助亚基(POLA2),Plakophilin-2(PKP2)及前胶原半乳糖基转移酶1(COLGALT1)(图9)。

图9 新冠病毒Nsp1蛋白相互作用网络Fig.9 Interaction network of SARS-CoV-2 Nsp1 protein
2.9 Nsp1蛋白结构域分析 Nsp1含有2个结构域,N端为冠状病毒Nsp1球状结构域(T12-G133),C端为β-冠状病毒Nsp1 C末端结构域(E148-G179)(图10)。Nsp1是α冠状病毒和β冠状病毒的一个特征性蛋白,在抑制宿主基因表达和抗病毒反应方面表现出功能保守性和机制多样性。尽管冠状病毒Nsp1蛋白之间的序列同源性较低,但其核心结构共享一个相对保守的球状结构域。

图10 新冠病毒Nsp1蛋白的结构域分析Fig.10 Domain analysis of SARS-CoV-2 Nsp1 protein
Sarbe冠状病毒Nsp1的C末端结构域通过与核糖体40S亚基的mRNA通道结合,干扰mRNA结合进而抑制宿主蛋白质翻译。这种抑制机制可能是Sarbe冠状病毒特有的,因为Nsp1的C端在α冠状病毒中较短,并且在包括MERS冠状病毒在内的其他β冠状病毒中并不高度保守。
2.10 Nsp1蛋白的三维结构 根据蛋白质三级结构建立网站构建Nsp1蛋白的三级结构。结果只显示10~126位点,148~180位点的三级结构模型(图11)。

图11 新冠病毒Nsp1蛋白的三维结构分析Fig.11 Three-dimensional structure analysis of SARS-CoV-2 Nsp1 protein
2.11 Nsp1蛋白序列同源性分析 通过Uniprot网站检索发现,与新冠Nsp1序列最接近的是Bat SARS-like coronavirus WIV1(85.0%),接着是Bat coronavirus Rp/Shaanxi 2011、严重急性呼吸综合征冠状病毒、SARS coronavirus WH20和SARS coronavirus PUMC02,序列一致性均为84.4%,与Bat Hp-betacoronavirus/Zhejiang2013的序列相似度为28.7%。所有序列中相同的残基占比21.1%(*所示),性质相似的占比19.4%(:所示),相似性较低的占比16.1%(.所示)(图12)。

图12 新冠病毒Nsp1蛋白序列同源性Fig.12 Homology of SARS-CoV-2 Nsp1 protein sequence
2.12 Nsp1的进化树构建 结果显示,这15种病毒的蛋白与SARS-CoV-2的Nsp1蛋白亲缘关系较远,BtRs-BetaCoV/YN2013与非典型冠状病毒HKU3聚为一支,置信度为72,聚为一支后与蝙蝠非典型冠状病毒WIV1聚为一支,置信度为39。此外,BtRf-BetaCoV/JL2012与Bat SARS-like coronavirus YNLF_31C聚类为同一支,置信度78;Bat coronavirus Rp/Shaanxi2011与BtRs-BetaCoV/HuB2013聚类为同一支,置信度48(图13)。

图13 新冠病毒Nsp1蛋白系统进化树Fig.13 Phylogenetic tree of SARS-CoV-2 Nsp1 protein
2.13 表达载体pET-22b-Nsp1的构建
2.13.1Nsp1的酶切与PCR验证 用NdeI与XhoI对Nsp1进行酶切(图14A);PCR扩增Nsp1序列,电泳检测显示片段大小合适(图14B)。

A:Nsp1双酶切实验 1:Nsp1酶切产物 M:2-log DNA marker B:菌落PCR 1~6阳性单克隆 图14 Nsp1的酶切与菌落PCRFig.14 Restriction endonuclease digestion and colony PCR validation of Nsp1
2.13.2 pET-22b-Nsp1的酶切及转化 用NdeI与XhoI同时酶切重组载体,电泳检测显示片段大小正确(图15A);将pET-22b-Nsp1转化Top10,于37 ℃恒温培养13 h(图15B左),提取质粒后测序验证,选取正确的转化BL21(图15B右)。
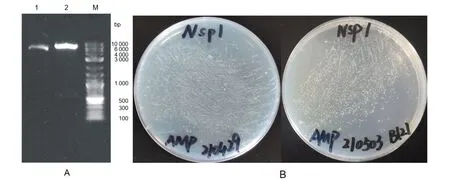
A:pET-22b-Nsp1酶切实验 1:不酶切 2:双酶切 B:pET-22b-Nsp1转化实验(左:Top10,右:BL21)图15 pET-22b-Nsp1的酶切和转化Fig.15 Enzyme digestion and transformation of pET-22b-Nsp1
2.14 Nsp1的蛋白表达 菌体培养至OD600为0.4~0.6时用0.5 mmol/L IPTG去诱导,12%SDS-PAGE检测显示,Nsp1蛋白表达量经诱导之后显著上调(泳道4和泳道10);对诱导前和诱导后的全细胞裂解液、上清液、沉淀分别检测后发现,Nsp1主要表达在沉淀(泳道3、6;泳道9、12)(图16)。对泳道6和12的相应位置进行切胶并质谱鉴定(图17),发现沉淀中表达的确实是目标蛋白Nsp1。

图16 Nsp1蛋白的诱导表达检测Fig.16 Detection of induced expression of Nsp1 protein

图17 Nsp1蛋白的质谱鉴定Fig.17 Identification of nsp1 protein by mass spectrometry
3 讨 论
新冠疫情的全球蔓延给世界公共卫生安全带来了巨大挑战,尽快阐明SARS-CoV-2的传播机制并开发有效的抗病毒药物是遏制疫情蔓延的关键所在[14]。结构分析显示,Nsp1的C末端结构域阻碍mRNA在核糖体上的进入通道(mRNA entry tunnel),加速宿主细胞mRNA降解,导致宿主蛋白合成减少并促进病毒存活[11,15]。Nsp1还能有效阻断RIG-I依赖的先天免疫反应,抑制宿主细胞对病毒的清除[11,16]。由于Nsp1参与病毒生命周期的多个阶段,因此它是一个潜在的抗病毒靶点和重要的毒力因子。
生物信息学分析对于目的蛋白的表达具有很强的指导意义,E.coli表达系统以其安全性好、操作简便、表达量高、容易放大培养等优点,被广泛用于基因工程药物生产[17]。此外,原核表达对于快速制备抗体和体外功能研究具有较大优势。目的蛋白的理化性质、分子量、氨基酸组成、等电点、亲疏水性、序列保守程度、GC含量、密码子组成等对于原核表达都具有重要影响。通常情况下,蛋白分子量超过100 kD或低于5 kD时均难以表达。分子量太小的易被降解,通过加入融合标签GST、Trx、MBP或者较大的促融合蛋白标签有助于使目的蛋白正确折叠,并以可溶形式表达;对于密码子进行优化,也可提高目的蛋白的翻译效率和表达量。本文生物信息学分析显示,Nsp1蛋白分子量19.78 kDa,等电点5.36,性质较稳定,在哺乳动物中半衰期约30 h,在E.coli内大于10 h,无信号肽和跨膜螺旋,亲水性较强,不属于分泌蛋白。无规则卷曲在Nsp1蛋白中占比最高(45.00%),其次是α螺旋(25.56%)和延伸链(20.56%),以上结果为进一步揭示该蛋白的结构及功能提供了数据基础。
糖基化和磷酸化修饰是生物体内最重要的翻译后修饰方式,糖基化对蛋白的折叠、免疫原性、稳定性及定位具有重要影响。磷酸化修饰可改变蛋白的生物活性,从而调控细胞内信号转导。蛋白的磷酸化修饰与病毒粒子增殖、组装和复制密切相关,在调控病毒与宿主的代谢中起重要作用。本研究分析显示,Nsp1有3个O-糖基化位点及12个磷酸化位点,然而仍需进一步实验验证。系统鉴定病毒蛋白的磷酸化位点并揭示其调控机制将有助于抗病毒药物的研发和病毒感染机制的阐明。
SARS-CoV的Nsp1蛋白通过“双管齐下”的策略抑制宿主基因表达,它首先结合核糖体40S亚基,在翻译起始的不同阶段使经典的mRNA翻译(canonical mRNA translation)停滞[18-19]。其次,Nsp1与核糖体结合导致宿主mRNA的酶切和降解。然而,Nsp1与病毒mRNA的5′ UTR保守区相互作用进而避免自身蛋白翻译停滞的机制还有待进一步研究[20]。本文多序列比对显示,SARS-CoV-2与SARS-CoV的Nsp1序列一致性为84.4%(图12),提示二者具有相似的理化性质和生物学功能。研究发现SARS-CoV Nsp1的C末端残基K164和H165在β冠状病毒中高度保守,二者对Nsp1与40S亚基的相互作用至关重要,K164A和H165A的突变导致Nsp1无法结合40S并抑制翻译起始[19]。近期,Schubert等[21]和Thoms等[11]的电镜结构分析显示,SARS-CoV-2 Nsp1的C末端区域折叠成两个螺旋,插入mRNA入口通道,阻碍mRNA进入进而抑制宿主蛋白翻译。第1个螺旋(P153-N160)与40S核糖体蛋白uS3和uS5形成疏水作用,第2个螺旋(S166-N178)与eS30和18S rRNA的h18相互作用。保守的KH二肽(K164和H165)与h18形成关键相互作用,这种相互作用是基于H165与U607和U630之间的碱基堆积力,以及K164与G625和U630的磷酸骨架之间的静电相互作用。此外,SARS-CoV-2 Nsp1的K164和H165残基对于核糖体结合和抑制宿主基因表达至关重要[11, 22]。以上结论与本文多序列比对结果相吻合。
结构域分析显示,Nsp1的N端(T12-G133)为冠状病毒Nsp1球状结构域,C端(E148-G179)为β-冠状病毒Nsp1 C末端结构域(图10)。Zhao K等[23]对SARS-CoV-2 Nsp1 N末端(K11-K125)的结构与功能研究发现,单独的N末端不能与核糖体共定位并抑制宿主蛋白翻译,单独的C端可与核糖体共定位但其抑制蛋白质翻译能力明显减弱。有趣的是,将Nsp1的C端与增强型绿色荧光蛋白(EGFP)或其他蛋白融合以取代其N端,可将蛋白翻译抑制能力恢复到与全长Nsp1相当水平。这就说明Nsp1的N末端能够稳定C末端同核糖体的结合,并作为非特异性屏障阻断mRNA通道从而抑制宿主细胞翻译,因此SARS-CoV-2 Nsp1主要通过其C端抑制宿主翻译,但N末端是Nsp1发挥功能所必需的。K141、S142和F143残基靠近SARS-CoV-2 Nsp1的C末端,参与40S核糖体亚基的结合[11, 21, 24]。本研究发现,K141-F143序列保守性不高,除SARS-CoV-2之外,其它序列中有14条对应残基均为K141-Y143。此外,Benedetti等[25]鉴定到一个K141-F143缺失的SARS-CoV-2基因组,这种缺失变异可能改变Nsp1蛋白的结构,抑制Nsp1同40S核糖体结合,影响病毒和宿主基因表达调控的活性[26]。以上结果表明,SARS-CoV-2的Nsp1基因正在经历一个进化过程,这可能有助于病毒更好地适应人类宿主。
最后,本文构建了SARS-CoV-2 Nsp1蛋白的表达载体pET-22b-Nsp1并完成原核表达,初步建立了Nsp1蛋白表达条件。当培养至OD600为0.4~0.6时加入IPTG(0.5 mmol/L)诱导,先37 ℃、220 r/min培养2.5 h,接着25 ℃、160 r/min继续培养9 h。结果显示,Nsp1蛋白出现过表达且主要在细菌裂解液离心之后的沉淀中表达(图16),经质谱鉴定(图17),沉淀中主要表达的确实是目标蛋白Nsp1。因此大规模纯化Nsp1用于疫苗研发或结构分析应考虑优先从沉淀中进行。另一方面,从功能研究的角度考虑,可采取改变培养温度16 ℃~30 ℃、降低IPTG浓度(0.01~0.1)mmol/L并延长诱导时间使蛋白更多的在上清表达,因为上清表达的蛋白要比经包涵体纯化的蛋白活性好。需要指出的是,本文还预测到Nsp1存在糖基化和磷酸化修饰,鉴于原核表达系统没有翻译后修饰功能,因此功能研究实验应考虑从真核系统去表达该蛋白。
综上,本文对SARS-CoV-2的Nsp1进行了较为全面的生信分析、表达载体构建及原核表达,研究结果将有助于深入了解Nsp1的生物学功能和设计靶向药。基于本研究结果,将来可针对以下方向进行重点攻关:1)Nsp1蛋白有效抑制宿主细胞翻译但不影响自身蛋白表达的分子机制的阐明;2)针对Nsp1蛋白的靶向药物设计;3)针对Nsp1蛋白所涉及的关键信号通路开发特异性的抑制剂;4)针对Nsp1蛋白或基因的高灵敏度病毒检测方法的开发;5)系统鉴定Nsp1蛋白的翻译后修饰位点并阐明其调控机理。
4 结 论
Nsp1性质稳定,亲水性较强,有多个翻译后修饰位点,原核表达后发现其主要在细菌裂解液离心后的沉淀中表达。因此,其功能研究可能采用真核系统的可溶性表达更适宜。此外,该蛋白序列保守性高,且主要定位于宿主细胞的细胞质与细胞核中,提示其功能重要。本研究为针对该蛋白的纯化、结晶、结构分析、抗体制备和体外功能研究提供了重要的较好的数据基础,有助于加快针对Nsp1的靶向药物研发。
(感谢中国科学院生物物理研究所质谱平台为本文Nsp1蛋白鉴定所提供的大力支持。)
利益冲突:无
引用本文格式:刘玲,李璟,范蕾,等. 新冠病毒Nsp1蛋白结构与功能的生物信息学分析及原核表达[J].中国人兽共患病学报,2022,38(7):566-576. DOI:10.3969/j.issn.1002-2694.2022.00.074
