昆虫保幼激素的合成、信号转导和形态调节作用研究进展
2022-08-11王涛李秀璋梁静唐楚煜陈建博李玉玲
王涛,李秀璋,梁静,唐楚煜,陈建博,李玉玲
(青海大学畜牧兽医科学院, 西宁 810016)
昆虫为了适应环境变化,会不断地更换自身形态,为了更好越冬越夏以及躲避天敌进化出独特的变态发育过程;从卵的孵化—幼虫蜕皮生长—(化蛹)—成虫—产卵的世代交替;其中各个时期间的虫态变化受多种激素的调节。在昆虫体内,脑激素、JH和蜕皮激素(20-hydroxyecdysone,20 E) 组成一个激素调节系统,幼虫期较高的JH滴度使幼虫仅蜕皮而不变态发育[1]。自人们首次发现JH至今约有86年历史, 研究证明,JH是一种倍半萜类化合物且天然JH已发现的有8种:JH0、JHⅠ、JHⅡ、JHⅢ、4-甲基-JHⅠ、JHB3(juvenile hormone bisepoxide)、JHSB Ⅲ、甲基法尼酯(methyl farnesoat,MF),其中JHⅢ在昆虫世代生活中对生理生化的调节作用更加显著[2]。研究认为昆虫不同发育期JH的效用种类不同,卵期(JH0)但JH0也在雌成虫发育的原始时期出现(JHⅠ、JHⅡ、JHⅢ)[3],在幼虫期JHⅠ、JHⅡ低龄时具有协调幼虫龄期发育和变态发育的作用,即幼虫只进行蜕皮生长进入下一龄期而不进行变态发育,如化蛹、羽化等[4];董言德等[5]研究也表明,JH在蜕皮生长、变态发育、成虫生殖以及其它生长发育过程中发挥了非常重要的作用;在成虫期控制两性的发育、促进性激素的表达、促进卵巢发育卵子成熟等生理生化作用。在昆虫的不同龄期虫体内JH滴度水平不同,幼虫期的高JH滴度确保幼虫在蜕皮后保持幼虫体态,在末龄期JH滴度下降不能维持幼虫状态而进行变态发育[6],昆虫变态发育过程中旧组织的消亡和成虫新组织的重建也受低水平JH滴度的诱导[7]。但昆虫的变态发育不仅仅受JH单一激素的调节,20 E也发挥着重要作用[8]。近年来学者对JH在合成与功能、下游受体的信号调控、幼虫变态发育等每个阶段中的作用都展开了大量的研究,但始终未将其贯穿幼虫的整个生活史。本文从JH的合成与代谢到分泌途径到与下游受体的结合以及对昆虫变态发育的影响从昆虫一个完整生活史上分析,为JH在昆虫体内的变态发育的作用做一科学性总结,为昆虫资源的合理利用提供理论依据。
1 JH的生物合成途径
1.1 JH的体内合成途径
一般认为,JH自咽侧体(corpus alatum,CA)中分泌出经血淋巴形成JH-JHBP聚合物顺着体液流动寻找靶细胞并识别[9],识别靶细胞后,JH-JHBP聚合物分解出JH进入细胞质,与细胞质中游离的甲硫氨酸结合激活下游信号促进信号的传递。
JH生物合成路径可以从两种不同的构建角度出发,首先是Bellés等[10]人对JH的结构鉴定符合萜类化合物的特点,推测JH的合成应与萜类化合物的通路相似也遵循异戊二烯定则,同时提出MVA、异戊烯醇焦磷酸(isopentenylpyrophosphate,IPP)、法尼焦磷酸(farnesyl pyrophosphate,FPP)、法尼酸( farnesoic acid,FA)和JH的五级合成理论;经过赵文恩等[11]人对萜类物质研究也提出异戊烯基焦磷酸(IPP)是‘活性’的异戊二烯单元亦是萜类物质合成的中心前体也支持此种观点并发现IPP的生物合成途径为MVA途径和DXP途径;此外杨涛等[12]人在对JH途径研究时发现一般鳞翅目昆虫FA被法尼酸环氧酶氧化为保幼激素酸(juvenile hormone acid,JHA)经过甲基转移酶(JHAMT)生成JH,即FA先氧化再进行甲基转移;而在其他目如蜚蠊目中蜚蠊Blattodea等当具有S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)时,FA先转移甲基为甲基法尼酯(methyl farnesoate,MF)再被细胞色素氧化酶氧化生成JH并对这种合成理论做出了补充;其次是嵇保中等[13]人从碳骨架构成的角度分析JH生物合成路径,C2、C3的乙酰辅酶A到C5、C6的IPP、HIPP,进一步形成C15、C16的FPP、HFPP称其为JH前体化合物,最后是对其修饰形成不同的JH,因此可以将JH的合成细分为以IPP形成为主的MVA和DXP途径(图1)和以FA形成为主的FA途径以及以JH形成为主的JH途径(图2)。

图1 IPP的分子合成途径
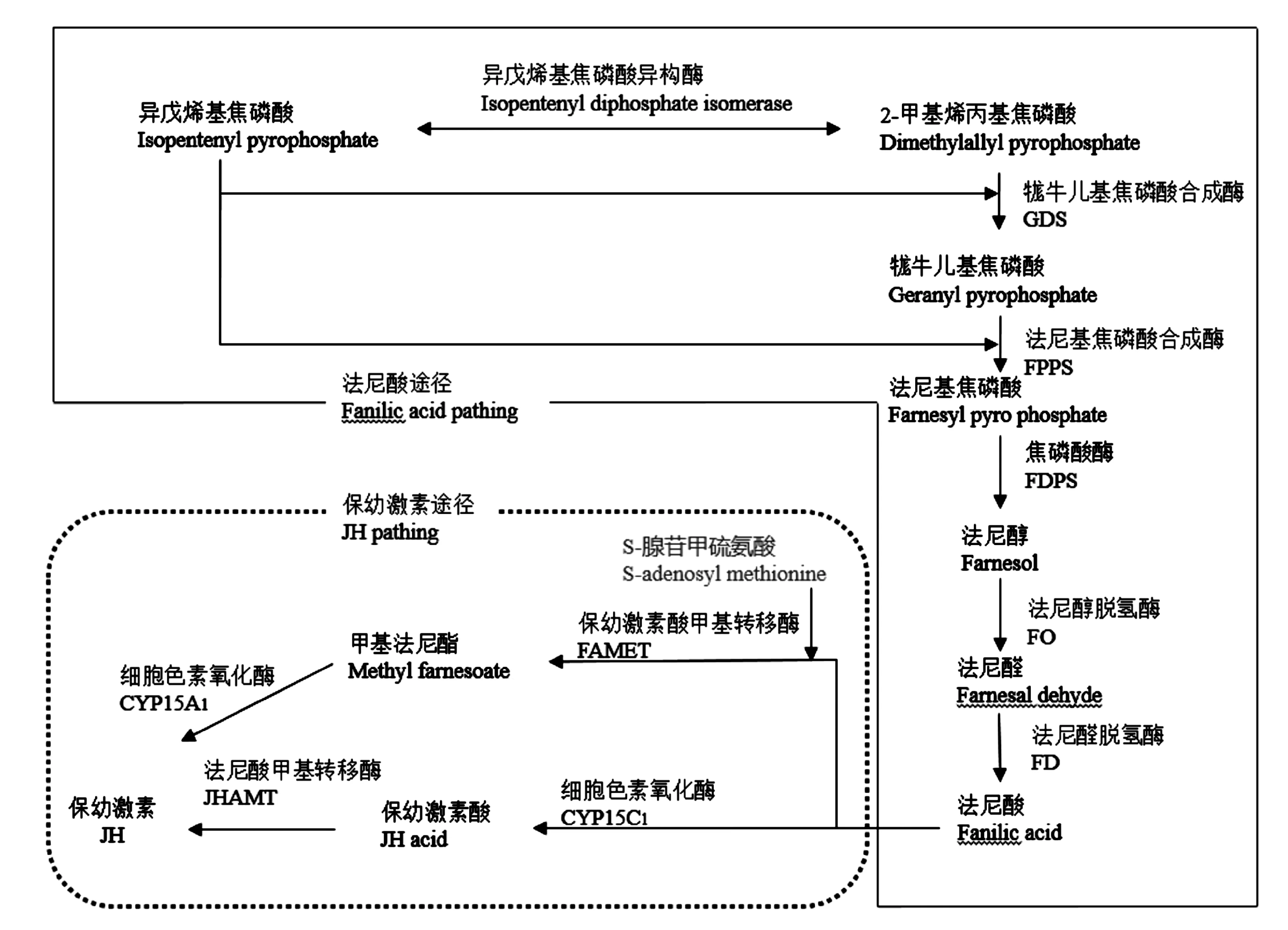
图2 法尼酸途径和保幼激素途径
1.2 JH同系物的合成途径
遵循嵇保中等对JH碳原子数目的划分,关雪辰等将JH划分为16碳和16碳以上,其中16碳的JH三个甲基侧链在合成时由于3分子IPP的化合和甲基化反应引入,包括JHⅢ、JHB3和MF;16碳以上JH形成既可以通过IPP的化合反应和甲基化反应形成JH的甲基侧链也可以通过HIPP化合形成乙基侧链,IPP、HIPP和多个异构体之间的分子比例决定所形成的JH种类,这与Yagi等[14,15]人的研究结果相似;Yagi在用放射性C标记侧链甲基和乙基后在JH同系物中检测到放射性标记,包括JH 0、JHⅠ、JHⅡ、4-甲基-JHⅠ[16]。
随着研究的不断深入,JH的体内合成通路逐渐清晰,嵇保中等在众多学者研究的基础上总结了JH以及其同系物合成的通路(图3)。按照起始化合物的不同分为Acetyl-CoA-IPP的MVA途径和丙酮酸+3-磷酸甘油醛-IPP的DXP途径(已有报道此途径只在细菌如大肠杆菌和植物质体中存在,昆虫中是否存在这一途径尚未有发现,但也不失为JH合成的新途径)[17-20],继而合成FA-JH的生成[21,22]。在不同目的昆虫体内有不同的合成方式,鳞翅目主要以FA-JHA-JH,而在其他目的昆虫体内又发现了FA在依赖SAM环氧化酶的作用下形成MF到JH的途径;这与郝宏蕾等人的研究结果鳞翅目JH的合成通路相似[1];Marchal[23]在研究德国小蠊Blattellagermanica时发现,在幼虫成虫过程中FA的合成具有两种通路并证实均导致IPP的增加,这与赵文恩等的研究结果相似;Yang等[24]人在亚洲飞蝗LocustamigratoriaL.雌性成虫体外放射合成JH时的合成路径并未检测到JHA,加入SAM和环氧化酶后检测到MF和JH峰值的出现,侧面验证了Bellés 等人的研究结论。尽管现在对JHⅢ的分子合成通路的研究已经较为清晰了,不仅从异戊二烯合成法则和碳骨架的构建两个方向分别讨论JHⅢ的合成也发现了多种的合成通路,但在不同目的昆虫之间JHⅢ的合成通路存在差异,为什么会产生这些差异,差异与目或科之间是否有所关联将成为未来研究的一个方向。

注:图中数字表示反应的分子比例。如1分子的Propenyl-CoA和2分子的Acetyl-CoA形成1分子的HEG-CoA等
1.3 影响JH合成的因素
1.3.1JH的合成能力
在CA中JH的合成受多种因素的影响,合成上游较为显著的受CA活性的影响,合成途径中受酶类主要为HMGR和JHAMT转录水平的调节,此外也受昆虫的营养条件、发育水平的调控。赵晓明等[25,26]人研究表明,蜕皮触发激素(ETH)、胰岛素(Insulin)、谷氨酸盐(glutamate)、短神经肽(sNPF)、 抑咽侧神经肽(AST)和促咽侧神经肽(AT)等都可以调节CA合成活性。Glutamate通过调控JHAMT的转录来调控JH的合成; Insulin调控胰岛素受体(InR)介入还原性辅酶A (CoA)基因表达的过程间接调控sNPF和HMGR来调控JH合成。SNPF在MVA途径抑制JH中心体IPP的合成,同时AT正向调控sNPF,而AST负向调控 sNPF[27];HMGR被认为是将HEG-CoA还原成MVA并且是MVA途径起始的关键酶类,JHAMT被认为是催化JHA生成JH的控速酶类。营养条件、发育水平对JH合成的影响主要表现为对蛋白、糖原和脂质等初始原料合成数量的多少进而间接调控JH的合成。埃及伊蚊Aedesaegypti的低营养性喂食试验发现成虫个体变小,检测表明蛋白、糖原、脂质含量显著降低合成JH的能力下降,表明JH的合成需要充足的营养条件的支持[28];冬眠的库蚊Culex采食行为较低导致库蚊的滞育,生理活动也相应降低可能也与JH 滴度降低有关[29]。李娟等[30]人对蟋蟀Gryllidae雌性成虫卵巢摘除试验,摘除后成虫CA内JH合成被抑制滴度水平显著降低,表明卵巢也是调控JH生物合成的因子之一;与之相似的是在雌性太平洋折翅蠊Diplopterapunctata中,卵巢发育初期上调CA内JH的表达,成熟后反向下调CA内JH的合成,都表明雌虫的生殖进程可以影响JH的滴度水平[31]。总之,昆虫的生殖发育进程、体内营养水平、酶类表达活性等都能调控JH的合成水平,但是具体的分子调控机制研究较少。
1.3.2JH的代谢能力
在细胞质中,JH的滴度水平也与代谢能力相关 (图4)。一方面受多种代谢酶类水平的影响主要为以下三种,保幼激素酯酶(juvenile hormone esterase,JHE)降解JH为JHA; 环氧化物水解酶(juvenile hormone epoxide hydrolase,JHEH)降解JH为保幼激素二醇(juvenile hormone diol,JHd);JHE与保幼激素二醇激酶(juvenile hormone diol kinase,JHDK)共同降解JHA为JHad[32,33],JHad和JHdp是JH的最终代谢产物。另一方面受代谢酶类基因转录因子活性的调控如转录因子(forkhead box O,FoxO)的影响,当其表达上调时促进代谢酶类的转录翻译,同时沉默Kr-h1(krüppel-homolog1)基因片段的表达,阻断Kr-h1对JHd的应答反应[34]。总之,代谢酶类的水平、代谢酶类基因转录活性对JH的代谢能力都有显著的影响,其中的详细作用机理尚需要从蛋白合成角度寻找。

图4 JH的代谢过程模式图
2 JH信号转导过程中与多个受体之间的作用
2.1 JH的最佳受体Met
基于JH功能的多样性,Wilson和Fabian猜想JH可能具有多种受体,并认为细胞膜上的受体耐烯虫酯蛋白Met是主要的受体[35]。
JH专一性的与Met相结合后不仅诱导下游基因的表达,还能上调Met的转录表达,因此普遍认为Met可能是JH的最佳受体[36,37],但也有研究从JH本身结构的疏水性和低分子量,控制基因表达的细胞内受体USP可能为主要作用部位[38]。通过DNA测序,鉴定出Met是basic-helix-loop-helix(bHLH)/Per-Arnt-Sim (PAS)转录因子家族的构成主体相似的是Met编码一个PAS-B转录因子,其是DNA结合结构域也是JH的特异性结合位点[39,40]。Baumann在果蝇drosophilidMet突变体试验中对Met合成能力缺失的果蝇施以过量的JH处理致使果蝇幼虫产生假瘤,果蝇体外检测显示出Met突变体能够在接收到JH滴度的变化信号后上调Kr-h1的表达,促使Met的表达[41,42]。然而Met突变体除了成虫产卵延迟、生殖力下降之外,胚后发育基本正常,这与Met作为JH受体应有的表型相矛盾也与JH的生理生化功能不吻合[43]。
GCE是Met基因片段重复而产生的的旁系同源基因,其突变体对保幼激素类似物具有较高的耐受性,功能相似,Met和Gce的双突变体导致果蝇死亡也验证了这一结论[44]。此外Met和GCE之间可以以二聚体的形式存在,Met缺失突变没有致死表型,可能是GCE的互补效应造成的。随着RNA干扰技术的发展,赤拟谷盗TriboliumcastaneumHerbst由于只有一个Met/Gce基因成为研究JH的又一模式昆虫,对幼虫Met基因沉默致使其提前化蛹或形成幼虫和蛹之间的‘中间体’,对大龄期幼虫施加Met干扰加速幼虫变态过程,不施加干扰时会导致其形成“超龄蛹”这就是 Williams经典的“现状维持效应”[45],其中赤拟谷盗幼虫的CA摘除试验与GCE缺失体表现型相似也支持这一观点[19,38,46]。
2.2 JH的下游受体基因
JH的调控作用除了细胞膜受体Met激活基因组转录途径,还能够引发核基因组转录途径触发和细胞膜非基因组信号转导途径,即蛋白激酶信号途径(PKC)和Ca2+信号途径从而影响下游基因的表达[48]。目前较为清晰的下游基因首先是Kr-h1,由于剪切酶的特异性剪切Kr-h1具有两个异构体α和β,Kr-h1-α主要在果蝇的胚胎期表达,Kr-h1-β在幼虫发育阶段表达[49]。赤拟谷盗幼虫末龄期Kr-h1表达活性逐渐降低化蛹期不再表达,幼虫开始变态发育,添加外源性JH诱导Kr-h1表达变态发育被抑制,基于此逐渐形成了JH-Met(协同Gce)-Kr-h1调控模式[50]。其次是Br,成虫果蝇腹部仍保留有蛹期特征,于鹤研究认为是JH抑制了20 E对Br的表达引起的,外源性JH只能诱导Br在成虫腹部表达[51]。赤拟谷盗幼虫期,相对较高的JH滴度诱导通过Met抑制Br的表达,而在蛹到成虫期JH滴度趋于零时通过外源性施用JH通过Met诱导Br再次表达并产生第二次化蛹,抑制向成虫的变态,表明JH通过Met调控Br的表达,但决定抑制还是上调可能与JH滴度、发育时期有关;Br基因被RNA干扰沉默后赤拟谷盗蛹期幼虫的羽化变态进程也同步被阻止,表明Br的表达对蛹期变态具有重要作用[52]。以上研究均表明,Kr-h1和Br是JH与其受体结合后作用的下游表达基因。
3 JH对幼虫的形态调节作用
3.1 幼虫期JH对龄期转变和化蛹的调节
在幼虫期,化蛹是完全变态昆虫变成成虫特有的时期,起初研究认为JH和前胸腺激素(prothoracic gland hormone,PGH)协调控制幼虫蜕皮行为[53]。但近年的研究均认为JH和20 E协同调控幼虫的变态生理进程。JH主导幼虫蜕皮后维持幼虫性状特征遏制化蛹的变态过程,20 E主导幼虫在蜕皮时进入下一个龄期促进幼虫—蛹—成虫变态,幼虫期的变态发育主要受JH与20 E相对含量的比例的调控。当JH显著高于20 E时诱导幼虫蜕皮,当JH显著低于20 E时诱导幼虫化蛹,当JH滴度趋近于零20 E单独起作用时诱导完全变态昆虫蛹的羽化,不完全变态昆虫直接变成成虫[54,55]。在幼虫的低龄期CA大量合成并分泌JH,JH可以直接或间接通过促前胸腺激素(prothoracic gland,PTTH)的合成调控20 E的表达,20 E启动与调整蜕皮的过程进入下一个龄期;高水平的JH和20 E诱导特殊的转录因子E75A的RNA在JH其它转录因子Kr-h1和Br转录之前表达[56,57]。E75A一方面诱导JH表达的,另一方面也抑制自身和20 E诱导的Br-c等早期基因的表达,因此,E75A的表达佐证了JH和20 E协同调控幼虫龄期变化的理论[58]。此外基因芯片分析在黑腹果蝇的L 57细胞系中发现一个受高滴度JH诱导表达的基因,在它的启动子区域存在一个29 bp的JH反应原件DmJHRE 1,其与FKBP 39、Chd 4特异性结合抑制FKBP 39、Chd 4和20 EcR-USP (20 E受体复合体)和JH的受体复合体的相互识别与结合[59];最终降低20 EcR-USP结合下游转录因子的活性,导致所诱导的一系列初级反应基因E74、E75、E93和BR2C等的表达减缓,蜕皮和变态过程中的细胞程序性凋亡和自噬进程延缓;因此FKBP39基因具有延迟果蝇幼虫细胞自噬的功能,也说明高滴度的JH可以阻碍20 E诱导的细胞程序性死亡,间接反映JH和20 E协同调控幼虫的蜕皮进程。从蛋白组调节分析是幼虫基因组中表皮基因控制的幼虫型表皮蛋白时空表达的结果,蜕皮时20 E抑制其的表达完成蜕皮高滴度的JH诱导其的再次合成保持幼虫形态,幼虫末期JH滴度趋于零,幼虫型蛋白基因不在表达,20 E诱导蛹表皮蛋白或成虫表皮蛋白的合成[60,61]。
因此,幼虫孵化、蜕皮生长、化蛹和羽化等都是基因时空表达间接控制的结果,主要通过调控JH、20 E的分泌调控幼虫的变态发育进程,而分析基因的这种表达水平和顺序有助于我们对幼虫发育的形成有更深刻的认识。
3.2 成虫期JH对雌虫卵巢发育的调节
幼虫经过蛹期到成虫期的转化,卵巢中卵巢管在蛹初期形成并开始增长,输卵管的不断增长促进卵巢的形成,卵室发育促进各级卵的形成,完成卵—幼虫—蛹—成虫的生活史;其中蛹末期到隐虫期卵黄出现并开始沉积,此时一级卵形成,雌虫CA分泌JH的基因开始再表达[62],因此,JH在雌虫卵黄的合成、卵巢的形成中起到何种作用引起了众多学者的研究。预蛹期长角血蜱HaemaphysalisIongicornis卵巢中卵室尚未出现仅卵巢管开始形成并不断生长,输卵管的不断增长促进卵巢的形成,卵室发育促进各级卵的形成,其中蛹末期到隐虫期卵黄出现并开始沉积,此时一级卵形成,雌虫的CA再次启动JH的表达,因此,JH在雌虫卵黄的合成、卵巢的形成中起到何种作用引起了众多学者的研究[63]。卵黄、卵巢的发育离不开卵黄原蛋白VG和卵黄磷蛋白Vt的合成,PAGE电泳分析表明二者均属于脂蛋白于隐成虫期合成[64];吕慧平对雌蝶蛹金小蜂Pteromaluspuparum脂肪体超微结构的电镜观察表明,蛹期脂肪体内未发现粗面内质网不具备合成蛋白质的条件,而在羽化期前后一周脂肪体内粗面内质网、线粒体数量增多开始蛋白质的旺盛合成[65]。因此,VG于隐成虫期合成,在成虫期诱导雌虫生殖生长。大量研究均表明,VG的合成主要受JH的调控,在飞蝗Locustamigratoria和德国小蠊体内VG由JH诱导在脂肪体中合成;果蝇、实蝇一些双翅目昆虫VG转录受到JH和20 E的共同调节但合成地点均主要为脂肪体,其次在卵巢的卵泡细胞中也有表达。
从基因角度分析,埃及伊蚊中JH通过提高Kr-h1、ET等多个基因的转录水平调控成虫羽化到卵黄发生前期的生殖过程,在东亚飞蝗Locustamigratoriamanilensis中JH上调Ncoa、Kr-h1、E75、FTZ-f1等多个基因的表达,通过RNAi干扰Met、Kr-h1抑制VG的转录和卵巢发育,在赤拟谷盗中,JH调节VG的合成,20 E调控卵巢发育和卵母细胞的成熟[66,67]。从JH受体信号转导角度分析,Song等人认为JH通过其受体Met调控卵黄生成和卵母细胞发育[68,69];在飞蝗中干扰Met可以阻碍JH诱导VG的合成,延迟卵巢发育和脂肪堆积,影响卵泡上皮细胞的大小[70,71]; Smykal等通过对JH-Met或JH-Met-Kr-h1信号通路的阻断试验证实JH不仅可以通过此信号通路促进卵黄生成、卵母细胞成熟,还能通过其受体复合体Met/SRC上调Mcm4(minichromosome maintenance proteins 4)、Mcm7(minichromosome maintenance proteins 7)以及Cdc6(ATPase cell division cycle 6)的表达,导致卵黄生成和卵巢发育时DNA的复制和多倍化[72]。Guo等人在对埃及伊蚊的突变Met缺失体对比试验中发现,正常组刺激Met可以激活核糖体(RRSI)合成和六个核糖体的表达,突变组脂肪体中卵黄原蛋白的分泌减少导致卵巢发育迟缓,繁殖力下降,同时证明JH能够促进核糖体蛋白基因的表达[73]。近年来的研究也证明Met的缺失体导致交配延迟,缺乏Gce受体却没有影响,因此证明JH通过Met调控雌雄性信息激素的产生和交配时间[74,75,76]。
因此,昆虫成虫雌虫的生殖生长受激素水平、营养水平和相关酶活性等多方面的调控,但其中JH的调控起主导作用;JH通过对Kr-h1、ET、Ncoa、E75、FTZ-f1等不同基因的活性上调或下游受体Met的激活促进VG基因的转录,其详细的分子过程尚不清晰,仍需要进一步研究。
4 展望
4.1 JH不同的合成路径对幼虫的影响
不同目的昆虫JH的合成通路不同,在上文中已经详尽的介绍了两种途径的合成通路。DXP通路在昆虫体内是否存在尚未可知,但其所需要的酶类相对较少,因此启动JH的合成所需酶类准备时间较短,其次较短的合成通路产生的中间体较少合成JH的效率较高对原料的使用率较高,所以仅从原料、合成时间和路径等来看,DXP途径显著优于MVA途径。昆虫体内已有报道均是以MVA为主要JH合成途径,但这种效率低、时间慢、消耗营养物主较多的途径如何在进化中获得优势?我们认为或许是基于昆虫对MVA途径代谢中间体的大量需求或是幼虫生境条件相对稳定不需要较快的发生虫态的变化,因此,针对不同合成途径的昆虫和其对生境的适应性研究将有利于进一步揭示变态昆虫与环境之间的生物适应性;从生物进化的角度分析,只有昆虫中出现了萜烯类的JH,其他动物尚没有发现这种激素是一个十分有趣的现象。
4.2 JH信号转导通路的基因调控
现有研究均是对Met受体基因表达的干扰,其一是Gce与Met基因上的同源性功能上的相似性,其二是生物体性状受多组基因的协同调控,但这种研究是不够严谨的,即使是这种功能基因被有效沉默也难以短期内在试虫体态上明显的表现出来;因此,必须从基因水平进行分析。Kr-h1、Br是受体的主要下游作用基因,多个受体多个响应基因之间如何互作从而调控昆虫的生长发育,将是未来亟待解决的问题。最新研究通过Western blot、IP、定点突变技术发现Kr-h1的磷酸化和去磷酸化是影响其与Met结合活性的主要因素[77,78],更多的分子证据仍需要更深入的研究。此外,昆虫属种的不同也使幼虫在蜕皮长大的过程中所需的JH滴度不同,同一属种的幼虫在不同龄期进入到下一龄期所需的JH滴度也不同,这是由什么原因导致的,或许可以从JH信号转导过程中下游受体产生的级联反应的响应程度进一步展开研究。
4.3 JH对昆虫生长发育的调节
近年来,学者通过研究白蜡虫提出激素调控幼虫两型变态发育的观点,1龄虫作为两型变态的起点,在2龄幼虫后雌雄虫角质化程度出现显著差异,较高的JH滴度诱导了雌虫不完全变态发育,低JH滴度诱导雄虫不完全变态发育[79,80];与之相似的现象是在蝙蝠蛾属幼虫化蛹时雄虫会在6或7龄期提前化蛹,雌虫在8或9龄期延迟化蛹,且雌雄比控制在1∶3左右,导致雄虫首先羽化雌虫后羽化[81,82],在应对剧烈环境变化时促进种群的繁衍,但并未对这种结果进行解释和研究。
