影响高分级动脉瘤性蛛网膜下腔出血患者预后不良的危险因素分析
2022-08-11郑云贵卢晓闻
郑云贵,陈 哲,卢晓闻,袁 军
(汕头大学医学院第一附属医院神经外科,广东 汕头 515041)
动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage, aSAH)是临床常见的急危重症之一。临床上一般采用Hunt-Hess分级法对aSAH患者的临床症状轻重进行评级,总共分Ⅰ ~ Ⅴ 5个等级。Ⅳ ~ Ⅴ级患者,即有中度至重度的偏侧不全麻痹、去脑强直、深昏迷、濒死状态等一系列表现,临床把这类患者归为高分级aSAH[1]。对于低分级aSAH的患者,入院后主要问题是防止再出血和脑血管痉挛,通过手术治疗闭塞动脉瘤是改善其预后的有效途径;高分级aSAH患者由于蛛网膜下腔出血后早期脑损伤和脑血管痉挛,通常持续性昏迷,易出现营养不良,进而导致代谢紊乱、免疫功能下降等情况,加重病情,且入院时的Hunt-Hess的分级越高,治疗过程中出现并发症的概率也越高,可能对预后造成不良影响。既往临床倾向于先采用保守治疗的方式治疗高分级aSAH患者,待患者病情好转后再选择性进行外科干预。但随着重症监护、外科技术、复苏技术等,特别是介入技术的发展,使得许多aSAH患者在介入手术后可能获得良好的预后,但目前对于高分级aSAH的处理方式和时机以及预后因素等仍存在不同结论。贾玲等[2]研究表明,年龄、Hunt-Hess分级、动脉瘤位置、动脉瘤直径、数目、颅内血肿量、手术时机与高分级aSAH患者预后相关。贺喜武等[3]研究表明,CT Fisher分级高、Hunt-Hess分级高、晚期进行手术等因素是颅内动脉瘤患者介人栓塞术后预后的危险因素。ZHAO等[4]对介入治疗高分级aSAH的一项研究结果显示,老年人、世界神经外科医师联盟(WFNS)Ⅴ级及以上的改良CT Fisher分级,宽颈动脉瘤以及术后肺部感染是介入治疗高分级aSAH预后不良的独立预测因素。因此有关高分级颅内动脉瘤破裂出血介入治疗的预后因素还需要进一步进行研究。基于此,本研究旨在探讨影响高分级颅内动脉瘤破裂出血患者血管内介入手术治疗后预后的相关因素,为此类患者的临床诊治提供相关依据,以改善患者预后,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2013年1月至2017年8月汕头大学医学院第一附属医院收治的高分级aSAH且行血管内介入手术治疗的144例患者的临床资料,根据其预后情况分为预后良好组[改良Rankin评分量表(MRS)[5]评分0~2分,71例]和预后不良组(MRS评分3~6分,73例)。纳入标准:符合《动脉瘤性蛛网膜下腔出血(aSAH)的治疗指南解读(上)》[6]中的相关诊断标准者;所有患者均行数字减影血管造影(DSA)和(或) CT血管造影(CTA)检查,Hunt-Hess分级[7]Ⅳ ~ Ⅴ级,确诊为高分级aSAH者;临床资料完整者等。排除标准:合并其他脑血管病者;已行相关病因治疗,动脉瘤复发者;合并其他全身严重疾病者等。本研究经院内医学伦理委员会审核批准。
1.2 研究方法
1.2.1 观察变量的选取选取年龄(50岁以下、50~60岁,60岁以上)、性别、是否合并颅内血肿、CT Fisher分级[7](2级:发现弥散性出血,尚未形成血块;3级:较厚积血,垂直面上厚度>1 mm或水平面上长×宽>5 mm×3 mm;4级:脑内血肿或脑室内积血,但基底池内无或有少量弥散性出血)、是否吸烟、是否有高血压、是否有糖尿病、是否合并肺部感染、是否合并脑积水、是否合并脑梗死、是否合并癫痫、颅内动脉瘤大小(微小动脉瘤:<5 mm;中型动脉瘤:5~15 mm;大型动脉瘤15~25 mm;巨大型动脉瘤: ≥ 25 mm)、手术时机(出血24 h之内、出血24~72 h、出血3~10 d、出血10 d以上)、颅内动脉瘤部位(前循环、后循环)等14个研究变量。
1.2.2 治疗方法均给予两组患者血管内介入治疗,术前禁饮、禁食6 h,双腹股沟备皮,术前插入导尿管导尿。患者取仰卧位,调整头位在适当位置,固定上肢,双腿稍分开并外展,接监护导联。常规消毒铺巾,穿刺针、动脉鞘、泥鳅导丝、猪尾管用肝素盐水冲洗,J形导丝用肝素盐水浸透。实施麻醉(气管内插管麻醉),一般选择股动脉波动比较明显的一侧进行穿刺,插入导丝,置入动脉鞘,撤出导丝,注射器回抽良好时注入肝素盐水。在心血管成像系统(美国通用电气公司,型号:Innova 3 100)显示下将造影管经腹主动脉、胸主动脉进入颈内动脉及椎动脉系统分别造影(可由右侧向左侧依次造影,也可先做已知病变血管),寻找载瘤动脉。根据动脉瘤大小、瘤颈、形态、位置、与载瘤动脉的关系,制定具体栓塞方案。将微导管头端在微导丝的引导下小心送入动脉瘤腔内,通过微导管置入弹簧圈,当动脉瘤腔内的弹簧圈稳定时,解脱弹簧圈。然后以相同方式置入下一枚弹簧圈,直到把瘤腔塞满。根据术中实际情况,必要时行支架置入或球囊辅助栓塞。术后中和肝素10 min后拔动脉鞘,压迫股动脉15 min,无出血后加压包扎,穿刺点用2 kg沙袋压迫5~6 h,穿刺侧下肢制动24 h,观察足背动脉搏动情况,30 min/次。
1.2.3 预后评定术后对患者至少随访半年,随访方式采用电话、神经外科门诊随访,参照MRS进行预后评分,0分:完全无症状;1分:尽管有症状,但功能无明显障碍,能完成所有日常职责和活动;2分:轻度残疾,病前能从事的活动现在不能完成,但能照顾自己的事务而不需要帮助;3分:中度残疾,需要寻求他人的一些帮助,但无需他人帮助即能独立行走;4分:重度残疾,不能独立行走,自身需要寻求他人帮助;5分:严重残疾,卧床、失禁,需要他人的持续关注和护理;6分:死亡,将0~2分归为预后良好,3~6分归为预后不良[4]。
1.3 观察指标①计算高分级aSAH血管内介入治疗后预后不良的发生率。②对两组患者的一般资料进行单因素分析。③将高aSAH患者预后不良作为因变量,单因素分析中差异有统计学意义的因素作为自变量,通过Logistic回归分析模型筛选出影响高分级aSAH患者血管内介入治疗后预后不良的独立危险因素。
1.4 统计学方法采用SPSS 21.0统计学软件分析数据,计数资料均以[ 例(%)]表示,采用χ2检验,危险因素分析采用多因素Logistic回归分析模型进行统计分析。以P<0.05为差异有统计学意义。
2 结果
2.1 患者预后情况统计根据MRS评分标准,本研究入组的144例患者中,1分34例,2分37例,3分17例,4分23例,5分25例,6分8例;结果显示:预后良好71例,预后良好率为49.31%(71/144),预后不良73例,预后不良率为50.69%(73/144)。
2.2 影响高分级aSAH患者血管内介入治疗后预后不良的单因素分析单因素分析结果显示,预后不良组合并颅内血肿、合并肺部感染、合并脑梗死的患者占比显著高于预后良好组,差异均有统计学意义(均P<0.05),而两组患者年龄、性别、CT Fisher分级、吸烟史、有高血压、有糖尿病、合并脑积水、合并癫痫以及颅内动脉瘤大小、手术时机、颅内动脉瘤部位等资料比较,差异均无统计学意义(均P>0.05),见表1。
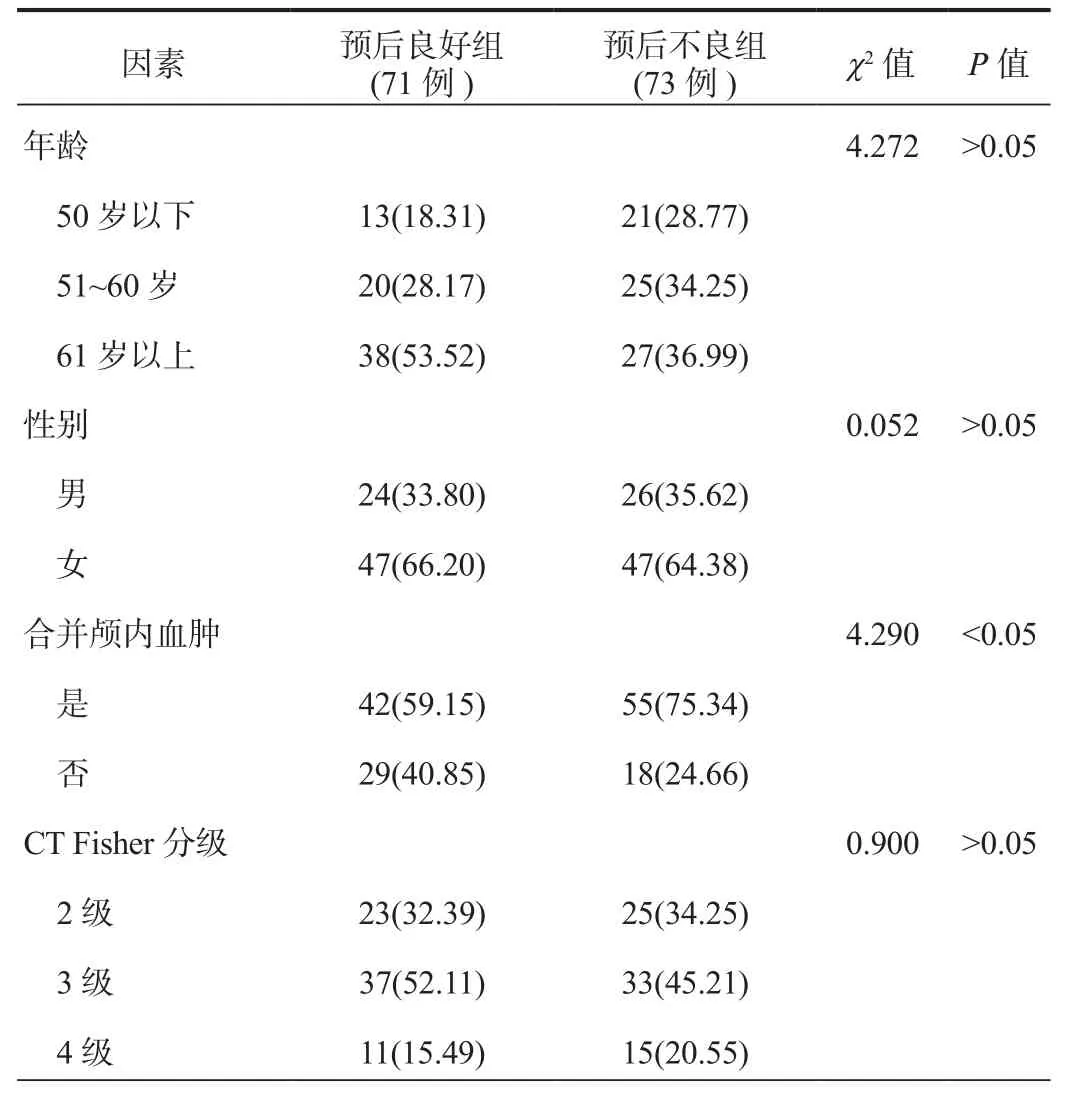
表1 影响高分级aSAH患者血管内介入治疗后预后不良的单因素分析[ 例(%)]
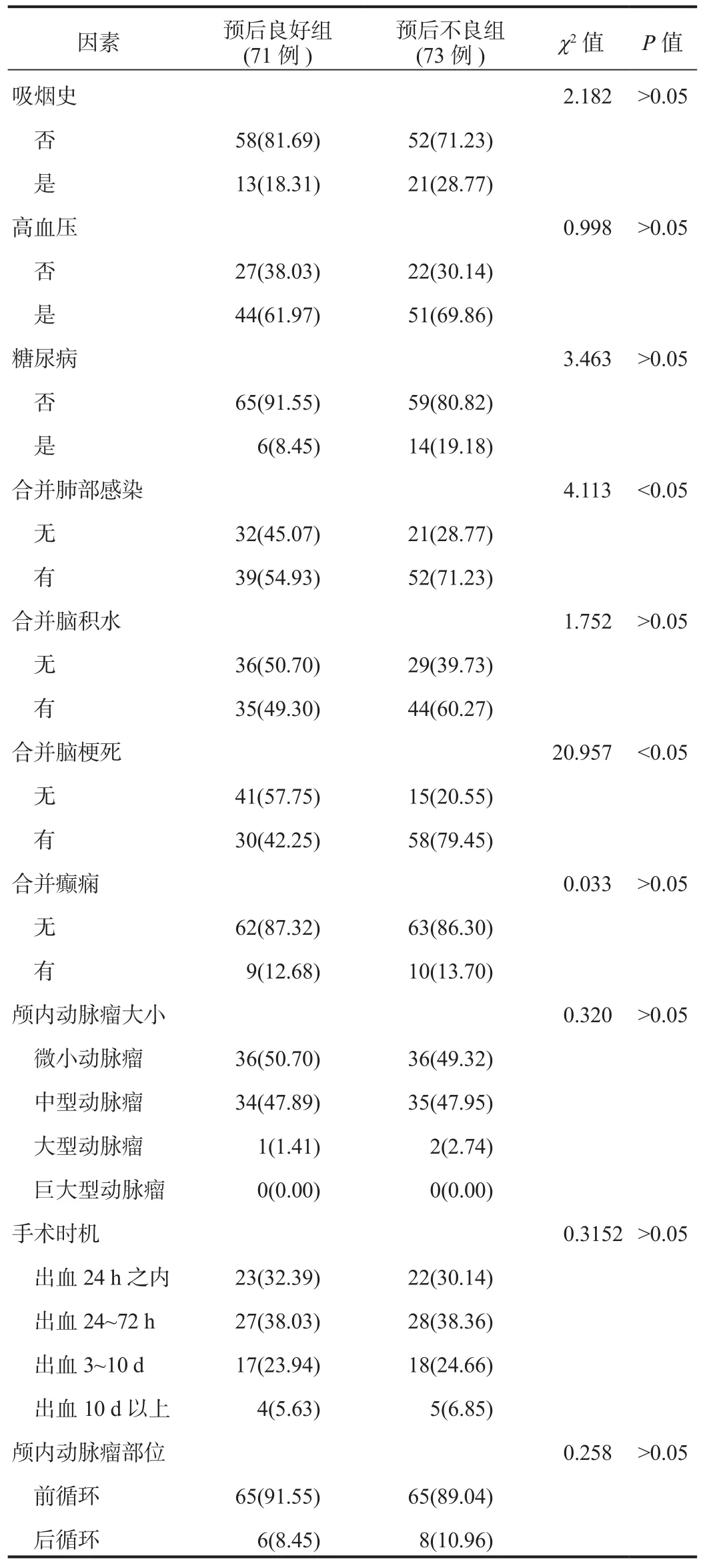
续表1
2.3 影响高分级aSAH患者血管内介入治疗后预后不良的多因素Logistic回归分析多因素Logistic回归分析模型结果显示,合并颅内血肿、合并脑梗死是影响高分级aSAH患者血管内介入预后不良的独立危险因素,差异均有统计学意义(OR= 2.354、2.273,均P<0.05),见表2。

表2 影响高分级aSAH患者血管内介入治疗后预后不良的多因素Logistic回归分析
3 讨论
aSAH是一种急性脑血管疾病,该病能够严重损害患者身体多个器官和中枢性神经系统,高分级aSAH除了对颅内脑组织造成原发性损伤外,还有脑血管的痉挛、继发性脑肿胀、动脉瘤24 h内再破裂出血等造成的继发性损害;此外患者需要长期卧床,中后期并发症加重病情的进展,使高分级aSAH患者致残、死亡率居高不下,较低级别aSAH患者预后更差[8]。本研究结果显示,高级别aSAH血管内介入治疗后预后不良率为50.69%(73/144),表明高级别aSAH经过血管内介入治疗后不良风险仍较高。因此,明确高分级aSAH患者血管内介入治疗后预后不良的危险因素十分关键。
本研究多因素Logistic回归分析结果显示,影响高分级颅内动脉瘤介入治疗预后的独立危险因素为合并颅内血肿、合并脑梗死。分析其原因为,Hunt-Hess分级Ⅳ ~ Ⅴ级的患者往往在入院时合并有颅内血肿,其除了表现出蛛网膜下腔出血本身的临床症状外,还包括脑池血肿、脑室内出血、脑叶血肿等产生的直接占位效应及继发性周围脑水肿;动脉瘤破裂出血后,脑室内血凝块中的血红蛋白将释放大量血红素、铁离子及促炎症细胞因子,从而诱导大量自由基参与形成脑水肿;此外血肿内释放5- 羟色胺,损伤的血管内皮释放的大量内皮素也会加重脑水肿和血管痉挛,引发颅内压增高,继而加深患者意识障碍,促使脑疝形成,增加了患者致残、致死的发生风险[9-10]。对此类患者,在临床诊疗前应对病情做全面分析,通过脑室外引流术、血肿清除等减压术来控制颅内高压,从而改善患者预后。
脑梗死可发生于颅内动脉瘤破裂前期,既脑损伤期,脑组织发生炎症级联反应,使血脑屏障损害、全脑组织缺血、缺氧性坏死,并损伤神经功能,最终导致脑梗死;aSAH患者亦可因病情进展导致脑血管痉挛,引发脑梗死,脑动脉瘤管壁破裂,血液和红细胞降解产物流入蛛网膜下腔,导致脑血管痉挛,从而导致脑血流下降,加重脑组织缺血、缺氧,促进脑梗死形成[11]。Hunt-Hess分级为Ⅳ ~ Ⅴ级的患者大多数病情危重,昏迷,其神经功能缺损程度因合并脑梗死而加重,且合并肺部感染、褥疮、下肢静脉血栓形成等合并症概率进一步增高,增加患者预后不良的风险[12]。因此,对于高级别aSAH患者,应及时应用升压、扩容、使用钙通道阻滞剂、多巴胺、甲肾上腺素等药物有效地扩张脑血管,提高患者脑血流量,解除脑血管痉挛,改善患者预后。
出血性脑卒中患者病情凶险,中枢神经严重缺损,使得神经体液调节功能减弱,更易引发因神经性肺水肿而导致的肺部感染。蛛网膜下腔出血属于出血性卒中的一类疾病,患者往往因长期卧床而发生坠积性肺炎,而伴有呕吐、意识障碍等患者容易因误吸而发生吸入性肺炎,从而延长患者住院时间,医疗成本更高。肺部感染容易加重卒中患者脑缺血、缺氧,导致脑水肿和神经细胞死亡,进一步加重神经功能缺损[13]。有研究表示,合并肺部感染是影响高分级颅内动脉瘤破裂出血患者预后不良的危险因素[14]。但本研究多因素Logistic回归分析结果显示,合并肺部感染并不是影响预后的独立危险因素,考虑本研究入组高分级颅内动脉瘤患者例数相对较少,可能因样本量偏少而造成统计结果有偏差,在以后研究可以增加样本量进一步研究介入治疗高分级颅内动脉瘤破裂出血患者与肺部感染的关系。
手术时机是高分级aSAH患者治疗的主要争论点,既往研究认为,高分级aSAH急性期患者颅内高压、脑水肿、生命体征不稳定,且手术可造成二次创伤,不合适进行超早期或早期手术治疗,因此临床多选择在药物保守治疗并ICU治疗一段时间后,根据患者的病情情况进行手术干预[15-16]。另一方面,高分级aSAH患者发生动脉瘤早期再破裂出血的概率明显高于低分级患者,且二次出血后预后更差。本研究结果显示,手术时机不是高分级aSAH患者血管内介入预后不良的独立危险因素。因此本研究认为,对于高分级aSAH患者,可在超早期积极进行手术干预,不仅能够避免动脉瘤再次破裂,减少再出血风险,还能够及时清除蛛网膜下腔血肿、降低颅内压,从而改善患者预后。
综上,合并颅内血肿、合并脑梗死是高分级aSAH患者血管内介入手术治疗后预后不良的独立危险因素,临床应针对以上因素采取相应的防治措施。但本研究仍存在一定不足之处,选取的病例数相对较少,未来仍有待进行大样本量研究进一步验证,力求取得更加全面、可靠的科学结论。
