地西他滨联合CAG方案治疗中高危骨髓增生异常综合征的效果观察
2022-08-11方敏
方 敏
黑龙江省佳木斯市中心医院血液内科 154002
骨髓增生异常综合征(MDS)是常见的造血系统肿瘤性疾病,其特点包括髓系细胞发育异常、造血功能衰竭、无效造血、难治性血细胞减少等,30%~40%可转化为急性髓系白血病(AML)[1]。MDS以老年患者居多,当前尚缺乏标准治疗方案,主要采用异基因造血干细胞移植(allo-HSCT)、化疗以及去甲基化治疗等[2]。其中,allo-HSCT是当前唯一可根治MDS的手段,但老年人由于生理机能衰退、免疫力减弱等影响难以承受allo-HSCT。阿糖胞苷(Ara-C,C)+阿克拉霉素(Acla,A)+重组人粒细胞刺激因子(G-CSF,G)即CAG化疗方案是当前常用的化疗手段,但单一的CAG化疗方案预后并不满意。地西他滨(DAC)可通过封闭DNA甲基转移酶,阻滞细胞周期而促进肿瘤细胞凋亡。研究发现,乳酸脱氢酶(LDH)、β2微球蛋白(β2-MG)、铁蛋白(SF)与MDS的国际预后评分系统(IPSS)危险分层、死亡风险相关,可用于辅助评估治疗效果及预后[3]。本文探讨了D-CAG化疗方案治疗中高危MDS的效果及对患者血清LDH、β2-MG、SF水平的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2019年4月—2021年4月本院收治的84例中高危MDS患者作为观察对象。纳入标准:经血常规、血生化、骨髓细胞学、免疫表型、染色体核型等检查确诊,且诊断符合《骨髓增生异常综合征中国诊断与治疗指南(2019年版)》[4]标准。排除标准:合并有白血病、再生障碍性贫血等可引起病态造血或血细胞减少的原发疾病者;合并感染与出血者;合并其他造血与免疫系统疾病、重要脏器功能异常及精神病患者。采用随机数字表法将患者分为两组,各42例。对照组:男27例,女15例;年龄65~84岁,平均年龄(74.01±6.27)岁;IPSS危险分层:中危19例,高危23例。观察组:男29例,女13例;年龄62~83岁,平均年龄(73.87±6.28)岁;IPSS危险分层:中危18例,高危24例。两组一般资料比较,差异无统计学意义(P>0.05),有可比性。
1.2 方法 对照组给予CAG化疗方案:Ara-C(哈尔滨莱博通药业有限公司,国药准字H23021806,50mg)10mg/m2,1次/12h ,第1~14天时皮下注射;Acla(江苏联环药业股份有限公司,国药准字H10920075,20mg)20mg/d,第1、3、5天时静脉滴注;G-CSF(科兴生物制药股份有限公司,国药准字S20010016,150μg)300μg/d,第1~7天时皮下注射。观察组在CAG方案的基础上于化疗第1~5天给予DAC(山东新时代药业有限公司,国药准字H20173051,10mg)15mg/(m2·d),连续静脉滴注3h以上。以28d为1个疗程,两组均治疗2个疗程。
1.3 观察指标 (1)疗效评定:完全缓解(CR):骨髓原始细胞≤5%,且所有细胞系成熟正常,维持≥4周;骨髓完全缓解(mCR):骨髓原始细胞≤5%,且减少≥50%;部分缓解(PR):骨髓原始细胞减少≥50%,但仍>5%,且维持≥4周;血液学进步(HI):血液改善,但未达PR标准;疾病稳定(SD):未达到PR的标准但至少8周以上无疾病进展证据;疾病进展(PD):转化为AML[4]。总反应率(ORR)=(CR+mCR+PR+HI)例数/总例数×100%。(2)记录两组治疗期间不良反应发生率。(3)血清细胞因子检测:治疗前后,取两组静脉血4ml,以3 000r/min 离心10min,离心半径6cm,取血清,以酶联免疫吸附法(ELISA)检测白细胞(IL)-4、IL-10、γ干扰素(IFN-γ)水平。(4)血清LDH、β2-MG、SF水平检测:以“(3)”中方法制备血清,以ELISA检测LDH、β2-MG、SF水平。
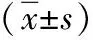
2 结果
2.1 两组疗效比较 观察组ORR为83.33%,高于对照组的61.90%(χ2=4.792,P=0.029<0.05),见表1。

表1 两组疗效比较[n(%)]
2.2 两组不良反应比较 两组不良反应总发生率比较差异无统计学意义(χ2=0.436,P=0.509>0.05),见表2。

表2 两组不良反应比较[n(%)]
2.3 两组血清细胞因子比较 治疗后,两组血清IL-4、IL-10、IFN-γ水平均较治疗前降低,且观察组均低于对照组(P<0.05),见表3。
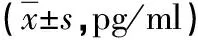
表3 两组血清细胞因子比较
2.4 两组血清LDH、β2-MG、SF水平比较 治疗后,两组血清LDH、β2-MG、SF水平均较治疗前降低,且观察组均低于对照组(P<0.05),见表4。
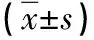
表4 两组血清LDH、β2-MG、SF水平比较
3 讨论
MDS是一种异质性髓系克隆性疾病,常以慢性进行性贫血症状如脸色苍白、气短、乏力等为表现,随着疾病进展,一旦出现血小板或粒细胞严重减少,则可导致反复发热、感染、出血等症状,并可向AML转化[5]。CAG化疗方案为当前MDS的常用化疗手段,其中Ara-C主要作用于增殖旺盛的细胞,特别是S期细胞,可抑制DNA聚合酶的活性,以此阻止DNA合成,并促进癌细胞凋亡;Acla可影响DNA、RNA、蛋白质合成,并可在G1晚期、S晚期阻滞细胞周期而促进癌细胞凋亡;G-CSF可提升化疗药物的抗肿瘤效应,且可刺激粒、单核巨噬细胞成熟并向外周血释放[6]。但单一CAG化疗方案的整体预后仍欠佳。
DAC为天然2’-脱氧胞苷酸的腺苷类似物,可抑制DNA甲基化转移酶,减少DNA的甲基化,抑制肿瘤细胞增殖;同时,可激活沉默肿瘤抑癌基因,增强分化基因等调控基因的表达,从而阻止恶性细胞增生,并促进肿瘤细胞凋亡[7]。本文中,观察组ORR高于对照组,且两组不良反应总发生率比较无显著差异,与单坤生等[8]的文献报道一致,表明D-CAG化疗方案可提升中高危MDS的治疗效果,且并未增加不良反应。原因是DAC联合CAG方案具有协同增效作用,且DAC可增强CAG方案中Ara-C的细胞毒作用,进一步提升抗肿瘤效应[9]。
研究发现,MDS患者的骨髓造血微环境常呈免疫抑制状态,造成造血细胞异常克隆增多,从而加速疾病进展[10]。IL-4是Th2细胞因子,可促进肿瘤增殖和存活,同时可诱导T细胞无反应性或其介导的细胞毒性丧失,以促进肿瘤与疾病进展。IL-10是调节性B细胞(Breg)因子,属于抑制性细胞因子,可产生免疫抑制效应,有效抑制CD4+T细胞,从而促进肿瘤转移。IFN-γ是由M1型巨噬细胞分泌的细胞因子,发挥促肿瘤作用。本文中,治疗后,观察组血清IL-4、IL-10、IFN-γ均低于对照组,提示D-CAG化疗方案可下调IL-4、IL-10、IFN-γ过表达,纠正免疫紊乱。原因是DAC可促使CD4+T细胞分化为CD4+调节性T细胞,促进稳定的调节性T细胞系的形成,从而能够减轻对细胞免疫的抑制,纠正免疫紊乱,有效调控细胞因子分泌,增强机体抗肿瘤作用[11]。
LDH是一种糖酵解酶,通常在机体损伤或者代谢紊乱时分泌,在恶性肿瘤细胞中呈高表达。β2-MG是一种球蛋白,通常在恶性肿瘤细胞或者炎症应激状态时异常表达,参与MDS恶性克隆增殖的调控。SF是一种可溶性铁蛋白,过高的铁负荷会增加毒性活性氧,造成造血干细胞衰老、死亡。陈春平等[12]的研究证实,LDH、β2-MG、SF在MDS患者血清中呈高表达,且随IPSS评分等级增加呈上升趋势,同时,SF水平是影响MDS患者死亡的独立危险因素。本文中,治疗后观察组血清IL-4、IL-10、IFN-γ水平均低于对照组,提示D-CAG化疗方案可改善MDS患者预后。
综上所述,D-CAG化疗方案可提升中高危MDS患者的治疗效果,改善预后,其机制可能与下调IL-4、IL-10、IFN-γ过表达有关。
