大鼠急性肾损伤模型中15种新型尿液生物标志物的评价研究
2022-08-11朱思睿屈哲杨艳伟刘鑫磊黄芝瑛周晓冰李波
朱思睿,屈哲,杨艳伟,刘鑫磊,黄芝瑛,周晓冰,李波
·论著·
大鼠急性肾损伤模型中15种新型尿液生物标志物的评价研究
朱思睿,屈哲,杨艳伟,刘鑫磊,黄芝瑛,周晓冰,李波
100176 北京,中国食品药品检定研究院国家药物安全评价监测中心,药物非临床安全评价研究北京市重点实验室(朱思睿、屈哲、杨艳伟、刘鑫磊、周晓冰、李波);510006 广州,中山大学药学院(朱思睿、黄芝瑛)
评价短期采尿下 15 种新型尿液生物标志物对药物肾毒性的诊断效能。Wistar 大鼠连续腹腔注射 120 mg/kg 庆大霉素构建急性肾损伤(AKI)模型。分别在检疫期、给药第 5、8 天采集动物 5 h 尿液和血样,并解剖动物,进行肾脏病理学检查。全自动生化分析仪检测各组动物的血清和尿生化。应用 Luminex 液相芯片方法检测分析尿液生物标志物浓度,与传统肾功能指标尿素氮(BUN)和肌酐(CRE)进行比较。组织病理学结果显示,给药动物出现典型急性肾损伤变化,并呈明显时间相关性;与对照组比较,干扰素诱导蛋白-10(IP-10)和 β2-微球蛋白(β2-MG)在给药第 5 天就显著升高,且持续增加。在给药第 8 天,除表皮生长因子(EGF)、骨桥蛋白(OPN)两种生物标志物以外,尿液中其他 8 种生物标志物浓度均明显升高(< 0.01)。而 BUN 和 CRE 也在给药第 8 天出现显著升高(< 0.05),受试者工作特性曲线(ROC)表明,白蛋白(ALB)、尿蛋白(uTP)、肾损伤因子-1(KIM-1)、IP-10、β2-MG、中性粒细胞明胶酶相关脂质运载蛋白(NGAL)、丛生蛋白(CLU)、半胱氨酸蛋白酶抑制剂-C(CysC)和酸性糖蛋白(AGP)的曲线下面积明显优于 BUN 和 CRE。证实 ALB、uTP、KIM-1、IP-10、β2-MG、NGAL 对药物致急性肾毒性早期诊断效能优于 BUN 和 CRE,这些候选生物标志物在药物的大鼠临床前安全性研究中将具有良好的应用前景。
肾毒性; 生物标志物; 急性肾损伤; 庆大霉素; 临床前安全性评价
肾脏由于其特殊结构和功能,是药物引起毒性的主要靶器官之一。药物诱导急性肾损伤是新药研发过程中最常见的问题[1]。作为药物研发全过程、临床和上市后安全性监测研究的评价指标和工具,生物标志物可客观测量与评价正常生物过程、病理过程或对药物干预反应的指示物[2-3]。传统的肾毒性标志物血清尿素氮(BUN)和肌酐(CRE)已被广泛应用,但诊断灵敏度较差,且肾损伤较严重时才表现明显升高,往往不能在肾损伤的早期及时作出诊断[4-5]。因此,亟待出现灵敏度高、特异性强、甚至无创的新的生物标志物予以补充。
在过去二十年,随着生物技术的发展和应用,新的蛋白和核酸类肾毒性生物标志物不断被发现。为了进一步研究新型尿液生物标志物在预测药物的肾脏毒性中的灵敏度和特异性[5-6]。本研究应用庆大霉素诱导 Wistar 大鼠急性肾损伤模型,与传统生物标志物 BUN 和 CRE 比较,系统评价近些年报道 15 种新型尿液生物标志物,包括尿葡萄糖苷酶(NAG)、尿蛋白(uTP)、丛生蛋白(CLU)、谷胱甘肽 S 转移酶-α(GST-α)、IP-10、肾损伤因子-1(KIM-1)、骨桥蛋白(OPN)、组织金属蛋白酶抑制剂-1(TIMP-1)、血管内皮生长因子-A(VEGF-A)、酸性糖蛋白(AGP)、白蛋白(ALB)、β2-MG、半胱氨酸蛋白酶抑制剂-C(CysC)、表皮生长因子(EGF)、中性粒细胞明胶酶相关脂质运载蛋白(NGAL)的诊断效能,以期为后续应用研究提供更多参考信息。
1 材料与方法
1.1 材料
1.1.1 药物及主要试剂 庆大霉素购自美国 Sigma-Aldrich 公司;Luminex 液相芯片大鼠肾毒性试剂盒购自美国 Merck Millipore 公司。
1.1.2 仪器 7180型全自动生化分析仪购自日本 Hitachi公司;Magpix 型液相芯片分析平台购自美国 Luminex 公司。
1.1.3 动物及饲养条件 体重为 230 ~ 270 g 的雄性 SPF/VAF 级 8 周龄Wistar 大鼠购自北京维通利华实验动物技术有限公司。实验动物饲养于屏障环境,温度:20 ~ 26 ℃,日温差< 3 ℃,相对湿度:40% ~ 70%,最小换气次数 15 次/h,12 h/12 h 明暗周期,自由摄食饮水。本试验方案及操作均经过动物福利伦理委员会(IACUC)审查批准。
1.2 方法
1.2.1 庆大霉素诱导急性肾损伤大鼠模型的构建 将 32 只雄性 Wistar 大鼠入室后检疫驯化,合格后,根据最新体重将动物随机均分为对照组和庆大霉素给药组,每组 16 只。庆大霉素给药组每天按 120 mg/kg 剂量腹腔注射给药 1 次,连续7 次,给药体积为 5 ml/kg;对照组给予生理盐水5 ml/kg。
1.2.2 生物样本的采集 分别在检疫期、给药第 5、8 天采集尿液;每次每组采集 8 只动物尿液,每天定时在 8:00 – 13:00 收集尿液。1000 ×、4 ℃条件离心 5 min,分装保存在–80 ℃备用。随后在同一天对每组已采集尿液 8 只大鼠腹腔注射舒泰进行麻醉(麻醉剂量为 50 mg/kg),然后从腹腔后大静脉进行采血,1800 ×离心 10 min,分离血清进行后续血清生化学等检测;解剖动物,收集肾脏进行病理学检查。
1.2.3 组织病理学评分 取左、右肾脏,固定后的肾脏组织经修块取材,逐级酒精脱水,石蜡包埋,滑动切片机切片(厚约 3 μm),经苏木素-伊红(HE)染色,光镜下进行检查。组织病理学评估分级(0 ~ 4级),标准参照文献[7],包括无(−)、极轻度(+)、轻度(++)、中度(+++)和重度(++++)。
1.2.4 血清和尿生化检测分析 全自动生化分析仪检测血清、尿生化。指标包括丙氨酸氨基转换酶(ALT)、天门冬氨酸氨酸转换酶(AST)、总胆红素(TBIL)、CRE、BUN、NAG、uTP、尿肌酐(uCr)。
1.2.5 Luminex 液相芯片检测尿液生物标志物分析 按照试剂盒说明书操作,应用 Luminex 液相芯片检测各种生物标志物含量,包括 CLU、GST-α、IP-10、KIM-1、OPN、TIMP-1、VEGF-A、AGP、ALB、β2-MG、CysC、EGF 和 NGAL。
1.3 统计学处理
2 结果
2.1 AKI 模型建立与病理损伤
根据血生化结果(表 1),在该给药条件下,各组 AST、ALT、TBIL 值无统计学差异,且解剖大体检查并未发现除肾脏以外其他组织器官病变,排除其他组织器官病变对肾生物标志物变化的影响。
2.2 肾脏组织病理学检查结果
肾脏组织病理学分析结果显示,Wistar 大鼠在接受庆大霉素连续给药后出现的明显肾脏损伤的组织病理学改变,主要包括肾皮质肾小管上皮细胞变性/坏死,间质炎性细胞浸润(图 1),且随给药时间的增加,给药组动物出现该病变的动物数增加,病变程度也随之加重(表 1),在对照组动物中偶见肾小管上皮细胞变性、再生等病变。
表1 Wistar 大鼠肾脏组织病理学检查结果(n = 8)
Table 1 Renal histopathological findings in Wistar rats(n = 8)
肾脏组织病变Renal histopathological findings第5 天给药(mg/kg)Dosing on day 5 (mg/kg) 第8 天给药(mg/kg)Dosing on day 8 (mg/kg) 0 120 0120 肾小管变性/再生 Renal tubule degeneration/regeneration+(1/8)+(1/8) +(4/8)- 肾小管上皮细胞和皮层变性、坏死Renal tubular epithelial cell and cortex degeneration/necrosis-++(2/8) -+(2/8) ++(1/8) +++(5/8) 间质炎性细胞浸润 Inflammatory cell infiltration, interstitium+(1/8)+(1/8) -+(6/8) 慢性进行性肾病 Chronic progressive nephropathy-++(1/8) -+(1/8) 蛋白管型 Protein cast++(1/8)- ++(1/8)++(1/8) 肾盂扩张 Renal pelvis dilation-++(1/8) -- 纤维化 Fibrosis-- ++(1/8)-

图1 Wistar 大鼠连续腹腔注射庆大霉素的肾脏组织病理学结果(HE 200 ×)(A:正常肾脏;B:给药组第5 天动物肾脏,轻度皮质肾小管上皮细胞变性/坏死;C:给药组第8 天动物肾脏,中度皮质肾小管上皮细胞变性/坏死,极轻度间质炎性细胞浸润)
Figure 1 Renal histopathological examination results in Wistar rats following continuous intraperitoneal injection with gentamicin (HE 200 ×) (A: Normal kidney; B: Mild cortical renal tubular epithelial cells degeneration/necrosis in kidney of animals after administration on 5 days; C: Moderate cortex renal tubular epithelial cells degeneration and/or necrosis, extremely mild interstitial inflammatory cell infiltration in kidney of animals after administration on 8 days)
表2 Wistar 大鼠连续腹腔注射庆大霉素对血清 ALT、AST 和 TBIL 的影响(n = 8)
Table 2 The effect of serum ALT, AST and TBIL in Wistar rats following continuous intraperitoneal injection with gentamicin (n = 8)
给药时间 Day给药剂量(mg/kg) Dose (mg/kg)ALT(U/L)AST(U/L)TBIL(μmol/L) 第 5 天 Day 5 034.38 ± 1.90102.75 ± 3.321.90 ± 0.12 12039.13 ± 2.45 91.38 ± 4.802.07 ± 0.08 第 8 天 Day 8 031.50 ± 1.17 82.50 ± 2.812.26 ± 0.07 12041.88 ± 2.21103.00 ± 6.782.25 ± 0.09
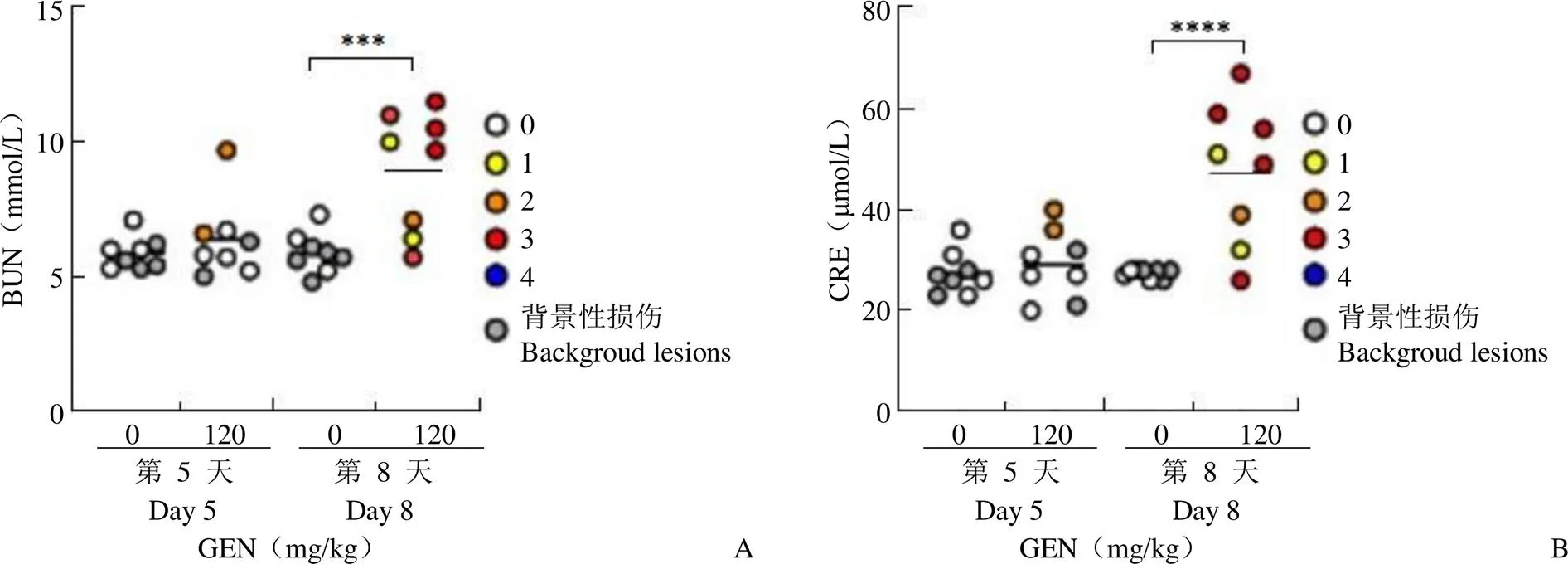
图2 Wistar 大鼠连续腹腔注射庆大霉素后血清BUN(A)和CRE(B)的变化(各组平均值用黑线表示;不同颜色标记给药后动物剖检的组织病理学损伤级别;与对照组比较,***P < 0.001;****P < 0.0001)
Figure 2 Change of serum BUN (A) and CRE (B) in Wistar rats following continuous intraperitoneal injection with gentamicin (The mean values of each group are represented by black lines. Different colors were used to mark the level of histopathological injury in animal autopsy. Comparison with control group,***< 0.001;****< 0.0001)
2.3 血清肝、肾生物标志物的变化
Wistar 大鼠连续 7 d 腹腔注射庆大霉素,与未给药的对照组动物比较,给药第 5 和第 8 天血清中 ALT、AST 和 TBIL 水平均未见明显升高(表 2)。
分析结果显示传统标志物(BUN、CRE)在第 5 天出现病理损伤时未出现显著性升高变化,仅在给药后第 8 天出现显著性上升,且个体差异较大,第 8 天的 BUN 表达水平均值较基线升高了大约 1.5 倍,CRE 升高了近 2 倍(图 2)。
2.4 尿液中新型生物标记物分析结果
尿液中生物标志物检测结果显示,IP-10 和β2-MG 在给药第 5 天的时候就出现了具有统计学意义的显著性升高,并且持续增加,表现出显著性的时间相关性。在给药第 8 天,具有肾损伤病变的动物绝大多数均出现了明显的 IP-10 和 β2-MG 升高。此外,除 EGF、OPN 两种生物标志物以外,在给药第 8 天,尿液中 ALB、uTP、KIM-1、NGAL、CLU、CysC、AGP、NAG 浓度均明显升高,与对照组比较具有显著性差异(< 0.0001)(图 3)。
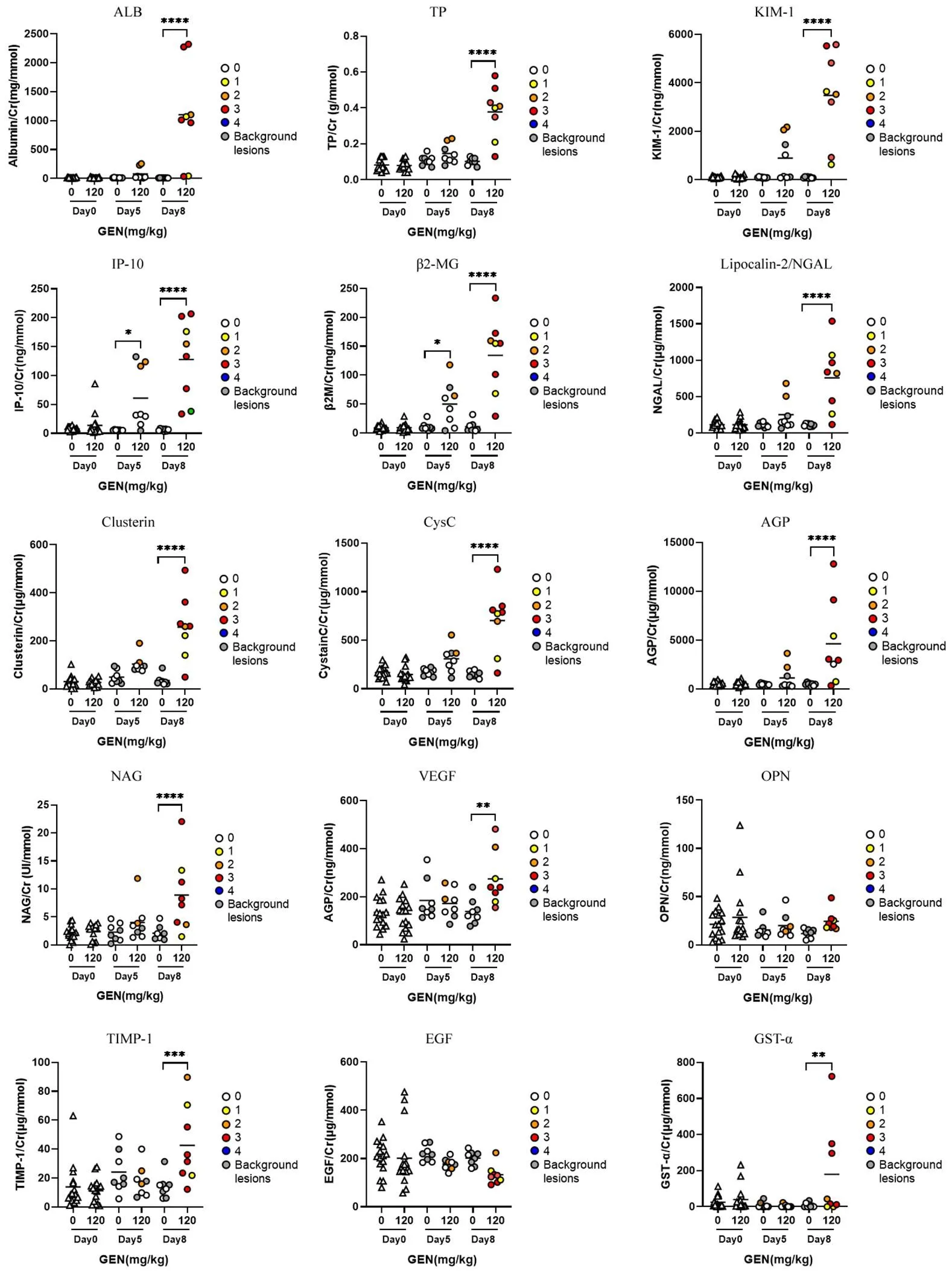
图3 Wistar 大鼠连续腹腔注射庆大霉素后尿液中生物标志物的水平变化[给药前(Day 0)每只大鼠的数据以三角形(△)表示(n = 16),给药后以圆形(○)表示(n = 8),各组平均值用黑线表示;不同颜色标记给药后动物剖检的组织病理学损伤级别;与对照组比较,*P < 0.05;**P < 0.01;***P < 0.001;****P < 0.0001]
Figure 3 Change of urinal biomarkers in Wistar rats following continuous intraperitoneal injection with gentamicin [Before administration (Day 0), the data of each rat was represented by triangle (△) (n = 16), after administration by circle (○) (n = 8), and the mean value of each grouprepresented by black line. Different colors were used to mark the level of histopathological injury in animal autopsy. Compared with the control group,*< 0.05;**< 0.01;***< 0.001;****< 0.0001]
2.5 ROC 分析
纳入不同病变程度的各组生物标志物的结果进行综合判断,ROC 分析用于评估本研究中新的生物标志物的准确性和敏感性,并对各生物标志物间的进行统计分析(图 4)。分析结果显示绝大多数生物标志(ALB、uTP、KIM-1、IP-10、β2-MG、NGAL、CLU、CysC、AGP、CRE、BUN)在此条件下都具有较好的准确性(≥ 0.9),其中 ALB、uTP、KIM-1、IP-10、β2-MG、NGAL 的敏感性和特异性均优于两个传统标志物(= 0.995、0.984、0.982、0.977、0.973、0.964 vs. BUN 和 CRE)。在 Spearman 相关分析结果中,除了 GST-α,其余所有生物标志物的表达水平与肾损伤程度均有统计学意义的相关性(< 0.0001)。
3 讨论
药物开发过程中出现严重的 AKI 为新药研发失败最常见原因,为药物研发带来巨大的损失[6, 8],因此,使用灵敏好、特异性强、无创的生物标志物能为药物临床前研究和评价提供更多宝贵的肾毒性信息。考虑到不同药物引起的肾毒性机制不同、病理损伤程度不同,为了综合考量新的生物标志物的广泛应用的潜力以及特异性,本研究利用经典肾毒性阳性药物庆大霉素造模评价了一系列新的肾毒性生物标志物在大鼠中的表达特性和应用价值,包括功能变化指标(ALB、β2-MG 和 CysC 等),直接反应损伤的指标(KIM-1、NGAL 和 OPN 等),以及由损伤细胞释放的标志物(NAG 等)[9-10],并与传统的血液生物标志物(CRE、BUN)进行对比分析。
组织病理结果显示庆大霉素导致的肾损伤开始(给药第 5 天)主要作用部位在肾小管皮质,出现上皮细胞的变形和坏死,在给药第 8 天会发展到间质,产生炎性细胞浸润。不同的生物标志物在不同的损伤时期的表达程度不一样。在庆大霉素引起的早期肾损伤中,表现最好的生物标志物是 IP-10,这是由 IFN-γ 诱导产生的一个分子量为10 kD 的 Th1 型促炎趋化因子,通过与受体 CXCR3 作用,可以发挥多种生物学功能,与病毒感染所致的炎症和免疫状态有关,血液中的 IP-10 水平是评估抗病毒治疗效果的生物标志物[11],近期也发现尿液中的IP-10 水平依旧能发挥灵敏的指示作用,且非侵入操作,不仅更易获得,对采集对象更加友好,更降低生物工作者的生物暴露风险[12-13],此外,还发现尿液 IP-10 表达水平在肾脏医学领域有着重要意义,目前作为急性排斥反应的早期生物标志物广泛用于肾移植临床操作中[13-14]。也有研究提示 IP-10 可作为狼疮性肾炎的生物标志物,用于临床的早期诊断,评估疾病严重程度和预测疾病结果[15-16]。但目前暂时仍未有 IP-10 在药物致急性肾损伤领域的研究和应用的报道,科研价值较大。

图4 生物标志物 ROC 分析
Figure 4 ROC analysis of biomarkers
此外,在庆大霉素引起的早期肾损伤中,我们的研究表明 ALB 的优势最为明显,跟我们前期犬的庆大霉素致急性肾损伤的结果一致[4]。ALB 是一种高分子量蛋白质,在近端小管中被重吸收,因此在正常情况下尿液中几乎检测不到,因此ALB 能作为提示肾小球损伤的指标。到目前为止有来自不同动物种属的多项研究报告ALB 是肾小球损伤的最佳指示物[17-20],且表现优于传统的生物标志物 BUN 和 CRE[19]。美国食品药品监督管理局和欧洲药品管理局已批准ALB 用于药物的临床和临床前安全性评价中[21]。
同时,本研究还发现尿液 KIM-1、NGAL 和 β2-MG 优于传统生物标志物。除了刚刚提到 IP-10 在药物致 AKI 领域仍待研究外,KIM-1 和 NGAL 已在临床上被广泛用于AKI 的早期诊断指标,可以指示近端小管功能障碍和肾小球损伤[22],其中尿 NGAL 水平已被建议作为区分临床与亚临床 AKI 患者的一种手段[23],最快可在 2 h 内检测到 AKI[24]。值得注意的是,血清中的 NGAL 不具有 AKI 的诊断价值[25]。此外,还发现尿液 AGP 具有一定肾毒性诊断效能,值为 0.913。该活性分子属于脂质运载蛋白家族,是一种主要存在于血浆中的急性期蛋白,在许多不同的疾病中会发生变化,因此它具有很大的诊断和预后潜力。比如其血清表达水平在临床上用于评估脓毒症的严重程度[26],其尿液表达水平也常用于临床诊断早期糖尿病肾病和慢性肾病预后发展[27-28],尽管有大量关于 AGP 的文献,尚未有用于药物致 AKI 的临床报道,但该蛋白质的生理功能仍有待阐明[29],具有较大的研究价值。
尿液与其他生物体液相比具有独特优势,可以很容易和非侵入性地获得,并且由于肾小管重吸收使之蛋白质含量低[30],提高了蛋白质组分析和标志物检测的效率,使其成为发现生物标志物的更好选择[31]。此外,在早期肾损伤阶段,短时间采尿可用尿肌酐校正,并且包括尿肌酐在内的各生物标志物的水平周期波动不影响病理损伤诊断结果。短时间采尿操作更为便捷,对动物机体影响小,更符合动物福利。本研究的结果进一步支持短时间采尿样可用于生物标志物检测[32-33]。
综上所述,本研究通过分析庆大霉素诱导 AKI 模型中采集的 5 h 尿样,证实 ALB、uTP、KIM-1、IP-10、β2-MG 和 NGAL 对药物致急性肾毒性早期诊断效能优于传统生物标志物 BUN 和 CRE,具有较大临床前应用潜力,这些研究结果为后续应用研究提供更多参考信息。
[1] Hoste EAJ, Kellum JA, Selby NM, et al. Global epidemiology and outcomes of acute kidney injury. Nat Rev Nephrol, 2018, 14(10):607- 625.
[2] Schrezenmeier EV, Barasch J, Budde K, et al. Biomarkers in acute kidney injury - pathophysiological basis and clinical performance. Acta Physiol (Oxf), 2017, 219(3):554-572.
[3] Srisawat N, Kellum JA. The role of biomarkers in acute kidney injury. Crit Care Clin, 2020, 36(1):125-140.
[4] Sun B, Zhou X, Qu Z, et al. Urinary biomarker evaluation for early detection of gentamycin-induced acute kidney injury. Toxicol Lett, 2019, 300:73-80.
[5] Han WK, Waikar SS, Johnson A, et al. Urinary biomarkers in the early diagnosis of acute kidney injury. Kidney Int, 2008, 73(7):863-869.
[6] Oh DJ. A long journey for acute kidney injury biomarkers. Ren Fail, 2020, 42(1):154-165.
[7] Duarte CG, Zhang J, Ellis S. The SHR as a small animal model for radiocontrast renal failure. relation of nephrotoxicity to animal’s age, gender, strain, and dose of radiocontrast. Ren Fail, 1997, 19(6):723- 743.
[8] Loghman-adham M, Kiu Weber CI, Ciorciaro C, et al. Detection and management of nephrotoxicity during drug development. Expert Opin Drug Saf, 2012, 11(4):581-596.
[9] Kashani K, Cheungpasitporn W, Ronco C. Biomarkers of acute kidney injury: the pathway from discovery to clinical adoption. Clin Chem Lab Med, 2017, 55(8):1074-1089.
[10] Bonventre JV, Vaidya VS, Schmouder R, et al. Next-generation biomarkers for detecting kidney toxicity. Nat Biotechnol, 2010, 28(5): 436-440.
[11] García-basteiro AL, Mambuque E, den Hertog A, et al. IP-10 kinetics in the first week of therapy are strongly associated with bacteriological confirmation of Tuberculosis diagnosis in HIV-Infected Patients. Sci Rep, 2017, 7(1):14302.
[12] Petrone L, Bondet V, Vanini V, et al. First description of agonist and antagonist IP-10 in urine of patients with active TB. Int J Infect Dis, 2019, 78:15-21.
[13] Petrone L, Chiacchio T, Vanini V, et al. High urine IP-10 levels associate with chronic HCV infection. J Infect, 2014, 68(6):591-600.
[14] Matz M, Beyer J, Wunsch D, et al. Early post-transplant urinary IP-10 expression after kidney transplantation is predictive of short- and long-term graft function. Kidney Int, 2006, 69(9):1683-1690.
[15] Tatapudi RR, Muthukumar T, Dadhania D, et al. Noninvasive detection of renal allograft inflammation by measurements of mRNA for IP-10 and CXCR3 in urine. Kidney Int, 2004, 65(6):2390-2397.
[16] El-Gohary A, Hegazy A, Abbas M, et al. Serum and urinary interferon-gamma-inducible protein 10 in lupus nephritis. J Clin Lab Anal, 2016, 30(6):1135-1138.
[17] Tonomura Y, Tsuchiya N, Torii M, et al. Evaluation of the usefulness of urinary biomarkers for nephrotoxicity in rats. Toxicology, 2010, 273(1-3):53-59.
[18] Uchino H, Fujishima J, Fukuoka K, et al. Usefulness of urinary biomarkers for nephrotoxicity in cynomolgus monkeys treated with gentamicin, cisplatin, and puromycin aminonucleoside. J Toxicol Sci, 2017, 42(5):629-640.
[19] Gu YZ, Vlasakova K, Troth SP, et al. Performance assessment of new urinary translational safety biomarkers of drug-induced renal tubular injury in Tenofovir-treated cynomolgus monkeys and beagle dogs. Toxicol Pathol, 2018, 46(5):553-563.
[20] Vlasakova K, Erdos Z, Troth SP, et al. Evaluation of the relative performance of 12 urinary biomarkers for renal safety across 22 rat sensitivity and specificity studies. Toxicol Sci, 2014, 138(1):3-20.
[21] Dieterle F, Sistare F, Goodsaid F, et al. Renal biomarker qualification submission: a dialog between the FDA-EMEA and predictive safety testing consortium. Nat Biotechnol, 2010, 28(5):455-462.
[22] Udawatte NS, Kang SW, Wang Y, et al. Predictive nephrotoxicity profiling of a novel antifungal small molecule in comparison to amphotericin B and voriconazole. Front Pharmacol, 2020, 11:511.
[23] George B, Joy MS, Aleksunes LM. Urinary protein biomarkers of kidney injury in patients receiving cisplatin chemotherapy. Exp Biol Med (Maywood), 2018, 243(3):272-282.
[24] Karademir LD, Dogruel F, Kocyigit I, et al. The efficacy of theophylline in preventing cisplatin-related nephrotoxicity in patients with cancer. Ren Fail, 2016, 38(5):806-814.
[25] Gaspari F, Cravedi P, Mandalà M, et al. Predicting cisplatin-induced acute kidney injury by urinary neutrophil gelatinase-associated lipocalin excretion: a pilot prospective case-control study. Nephron Clin Pract, 2010, 115(2):c154-160.
[26] Xiao K, Su L, Yan P, et al. α-1-Acid glycoprotein as a biomarker for the early diagnosis and monitoring the prognosis of sepsis. J Crit Care, 2015, 30(4):744-751.
[27] Liu QL, Lin B. Serum and urine α1-acid glycoprotein clinical value for early diagnosis of diabetic nephropathy. Chin J Integrated Traditional West Nephrol, 2019, 20(12):1089-1091. (in Chinese)
刘清林, 林博. 血清和尿液α1-酸性糖蛋白用于糖尿病肾病早期诊断的临床价值. 中国中西医结合肾病杂志, 2019, 20(12):1089-1091.
[28] Zhai YJ, Fu B, Yao Q, et al. The value of urinary cystatin C and α1-acid glycoprotein in the diagnosisof early diabetic nephropathy. China Mod Doctor, 2021, 59(4):34-37, cover 3. (in Chinese)
翟迎九, 付彬, 姚强, 等. 尿胱抑素C和α1-酸性糖蛋白在早期糖尿病肾病诊断中的价值. 中国现代医生, 2021, 59(4):34-37, 封3.
[29] Ruiz M. Into the labyrinth of the lipocalin α1-acid glycoprotein. Front Physiol, 2021, 12:686251.
[30] Vaidya VS, Ozer JS, Dieterle F, et al. Kidney injury molecule-1 outperforms traditional biomarkers of kidney injury in preclinical biomarker qualification studies. Nat Biotechnol, 2010, 28(5):478-485.
[31] Lee H, Fujimoto M, Ohkawara T, et al. Leucine rich α-2 glycoprotein is a potential urinary biomarker for renal tubular injury. Biochem Biophys Res Commun, 2018, 498(4):1045-1051.
[32] Shinke H, Masuda S, Togashi Y, et al. Urinary kidney injury molecule-1 and monocyte chemotactic protein-1 are noninvasive biomarkers of cisplatin-induced nephrotoxicity in lung cancer patients. Cancer Chemother Pharmacol, 2015, 76(5):989-996.
[33] Sinha V, Vence LM, Salahudeen AK. Urinary tubular protein-based biomarkers in the rodent model of cisplatin nephrotoxicity: a comparative analysis of serum creatinine, renal histology, and urinary KIM-1, NGAL, and NAG in the initiation, maintenance, and recovery phases of acute kidney injury. J Investig Med, 2013, 61(3):564-568.
Evaluation of 15 novel urine biomarkers in an animal model of acute kidney injury induced by gentamicin
ZHU Si-rui, QU Zhe, YANG Yan-wei, LIU Xin-lei, HUANG Zhi-ying, ZHOU Xiao-bing, LI Bo
Author Affiliations: National Center for Safety Evaluation of Drugs, National Institutes for Food and Drug Control, Beijing Key Laboratory of Drug Nonclinical Safety Evaluation Research, Beijing 100176, China (ZHU Si-rui, QU Zhe, YANG Yan-wei,LIU Xin-lei, ZHOU Xiao-bing, LI Bo); School of Pharmaceutical Sciences, Sun Yat-sen University, Guangzhou 510006, China (ZHU Si-rui, HUANG Zhi-ying)
To evaluate the diagnostic efficacy of 15 novel urine biomarkers for drug nephrotoxicity.Wistar rats were given continuous intraperitoneal injection of 120 mg/kg gentamicin (GEN) to construct an acute kidney injury (AKI) model. The 5-hour urine and blood samples were collected during the quarantine period and on the 5th and 8th day after administration, and the animals were dissected for renal pathological examination. An automatic biochemical analyzer was used for serum and urine biochemical testing in each group of animals. The Luminex liquid chip method was used to analyze the concentration of urine biomarkers as compared with the traditional renal function indicators of urea nitrogen (BUN) and creatinine (CRE).The histopathological results showed that typical acute kidney injury changes were found in gentamicin-treated animals as an obviously time-related manner. Compared with the control group, interferon-inducible protein-10 (IP-10) and β2-microglobulin (β2-MG) were significantly up on the 5th day, and continued to increase. On the 8th day, in addition to the two biomarkers of epidermal growth factor (EGF) and osteopontin (OPN), other 8 biomarkers in urine increased significantly (< 0.01). BUN and CRE also increased significantly on the 8th day (< 0.05). The receiver operating characteristic curve (ROC) results showed that the area under the curve (AUC) of albumin (ALB), IP-10, kidney injury factor-1 (KIM-1), neutrophil gelatinase-associated lipocalin (NGAL) and β2-MG were significantly better than BUN and CRE.The 5-hour urine samples from the drug-induced AKI animal model are collected and analyzed, of which confirmed that ALB, IP-10, KIM-1, NGAL and β2-MG are better than BUN and CRE in the early diagnosis of drug-induced acute nephrotoxicity. Candidate biomarkers will have good application prospects in the preclinical safety studies of drugs in rats.
nephrotoxicity; biomarker; acute kidney injury; gentamicin; preclinical safety evaluation
ZHOU Xiao-bing, Email: zhxb@nifdc.org.cn
10.3969/j.issn.1673-713X.2022.04.004
国家自然科学基金(81603210);“重大新药创制”国家科技重大专项(2018ZX09201017-001)
周晓冰,Email:zhxb@nifdc.org.cn
2021-10-26
