胸腺上皮性肿瘤体积与WHO 分型及Masaoka-Koga 分期的相关性研究
2022-08-11张砚满吴献华
宋 佳 ,张砚满 ,吴献华 *
(1 南通大学附属医院放射科,江苏 226001;2 南通大学第二附属医院影像科)
胸腺上皮性肿瘤(thymicepithelial tumors,TETs)是常见的纵隔原发肿瘤,占前纵膈肿瘤的40%~50%,多发于40~70 岁人群,男女发病率无显著差异[1]。TETs 病因尚不明确,在非裔美国人及亚太岛屿居民中发病率较高,提示可能与遗传因素有关[2-3]。TETs 起源于胸腺上皮细胞,主要由不同比例的上皮细胞和淋巴细胞组成。根据2015 年WHO 修订的TETs 组织学分类,分为胸腺瘤(A 型、AB 型、B1 型、B2 型、B3 型)和胸腺癌两大类。JEONG 等[4]根据临床需求,将TETs 分型简化为低危型胸腺瘤(A、AB、B1型)、高危型胸腺瘤(B2、B3 型)和胸腺癌。目前临床上广泛应用Masaoka-Koga 分期系统,根据肿瘤生长模式、外侵程度、转移情况对TETs 进行分期[5],研究认为该分期也是影响TETs 预后的独立因素,对临床治疗有指导意义[6]。
临床上需要联合临床分期、组织学分型及手术切除情况为TETs 患者制定合适的治疗方案,因此术前影像学评估十分重要。根据NCCN 临床实践指南,胸部增强CT 扫描是TETs 治疗前影像学评估的首选手段[7],不少研究尝试术前预测WHO 分型和Masaoka-Koga 分期,发现肿瘤大小是重要的预测指标[8-14]。本研究选择我院 2017 年 1 月—2020 年 12 月术后病理证实为TETs 患者125 例,分析肿瘤体积与WHO 分型和Masaoka-Koga 分期的相关性。
1 资料与方法
1.1 一般资料 TETs 患者125 例,术前均行胸部CT 平扫及增强扫描。125 例中胸腺瘤105 例,胸腺癌 20 例。根据 2015 年 WHO 分类标准:A 型 7 例(5.6%),AB 型 32 例(25.6%),B1 型 20 例(16.0%),B2 型 34 例(27.2%),B3 型 12 例(9.6%),胸腺癌 20例(16.0%)。按简化分组:低危型胸腺瘤59 例(47.2%),高危型胸腺瘤 46 例(36.8%),胸腺癌 20 例(16.0%)。Masaoka-Koga 分期:I 期 45 例(36.0%),Ⅱ期 50 例(40.0%),Ⅲ期 12 例(9.6%),Ⅳ期 18 例(14.4%),其中I 期为非侵袭性TETs,Ⅱ~Ⅳ期为侵袭性TETs。纳入标准:(1)术后有明确的 WHO 组织学分型和Masaoka-Koga 分期;(2)术前影像学资料齐全,图像质量佳;(3)手术与CT 检查的时间间隔小于2 周;(4)CT 检查前未行抗肿瘤治疗。WHO 简化分组各组间以及Masaoka-Koga 分期各组间患者的年龄、性别比较,差异均无统计学意义(P>0.05)。见表1,表2。
表1 WHO 简化分组患者一般资料比较 [n(%),]
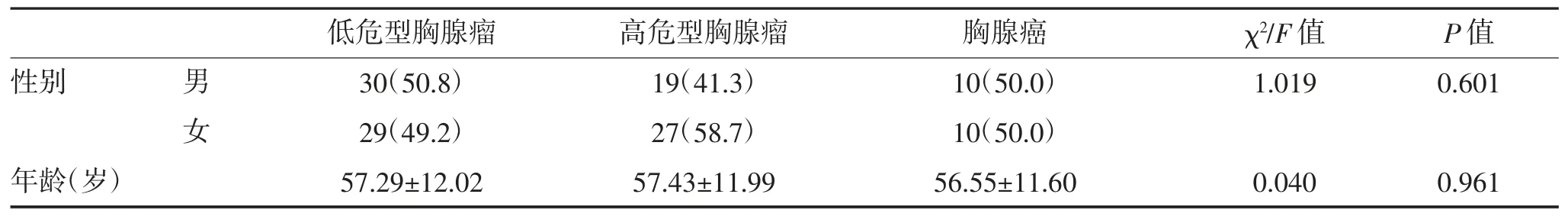
表1 WHO 简化分组患者一般资料比较 [n(%),]
低危型胸腺瘤 高危型胸腺瘤 胸腺癌 χ2/F 值 P 值性别 男 30(50.8) 19(41.3) 10(50.0) 1.019 0.601女29(49.2) 27(58.7) 10(50.0)年龄(岁) 57.29±12.02 57.43±11.99 56.55±11.60 0.040 0.961
表2 Masaoka-Koga 分期患者一般资料比较 [n(%),]
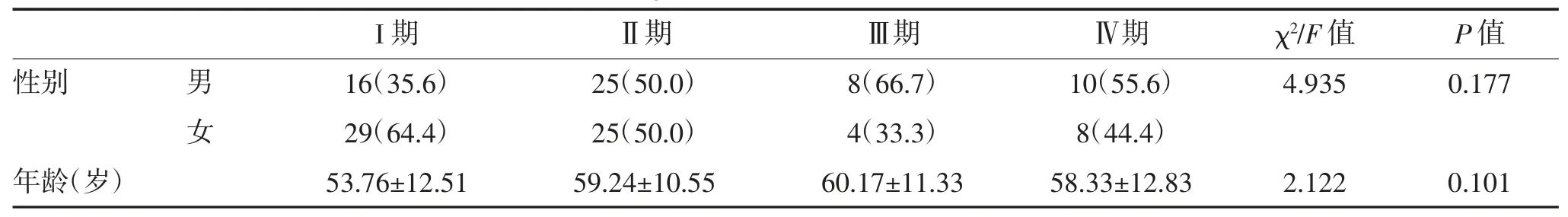
表2 Masaoka-Koga 分期患者一般资料比较 [n(%),]
I 期 Ⅱ期 Ⅲ期 Ⅳ期 χ2/F 值 P 值性别 男 16(35.6) 25(50.0) 8(66.7) 10(55.6) 4.935 0.177女29(64.4) 25(50.0) 4(33.3) 8(44.4)年龄(岁) 53.76±12.51 59.24±10.55 60.17±11.33 58.33±12.83 2.122 0.101
1.2 CT 扫描方法 CT 检查采用 Philips Briliance ICT 或GE Revoluntion。患者仰卧位,深吸气后屏气扫描,扫描范围自胸廓入口至横膈下缘。扫描参数:管电压 120 kV,管电流 250~300 mA,螺距 1.0,扫描层厚5 mm,重建层厚1 mm。增强扫描采用非离子型对比剂碘比醇(350 mgI/mL),总剂量 80~100 mL,经肘前静脉注射,注射速度3.5 mL/s。
1.3 图像分析 利用飞利浦工作站后处理软件,在横断位、冠状位、矢状位图像上对肿瘤边界进行勾画,由软件计算出感兴趣区(region of interest, ROI)的体积(图1)。最终取两名放射科诊断医生测量结果的平均值。
1.4 统计学处理 应用SPSS 23.0 统计学软件对数据进行分析。计数资料以频数和率表示,组间比较采用χ2检验;计量资料以表示,多组间比较采用 F检验,两组间比较采用U 检验;采用受试者工作特征曲线(ROC 曲线)分析肿瘤体积预测侵袭性TETs 的临界值及其效能。P<0.05 为差异有统计学意义。
2 结 果
2.1 TETs肿瘤体积与WHO 分型的相关性 TETs各亚型体积:A 型 26±42 cm3,AB 型 40±36 cm3,B1型 51±91 cm3,B2 型 60±113 cm3,B3 型 79±52 cm3,胸腺癌85±81 cm3,各亚型肿瘤体积比较,差异均无统计学意义(P=0.842)。低危型胸腺瘤体积42±61 cm3,高危型胸腺瘤体积 65±101 cm3,胸腺癌体积 85±81 cm3,三者差异均无统计学意义(P=0.098)。
2.2 TETs 肿瘤体积与Masaoka-Koga 分期的相关性 Masaoka-Koga 各分期 TETs 肿瘤体积:I 期为21±23 cm3,Ⅱ期为 48±36 cm3,Ⅲ期为 89±51 cm3,Ⅳ期为 156±165 cm3,I 期与Ⅲ期,I 期与Ⅳ期,Ⅱ期与Ⅳ期,Ⅲ期与Ⅳ期患者肿瘤体积比较,差异均有统计学意义(P<0.05)。侵袭性 TETs 肿瘤体积为 78±95 cm3,大于非侵袭性TETs 的21±23 cm3,差异有统计学意义(P<0.001)。肿瘤体积预测侵袭性胸腺上皮性肿瘤的ROC 曲线下面积为0.805,临界值为51.4 cm3,其敏感性为88.9%,特异性为62.5%,提示肿瘤体积大于51.4 cm3时侵袭性TETs 可能性大(图1)。
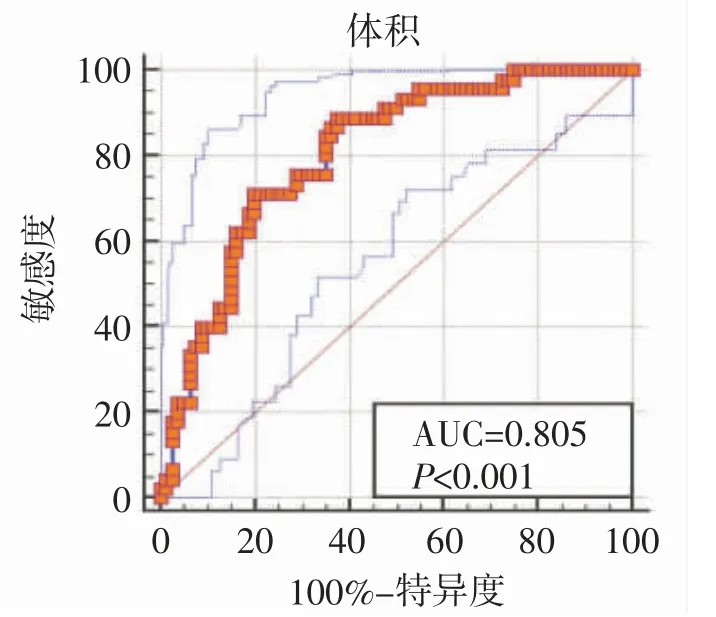
图1 肿瘤体积预测侵袭性TETs 的ROC 曲线
3 讨 论
LIU 等[15]研究指出WHO TETs 各亚型患者肿瘤长轴测量值比较,差异有统计学意义。但本研究未发现TETs 各亚型肿瘤体积的差异有统计学意义,亦未发现低危型胸腺瘤、高危型胸腺瘤和胸腺癌肿瘤体积的差异有统计学意义。有研究[11,16]表明胸腺癌的肿瘤体积明显大于胸腺瘤,这可能与本研究纳入的胸腺癌病例数少,收集病例中包括较大体积的B 型胸腺瘤有关。
由于肿瘤生长并非总是对称,采用手动测量肿瘤长轴直径,以近似为椭球来计算肿瘤体积,这种二维方法很难精确测量体积。本研究利用后处理软件三维测量肿瘤体积,能提高一定的精确性[17]。本研究发现Masaoka-Koga 各分期TETs 肿瘤体积比较,差异均有统计学意义(P<0.05),且侵袭性TETs 体积明显大于非侵袭性 TETs(P<0.001),这与 SATO 等[16]研究结果一致。QU 等[12]在CT 上发现肿瘤体积与Masaoka-Koga 分期显著相关,但其研究中不包括胸腺癌。MAROM 等[11]认为Ⅰ/Ⅱ期与Ⅲ/Ⅳ期肿瘤体积的差异有统计学意义。另外,本研究采用ROC 曲线分析肿瘤体积预测侵袭性胸腺上皮性肿瘤的效能,曲线下面积为0.805,区分非侵袭性TETs 和侵袭性TETs 体积临界值为51.4 cm3,其敏感度为88.9%,特异度为62.5%,提示肿瘤体积大于该临界值时,侵袭性TETs 可能性大。
综上所述,TETs 肿瘤体积与Masaoka-Koga 分期具有一定相关性,且侵袭性TETs 肿瘤体积明显大于非侵袭性TETs,当肿瘤体积大于51.4 cm3时侵袭性TETs 可能性大。因此,术前CT 检查能为TETs 临床分期的评估提供依据,并对肿瘤治疗方式的选择及预后判断具有重要作用。
