碳酸氢盐处理下桑树和构树的生长、光合和抗逆性差异
2022-08-11李仕洪刘映良吴沿友
李仕洪, 姚 凯, 刘映良, 吴沿友
( 1. 贵州师范大学 生命科学学院, 贵阳 550025; 2. 中国科学院地球化学研究所 环境地球化学国家重点实验室, 贵阳 550081 )


1 材料与方法
1.1 实验材料培养
本实验采取从种子萌发开始的材料培养方式。本实验的构树种子收集于贵州省贵阳市中国科学院地球化学研究所老所园区;桑树种子收集于贵州省贵阳市贵州省农业科学院。选取籽粒饱满的种子,置于盛有一定体积的珍珠岩的育苗盒中,种子上覆盖一薄层的珍珠岩,育苗盘的盛水盒中注入一定量的蒸馏水,以不浸泡种子为宜。培养室温度为25 ℃,湿度为50%~60%,光照时间为12 h。约12 d时,种子开始萌发。待幼苗出现4片叶片时,选取生长均一、茁壮的幼苗移植到12孔育苗盒中。每个育苗盒栽培2株幼苗,保持适当间距,确保幼苗生长至适宜实验要求的过程中,互不干扰,移苗后,将种植有植株的育苗盒置于人工气候室内,设置光周期为12 h,光合有效辐射(PPFD)为300 μmol·m·s,日间气温保持为25 ℃,夜间气温保持为20 ℃,相对湿度为55%~65%。桑树和构树幼苗均采用水培方式进行培养,以1/2浓度的霍格兰营养液为植物幼苗提供营养和水分。
1.2 碳酸氢盐胁迫处理

1.3 植株生长参数测定
为了测量碳酸氢盐作用下构树和桑树生长指标的动态变化,本研究采取测量植株地上部分的各项指标来分析、评估植物的生长情况。该测量过程应尽量避免影响植物的正常生长。碳酸氢盐处理后,分别于第0、第2、第4、第6、第8、第10、第12天对植株的生长指标进行测量。本实验选取株高(H)、基径(D)、叶片数(N)和大于等于80 mm叶片宽度的叶片数(N)作为判断植物生长情况的各项指标。
1.4 植株叶片光合参数测定
进行碳酸氢盐胁迫处理后,分别于第0、第2、第4、第6、第8天对植株的光合参数进行测定,测定时间固定于下午的14:00—16:00,避开植物可能产生午休现象的时间。使用进口LI-6400XT便携式光合测量系统(LI-COR,Lincoln,NE,USA)对植株叶片的净光合速率()、气孔导度()、二氧化碳浓度()和蒸腾速率()进行测定。气孔限制值()由公式=1-(为空气中CO浓度)计算得出(Farquhar & Sharkey, 1982;韩瑞宏等,2007) 。
1.5 植株叶片抗氧化酶活性测定
酶液的提取参照彭方仁等(2007)的方法;超氧化物歧化酶(SOD)活性测定参照Zhang等(2000)的方法;过氧化物酶(POD)活性测定参照Zhang等(2000)的方法;过氧化氢酶(CAT)活性测定参照Aebi(1984)的方法。
1.6 植株叶片渗透调节物质含量测定
脯氨酸含量测定参照Lei等(2007)的方法;可溶性糖含量测定参照邹琦(2003)的方法。
1.7 硫代巴比妥酸反应物(TBARS)测定
参照Heath和Packer(1968)的方法。
1.8 数据统计与分析
文中数据采用软件Microsoft Excel 2019进行基础数据整理,用软件IBM SPSS Statistics 20.0进行双因素方差分析检验不同树种和不同NaHCO浓度对植株的生长情况、光合能力、抗氧化酶活性、渗透调节物质含量和细胞膜系统损伤情况等影响的显著性,用独立样本检验不同树种之间的生长情况、光合能力、抗氧化酶活性、渗透调节物质含量和细胞膜系统损伤情况等影响的显著性,测定不同处理方式间在0.05 水平上的显著差异,运用软件Origin 2019b 32Bit绘制图表。
2 结果与分析
处理对构树和桑树生长指标的影响


表处理8 d后桑树和构树的生长指标Table 1 Growth indices of Morus alba and Broussonetia papyrifera after treatments for eight days
处理对构树和桑树光合特征的影响


表处理8 d后桑树和构树的光合参数Table 2 Photosynthetic parameters of Morus alba and Broussonetia papyrifera after treatments for eight days
处理下构树和桑树的抗氧化酶活性

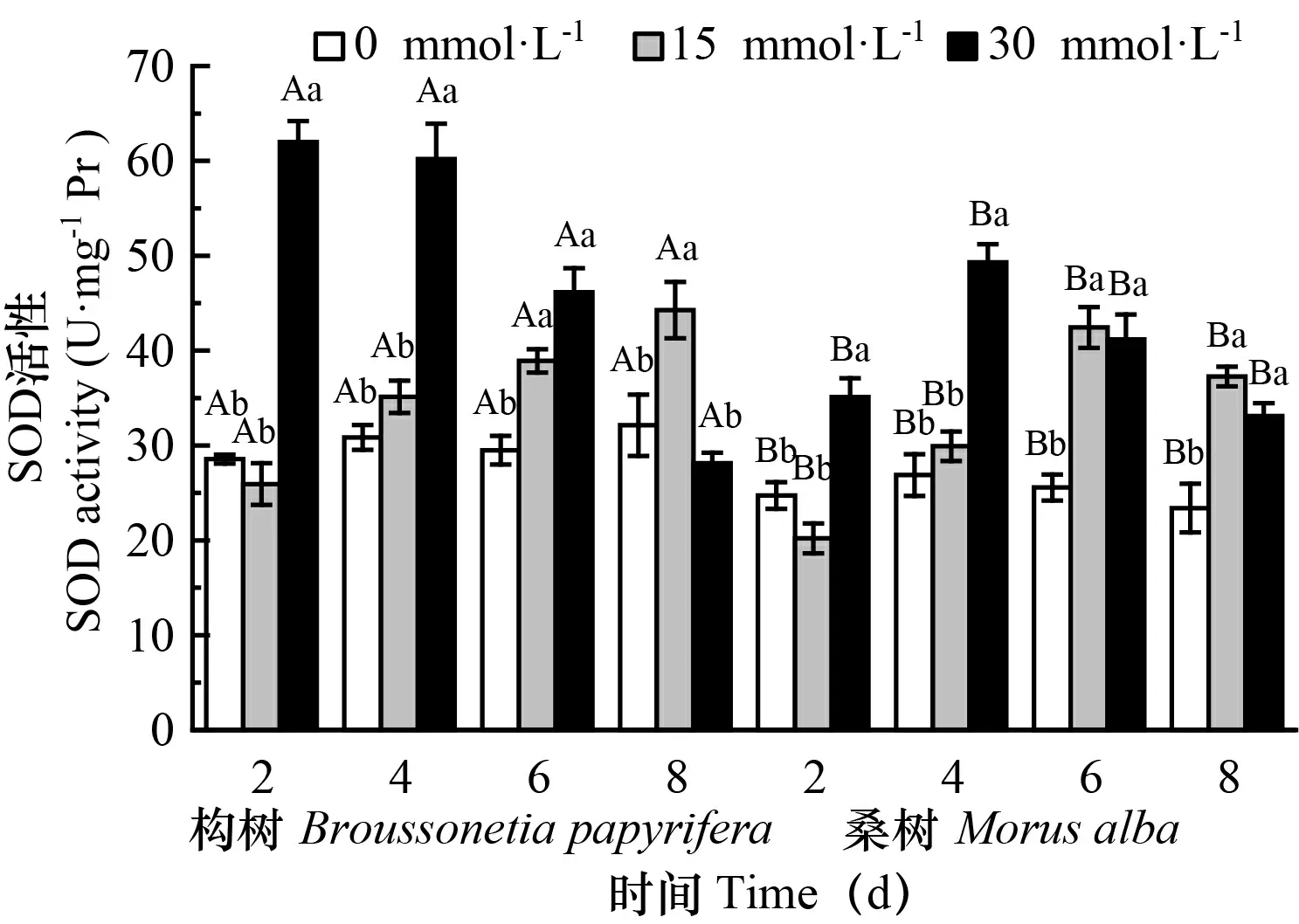
不同小写字母表示同一树种不同浓度处理差异显著(P<0.05);不同大写字母表示不同树种同一浓度处理差异显著(P<0.05)。数据为平均值±标准差。下同。Different lowercase letters indicate those treatments of the same tree species with different concentrations of The same below. 图 1 在对照和处理下构树和桑树叶片SOD活性的变化Fig. 1 Changes of SOD activities in Broussonetia papyrifera and Morus alba leaves under 15 mmol·L-1 30 mmol·L-1 control treatments

此外,不得不提的是,香港投融资中心由资产运营向资本运营和资产运营相结合,是西王集团转型发展的重要组成部分。这种转型,某种程度上说,与新生代的知识结构、成长经历、个人喜好高度关联。他们不愿再重复父辈的老路,在产业风口之下,开始新的“玩法”,进入新的市场。
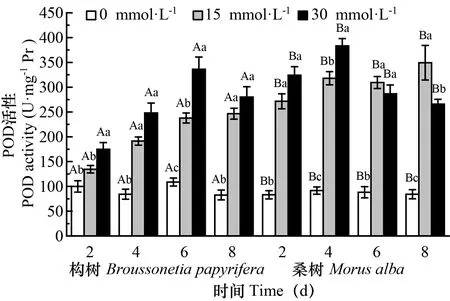
图 2 在对照和30 mmol·L-1 处理下,构树和桑树叶片POD活性的变化Fig. 2 Changes of POD activities in Broussonetia papyrifera and Morus alba leaves under 15 mmol·L-1 30 mmol·L-1 and control treatments
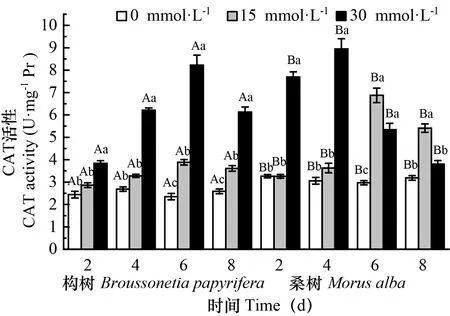
图 3 在对照和30 mmol·L-1 处理下构树和桑树叶片CAT活性的变化Fig. 3 Changes of CAT activities in Broussonetia papyrifera and Morus alba leaves under 15 mmol·L-1 30 mmol·L-1 control treatments
处理下构树和桑树的渗透调节物质含量


图 4 在对照和30 mmol·L-1 处理下构树和桑树叶片脯氨酸含量的变化Fig. 4 Changes of proline contents in Broussonetia papyrifera and Morus alba leaves under 15 mmol·L-1 30 mmol·L-1 control treatments
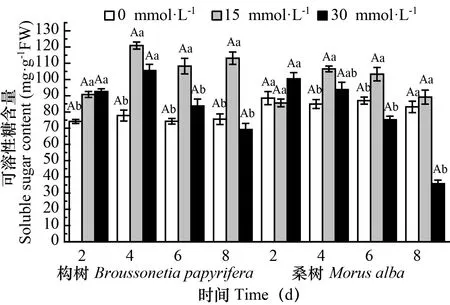
图 5 在对照和处理下构树和桑树叶片可溶性糖含量的变化Fig. 5 Changes of soluble sugar contents in Broussonetia papyrifera and Morus alba leaves under 15 mmol·L-1 30 mmol·L-1 and control treatments
处理下构树和桑树的细胞损伤情况

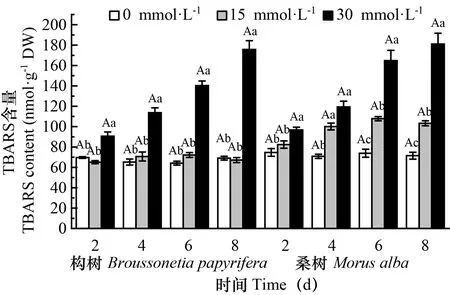
图 6 在对照和处理下构树和桑树叶片TBARS含量的变化Fig. 6 Changes of TBARS contents in Broussonetia papyrifera and Morus alba leaves under 15 mmol·L-1 30 mmol·L-1 and control treatments
3 讨论与结论
处理下构树和桑树幼苗生长的变化


处理对构树和桑树光合特征的变化



处理下构树和桑树的抗氧化酶活性、渗透调节物质含量及细胞损伤情况的变化
在盐碱胁迫下,植物的抗氧化酶保护与渗透调节作用同时存在并相互协作(袁泽斌等,2020)。碱胁迫增加了高pH的影响,抑制了植物细胞对离子的吸收并破坏离子平衡(Guo et al., 2010;Javid et al., 2012;Lin et al., 2012),使植物体内产生活性氧簇(ROS),造成一定程度的氧化伤害(刘建新等,2008)。SOD、CAT、POD等抗氧化酶作为植物耐NaHCO的生化选择指标(Ahmad et al., 2014),能够有效还原和清除植物体内的损伤膜系统共同抵制活性氧对细胞膜系统的伤害(陈展宇等,2017;陈展宇等,2019)。可溶性糖和脯氨酸作为研究抗盐碱性指标之一,在盐碱胁迫下可以引起渗透调节物质的积累,从而维持细胞内的渗透平衡,增强细胞结构稳定性(Smirnoff & Cumbes, 1989;Bohnert & Jensen, 1996;张丽,2010)。