新生儿重症监护室晚发型败血症病原菌变迁及耐药性分析
2022-08-09张良娟施姣杨军兰刘振国郭金珍李占魁李清红
张良娟 施姣 杨军兰 刘振国 郭金珍 李占魁 李清红
西北妇女儿童医院新生儿科(陕西西安 710061)
新生儿晚发型败血症(late-onset sepsis,LOS)是新生儿重症监护室(neonatal intensive care unit,NICU)中引起患儿死亡的重要疾病之一,尤其是早产儿或低出生体质量儿。延误发现和不适当的使用抗生素是导致该病救治失败的关键因素之一[1]。因受地域、胎龄以及病种分布、区域性和时段性抗菌药物使用习惯等各种因素影响,病原菌构成在逐年变化。随着多重耐药菌的不断出现,以及抗菌药物的有限储备,可供选择的抗生素越来越少。因此,定期了解LOS 病原菌构成、变迁及耐药情况,对有效控制院内感染,降低病死率至关重要。本研究回顾性分析西北妇女儿童医院NICU 经血培养确诊的LOS患儿的临床资料,分析病原菌的逐年变化特点及耐药情况,以期为临床诊治、合理用药提供依据。
1 对象与方法
1.1 研究对象
回顾性分析2012年1月1日至2019年12月31日入住NICU、在医院内获得感染且经血培养阳性确诊的LOS 患儿的临床资料。纳入标准:①足月儿3~28 d,早产儿3 d至矫正胎龄44周;②符合《新生儿败血症诊断及治疗专家共识(2019年版)》的LOS确诊标准[2],即“大于3日龄,有败血症临床表现,血培养或脑脊液(或其他无菌腔液)培养阳性”;③双份血培养结果均为同一病原菌。排除标准:存在标本污染的病例。
根据血培养结果分为革兰阴性(Gram-negative,G-)菌组、革兰阳性(Gram-positive,G+)菌组和真菌组。
1.2 方法
1.2.1 临床资料 收集患儿胎龄、体质量、性别、分娩方式、发病日龄、发病前抗生素暴露史、临床表现、合并症及结局,2012—2019年血培养及药敏结果。
1.2.2 标本采集 临床考虑发生LOS者在使用抗菌药物治疗前,严格无菌操作下,采集两个不同部位的静脉血2~3 mL进行培养及药物敏感试验。
1.2.3 检测方法 检测标本置美国BD公司的BD BactecTMFX全自动血培养仪进行培养,细菌分离鉴定参照《全国临床检验操作规程》,并经法国生物梅里埃公司 VITEK2-compact 生化鉴定系统进行鉴定。所有细菌用的药敏试剂卡片均为法国生物梅里埃公司生产。大肠埃希菌ATCC25922、金黄色葡萄球菌ATCC25923和铜绿假单胞菌ATCC27853作为药敏试验质控菌。大肠埃希菌ATCC25922和肺炎克雷伯杆菌ATCC 700603 分别作为产超广谱β 内酰胺酶(extended spectrum β-lactamases,ESBLs)确证试验阳性质控菌。
1.3 统计学分析
采用SPSS 23.0 统计软件进行数据分析。计量资料符合正态分布的以均数±标准差表示,多组间比较采用单因素方差分析;非正态分布的以中位数(P25~P75)表示,多组间比较采用Kruskal WallisH秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
研究期间NICU 共收治12 242 例新生儿,符合LOS纳入标准252例,排除标本污染病例29例,最终纳入223例,经血培养阳性确诊LOS发生率为1.8%。其中男116 例、女107 例,平均胎龄(31.9±1.2)周,平均出生体质量(1 584.1±620.9)g,发生LOS的中位年龄为19.0(13.0~27.0)d,早产儿203例(91.0%)、足月儿20例(9.0%),剖宫产138例(61.9%)、顺产85例(38.1%)。发病前抗生素暴露180例(80.7%)。
LOS临床多表现为反应差(120例,53.8%),呼吸暂停(91例,40.8%),体温改变(53例,23.8%),皮肤改变(51 例,22.9%)及喂养不耐受(44 例,19.7%)。合并细菌性脑膜炎32例,新生儿坏死性小肠结肠炎20例,感染性休克18例。死亡18例,存活205例。
2.2 LOS病原菌分布情况
共检出234株病原菌,以G-菌检出最多(128株,54.7%),其中肺炎克雷伯杆菌77株,占60.2%;G+菌次之(69株,29.5%);真菌37株(15.8%)。比较不同年份病原菌分布情况发现,G-菌、G+菌以及真菌检出率差异有统计学意义(χ2=51.88,P<0.001);G-菌和真菌均以2016年检出率最高,G+菌以2014年检出率最高。128 株G-菌中,不同年份间各种G-菌的检出率差异有统计学意义(χ2=66.47,P=0.001);69 株G+菌中,不同年份间各种G+菌的检出率差异有统计学意义(χ2=48.94,P=0.016);37 株真菌中,光滑念珠菌、白色念珠菌以及克柔假丝酵菌的检出率分布在不同年份间的差异亦有统计学意义(χ2=26.90,P=0.008)。见表1。
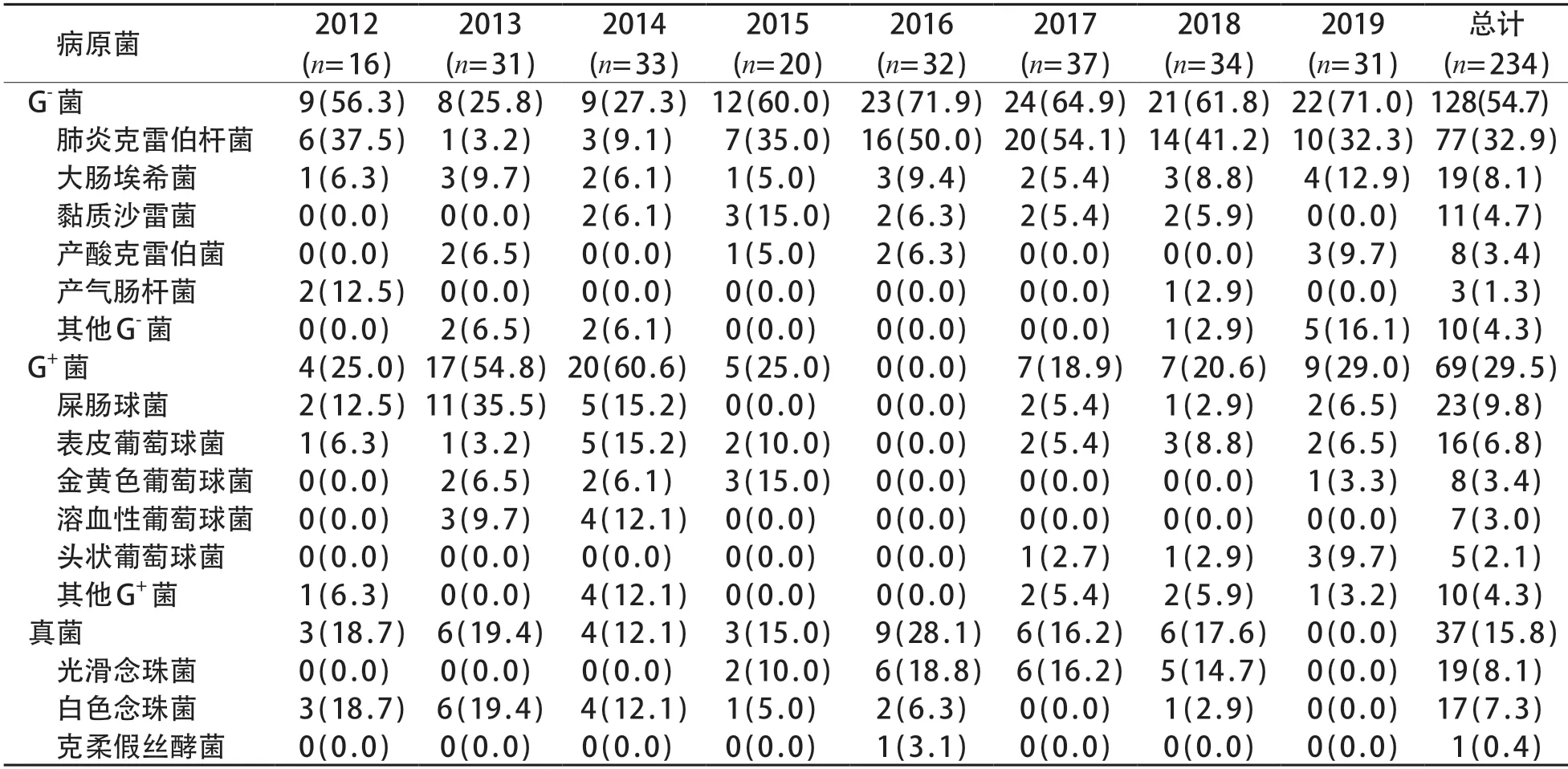
表1 不同年份导致LOS病原菌分布差异[n (%)]
2.3 G+菌、G-菌和真菌组临床特征比较
G+菌、G-菌及真菌组的发病时间、剖宫产率、胎膜早破时间>18 h、抗生素暴露率及病死率差异均有统计学意义(P<0.05)。G-菌组剖宫产率、病死率较高,发病时间较短;真菌组抗生素暴露率、胎膜早破时间>18 h比例较高。见表2。
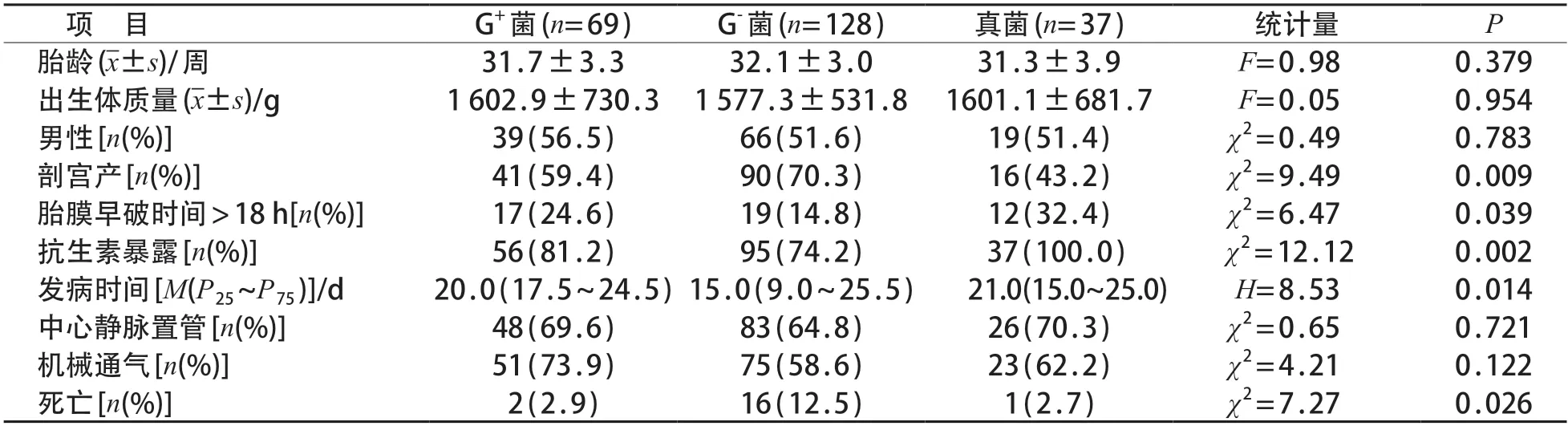
表2 G+菌、G-菌和真菌组临床特征比较
2.4 早产儿与足月儿病原菌分布及构成比情况
203例早产儿检出病原菌212株,20例足月儿检出病原菌22株。肺炎克雷伯杆菌(74株,34.9%)是引起早产儿LOS最常见致病菌;金黄色葡萄球菌是引起足月儿LOS的常见致病菌(4株,18.2%)。早产儿和足月儿组G-菌、G+菌以及真菌检出率差异无统计学意义(χ2=0.23,P=0.892)。128株G-菌中,早产儿和足月儿组之间各种G-菌的检出率差异有统计学意义(Fisher精确概率法,P<0.001);69株G+菌中,早产儿和足月儿组之间各种G+菌的检出率差异有统计学意义(Fisher精确概率法,P=0.006);37株真菌中,光滑念珠菌、白色念珠菌以及克柔假丝酵菌的检出率在早产儿和足月儿组之间的差异无统计学意义(Fisher精确概率法,P=1.000)。见表3。
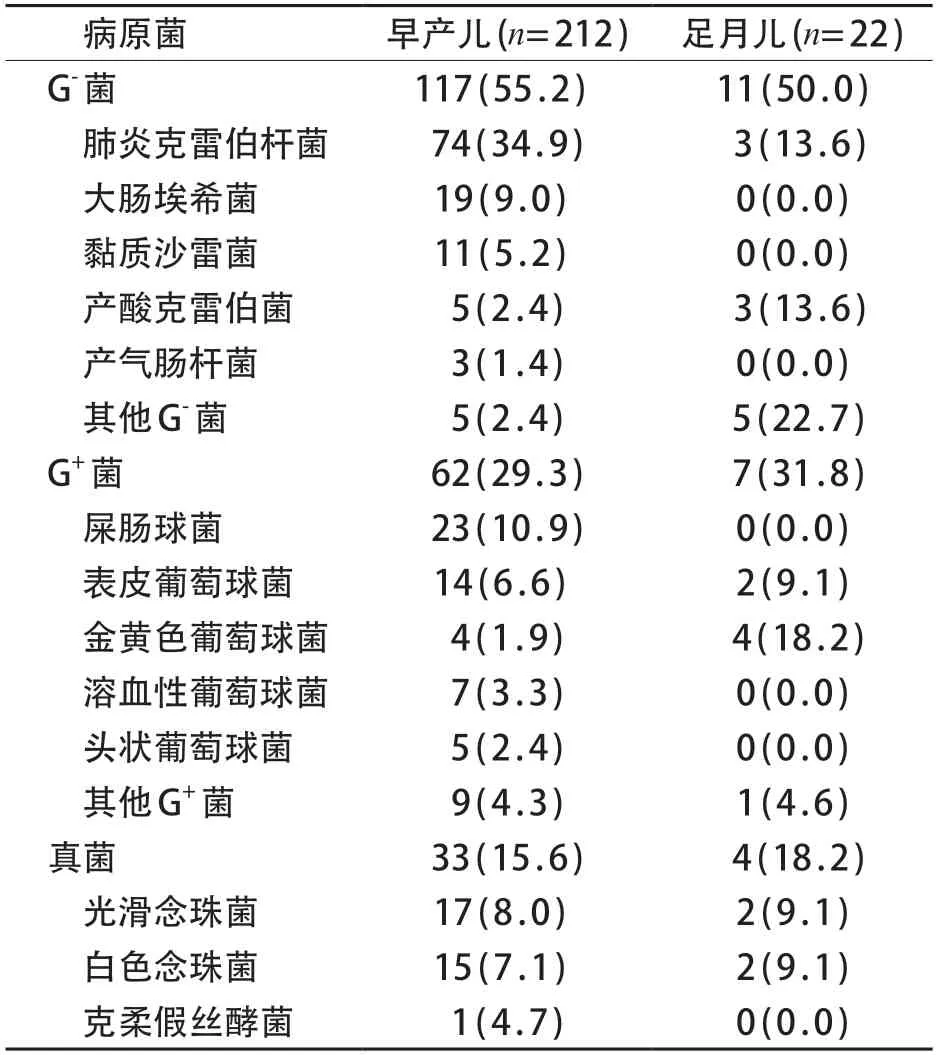
表3 早产儿与足月儿LOS病原菌分布[n (%)]
2.5 死亡病例病原菌分布情况
223例LOS患儿中死亡18例,病死率8.1%。死亡患儿胎龄(29.9±2.7)周,体质量(1 254.7±392.9)g。检出病原菌19株,其中G-菌感染15例,包括6例肺炎克雷伯杆菌,4例大肠埃希菌,3例黏质沙雷菌,嗜麦芽窄食单胞菌及产气肠杆菌各1例;另外1 例为屎肠球菌;1 例为白色念珠菌;1 例为肺炎克雷伯杆菌及屎肠球菌合并感染。
2.6 主要检出菌耐药性分析
G-菌对不加酶青霉素类、头孢菌素类表现出高耐药率,加酶后耐药率明显降低,已出现对美罗培南、亚胺培南的耐药株。见表4。G+菌对青霉素、苯唑西林等常用抗生素普遍耐药,尚未发现对利奈唑胺及万古霉素的耐药株。见表5。
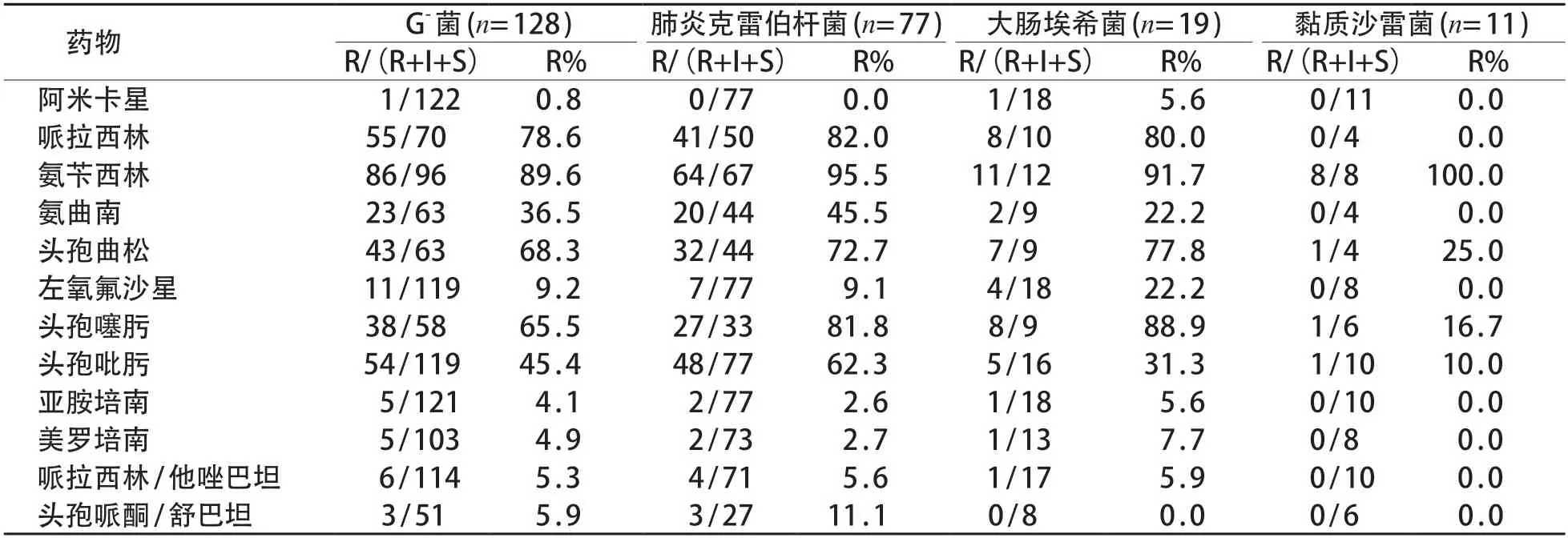
表4 G-菌对常用抗菌药物的耐药情况
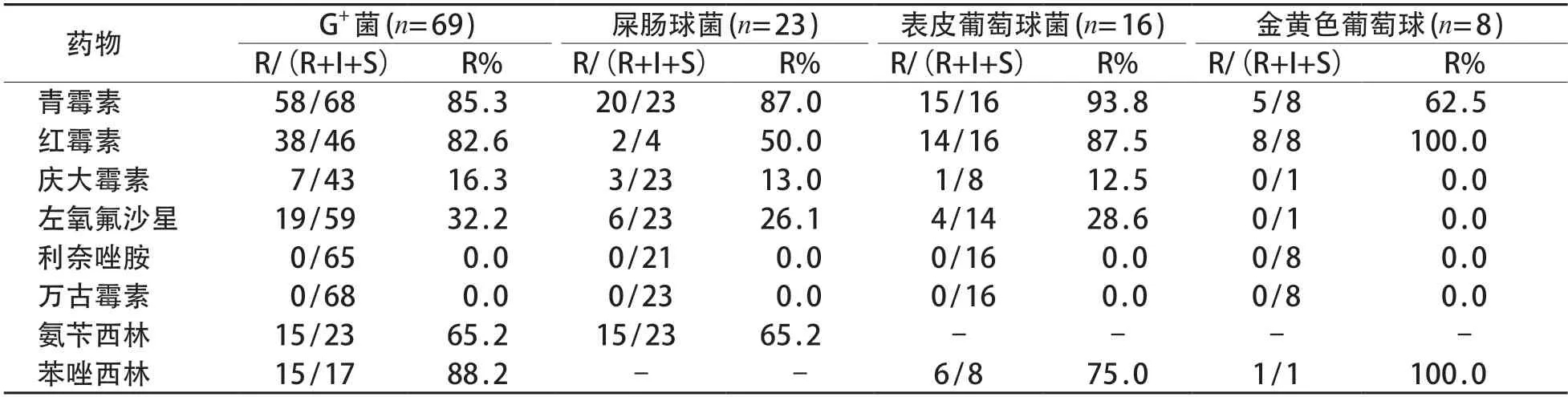
表5 G+菌对常用抗菌药物的耐药情况
2.7 多重耐药菌分布及构成比
检出多重耐药菌109株(46.6%),以ESBLs肠杆菌为主(74株,67.9%)。75.3%(58/77)的肺炎克雷伯杆菌和63.2%(12/19)的大肠埃希菌均为ESBLs阳性。见表6。

表6 多重耐药菌分布及构成比(n=109)
死亡病例中10 例为多重耐药菌感染(10/18,55.6%),其中5例(50.0%)为ESBLs肺炎克雷伯杆菌,3例(30.0%)为ESBLs大肠埃希菌,ESBLs黏质沙雷菌和ESBLs产气肠杆菌各1例(10.0%)。
3 讨论
本研究显示,早产儿确诊LOS数是足月儿10.2倍。与足月儿相比,早产儿患LOS的风险显著增高,这与低胎龄、低出生体质量、免疫功能不成熟、住院期间侵袭性诊疗技术的应用和抗生素广泛使用造成菌群失调等因素密切相关[1]。本研究确诊LOS比例为1.8%,低于国内报道的3.7%[3],分析原因与本中心手卫生及病房设备消毒管理等严格无菌观念的提高有关。
本研究通过对比8年数据发现LOS病原菌占比发生改变的转折点在2015年,2013、2014年病原菌检出率以G+菌为主,2015 年后逐渐以G-菌为主,考虑为2015 年后本院病区扩增后收治的危重患儿明显增加,尤其是极早/超早早产儿,医疗技术的发展使得这部分患儿存活率提高,然而这些患儿也极大程度的延长了住院时长和增加了院内感染的风险,尤其是易发生G-菌定植,并转移到血液中[4];这也表明医疗硬件设施在新生儿LOS 病原菌变化中的作用机制。由于年代、地域环境等不同,新生儿LOS 病原菌分布模式在不同国家存在较大差异[5]。根据美国新生儿学网络监测,LOS病原菌主要为G+菌,以凝固酶阴性的葡萄球菌(coagulase-negativeStaphylococcus,CoNS)为主,其次为G-菌,以大肠埃希菌最常见[6]。近年来国内研究报道G-菌已成为LOS的主要致病菌,以肺炎克雷伯杆菌居首[7-8]。本研究发现肺炎克雷伯杆菌是LOS患儿最常见的致病菌,也是早产儿LOS 的主要病原菌,与文献报道一致[7]。屎肠球菌作为本研究G+菌LOS 的主要致病菌,与相关研究报道不一致[9],考虑屎肠球菌是人类肠道的主要定植菌,抗G-菌抗生素暴露过多引起肠道微生物分布异常导致主要定植菌进入血液发生感染[10]。真菌作为LOS的第三大重要病原体,多在长期住院期间发生,特别是随着条件致病菌及多重耐药菌的出现,增加了真菌感染的风险。应采取综合预防措施,进一步降低真菌性LOS的风险。
不同类型病原菌引起LOS 的危险因素存在显著差异。本研究发现G-菌组的剖宫产率较高,且引起LOS的发病时间更早,与国内多中心研究相符[8]。这可能是因为早产儿作为G-菌感染的主要人群,母孕期合并症增加了剖宫产率,另外早期静脉注射、气管插管或其他侵入性操作使得该人群更早发生医院获得性感染[7]。胎膜早破的主要并发症为早产和宫内感染[11]。因羊膜腔屏障的完整性受到破坏,宫内环境暴露于外界,一方面产妇阴道念珠菌上行感染,另一方面广谱抗生素的暴露破坏了正常菌群,均促进了真菌生长,这也解释了真菌感染组胎膜早破及抗生素暴露比例高的结果。本研究死亡病例以G-菌感染为主,肺炎克雷伯杆菌感染死亡约占1/3,且大多数为多重耐药菌感染,死亡风险远远高于G+菌,与文献报道一致[12]。主要是因为G-菌细胞壁结构较复杂,易产生变异和抗药性,产生的内毒素性能稳定且抗原性弱,较G+菌有更强的致病力,因此容易引起严重的临床症状和更高的病死率[13]。
本研究检出的肺炎克雷伯杆菌中,75.3%为ESBLs 阳性,呈多重耐药,对常用的β-内酰胺类抗生素耐药率均较高,对加酶抑制剂的耐药率明显降低,已出现对美罗培南、亚胺培南的耐药株,与国内外研究结论相符[14-15]。提示临床医师应尽量控制使用碳青霉烯类抗生素,以免引起严重的菌群失调和多重耐药。G-菌对阿米卡星、左氧氟沙星等耐药率低,与这些抗生素对肝、肾、听力和软骨发育等有严重毒副作用,在新生儿中较少使用有关[2]。检出的G+菌对青霉素及红霉素表现出高耐药性,对万古霉素及利奈唑胺均敏感,未发现耐药菌株。但滥用万古霉素是多重耐药菌群出现和侵袭性真菌感染发生率升高的重要因素,因此需合理使用万古霉素。
本研究显示多重耐药菌以G-菌为主,其中主要为ESBLs 肺炎克雷伯杆菌及ESBLs 大肠埃希菌,这与相关研究结果一致[16]。耐碳青霉烯类菌株的出现,更加提示了医护手卫生、NICU 环境清洁、评估各项侵入性操作以及规范合理用药的重要性。本研究因多重耐药菌感染导致的死亡病例占55.6%,应引起充分重视。
综上所述,为获得院内感染LOS 管理的最佳结果,需不断更新了解新生儿LOS 病原体分布特点,以便作出更好的初始抗菌治疗的医疗决策。
