精神分裂症肠道微生物与脑影像和临床表征的关系*
2022-08-09周振友陈楚侨
周振友 孔 丽,2 陈楚侨
精神分裂症肠道微生物与脑影像和临床表征的关系*
周振友1孔 丽1,2陈楚侨3
(1上海师范大学心理系, 上海 200234) (2华东师范大学城市化生态过程与生态恢复重点实验室, 上海 200241) (3中国科学院心理研究所心理健康重点实验室, 神经心理学与认知神经科学研究室, 北京 100101)
微生物−肠−脑轴假设在精神分裂症发病机制中的研究受到越来越多的关注。以往研究初步考察了肠道微生物的构成与精神分裂症患者脑影像和临床表征之间的联系, 但具体的作用路径尚不明确。当前研究通过总结最新研究进展, 并在此基础上提出肠道微生物影响精神分裂症患者大脑结构和功能的机制假设。相关内容对于进一步阐明精神分裂症的病理机制, 为将肠道微生物纳入精神分裂症的评估与干预提供理论基础。
精神分裂症, 肠道微生物, 微生物−肠−脑轴, 脑影像, 临床表征
1 引言
精神分裂症是一组成因不明、病程迁延、预后不良的重性精神疾病(Insel, 2010)。目前, 精神分裂症的发病机制尚未完全阐明, 现有普遍公认的病因假说包括多巴胺假说、五羟色胺(血清素)假说和微生物−肠−脑轴假说等(Nemani et al., 2015; Seeman, 2021; Stahl, 2018)。Nemani等人(2015)最早提出精神分裂症的微生物−肠−脑轴假说, 认为精神分裂症患者的肠道微生物与中枢神经系统之间存在双向交流, 并通过微生物−肠−脑轴在精神分裂症的病理过程中产生作用。一方面, 肠道微生物可通过肠道免疫系统影响大脑。肠道微生物的破坏使肠道的通透性增加, 导致有害微生物及其产物迁移到身体其它部位并引发炎症, 进而使血脑屏障(blood-brain-barrier, BBB)的通透性增加。肠道菌群代谢所产生的神经营养因子透过血脑屏障的稳态被破坏, 增加了大脑出现炎症的风险, 引起大脑结构和功能的异常, 例如导致大脑海马体神经元的损伤(Jiang et al., 2015; Kelly et al., 2005; Kelly et al., 2021; Ma et al., 2017)。另一方面, 生命早期肠道微生物的定植会影响中枢神经系统的发生发育。肠道微生物群的形成和神经发育同时发生, 两者都具有相似的对损伤敏感的窗口期(Heijtz et al., 2011)。当大脑在神经元回路和突触水平上面临重塑时, 肠道微生物会通过其代谢产物影响和促进这一时期神经元回路的精细化过程(Oliphant et al., 2021)。
以往研究发现, 精神分裂症患者与正常人之间的肠道微生物构成和多样性存在显著差异, 通常表现为肠道微生物多样性的显著降低(Foster & Neufeld, 2013; Li et al., 2017; Vogt et al., 2017; Schwarz et al., 2018)。进一步的研究发现, 精神分裂症患者的肠道微生物构成的多样性和相对丰度的改变与特定脑区的结构和功能异常与存在联系(Li et al., 2021; Ma et al., 2020; 吴位东, 2019)。但肠道微生物的改变与精神分裂症患者的大脑结构和功能受损的具体关系尚不明确, 并且肠道微生物如何通过微生物−肠−脑轴对精神分裂症患者的大脑结构和认知功能产生影响的具体通路也不清楚。因此, 本文回顾了有关精神分裂症患者的肠道微生物结构异常的研究, 同时也综述了当前有关精神分裂症患者的肠道微生物与大脑结构和功能关系的研究, 进一步理清肠道微生物如何通过微生物−肠−脑轴在精神分裂症的潜在病理生理学过程中产生影响, 为阐明精神分裂症的病理生理学机制提供新的见解。
2 精神分裂症与肠道微生物
2.1 精神分裂症患者与健康人的肠道微生物差异
正常人的肠道微生物主要由4个分支组成:拟杆菌属、厚壁菌属、变形菌属和放线菌属, 占肠道微生物总数量的99% (Lloyd-Price et al., 2016; Zhang et al., 2015; Zou et al., 2019)。本文详细检索了精神分裂症个体与健康对照的肠道微生物差异的研究, 在中国知网、万方、维普网数据库将关键词“精神分裂症”、“精神疾病”与“肠道微生物”、“肠道菌群”进行匹配检索, 接着将关键词:“schizophrenia”、“Psychiatry”与“gut microbiome”、“gut microbiota”、“gastrointestinal microbiome”、“gastrointestinal microbiota”进行匹配, 在Web of Science、Pub Med、Cochrane Library和Science Direct数据库中检索, 搜索篇名、关键词及摘要中包含此类关键词的期刊与论文, 检索截止日期为2021年12月, 共纳入7项使用16S rRNA技术对精神分裂症患者的肠道菌群进行基因测序的研究, 其中4项研究对象为中国被试, 3项研究对象为外国被试(表1), 结果显示精神分裂症患者与健康人肠道微生物的差异主要体现在微生物构成的多样性以及相对丰度的差异上。
2.1.1 多样性的差异
在肠道微生物的多样性上, 研究结果一致认为精神分裂症患者的肠道微生物多样性显著低于正常人。Xu等人(2020)的研究发现, 与健康对照组相比, 精神分裂症患者的肠道菌群多样性显著降低, 具体表现为β多样性指数的降低, 这种肠道菌群多样性的降低可区分精神分裂症患者与健康被试, 而且, 精神分裂症患者的肠道微生物营养不良指数与肠道菌群相关的肠道免疫球蛋白A (IgA)水平呈正相关, 与肠道菌群多样性呈负相关。Li等人(2020)研究精神分裂症患者与健康被试的肠道菌群多样性的差异发现:α多样性(单个样本中的微生物多样性)在健康被试组和精神分裂症组之间没有显著差异, 这与Nguyen等人(2019)的研究结果相一致。但β多样性(样本间微生物组成差异)在两组之间的微生物群落组成中显示出显著的群落水平分离, 精神分裂症组显著降低。赵星梅等人(2019)的研究也发现, 精神分裂症患者的肠道微生物构成的多样性与健康对照组相比存在统计学差异, 其α多样性的Ace指数、Chao1指数、Shannon指数患者组显著低于健康组, 而Simpson指数明显高于健康对照组, 并且Manchia等人(2021)的研究也发现精神分裂症患者肠道菌群的α多样性指数显著低于健康对照。
2.1.2 相对丰度的差异
除多样性存在差异外, 精神分裂症患者的肠道微生物构成的相对丰度与正常人相比也存在显著差异。以往研究发现精神分裂症患者与健康人的肠道微生物构成的相对丰度存在显著差异的具体表现为:在门水平上, 精神分裂症患者肠道内的放线菌门和变形菌门显著增加, 而拟杆菌门和厚壁菌门显著降低(Li et al., 2020; Xu et al., 2020; 赵星梅等, 2019), 但Nguyen等人(2019)的研究则发现精神分裂症患者的变形菌门的丰度相较对照组降低。在科水平上, Schwarz等人(2018)发现精神分裂症患者肠道内乳杆菌科、Halothiobacillaceae、布鲁氏菌科和微球菌科的相对丰度显著增加, 而韦氏球菌科的相对丰度显著降低。Xu等人(2020)发现精神分裂患者肠道内的鞘氨醇科相对丰度增加, 产碱杆菌科, 肠球菌科, 明串珠科, 红串珠科的相对丰度降低。在属水平上, 不同的研究之间的结果指向不同类别的菌属。其中, Shen等人(2018)的研究发现, 与健康对照相比, 琥珀酰菌、巨球孢菌、柯林塞拉菌、梭状芽孢杆菌、克雷伯氏菌和甲烷菌的相对丰度显著较高, 而布拉氏菌、粪球菌、玫瑰菌的丰度则较低。赵星梅等人(2019)的一个小样本的研究发现, 精神分裂症患者的双歧杆菌属、普雷沃菌属和巨单胞菌的相对丰度显著高于健康对照组, 而拟杆菌属和梭菌属的相对丰度显著低于健康对照。Nguyen等人(2019)发现, 相较与对照组, 精神分裂症患者肠道内厌氧球菌属相对丰度显著增加, 而流感嗜血杆菌属、萨特氏菌属和梭菌属的相对丰度显著降低。Xu等人(2020)研究发现, 精神分裂症患者的放线菌目、鞘氨醇目和鞘氨醇科、埃格氏菌属以及巨球孢菌属的相对丰度增加, 红串珠目、产碱杆菌科等菌属的相对丰度显著降低。Li等人(2020)的研究也发现精神分裂症患者的乳球菌属和粪链球菌属的相对丰度显著降低。最新一项研究发现, 与健康对照相比, 精神分裂症患者存在某些肠道菌群的缺失, 如门水平的蓝细菌门, 科水平的巴氏杆菌科、cytophagaceae和morganellaceae, 属水平的醋酸杆菌属、嗜血杆菌属、Turicibacter, Obesumbacterium等, 以及种水平的马链球菌种、粪球菌种、血链球菌种等, 而这些菌群在正常对照组中为相对丰度较高的菌群(Manchia et al., 2021)。
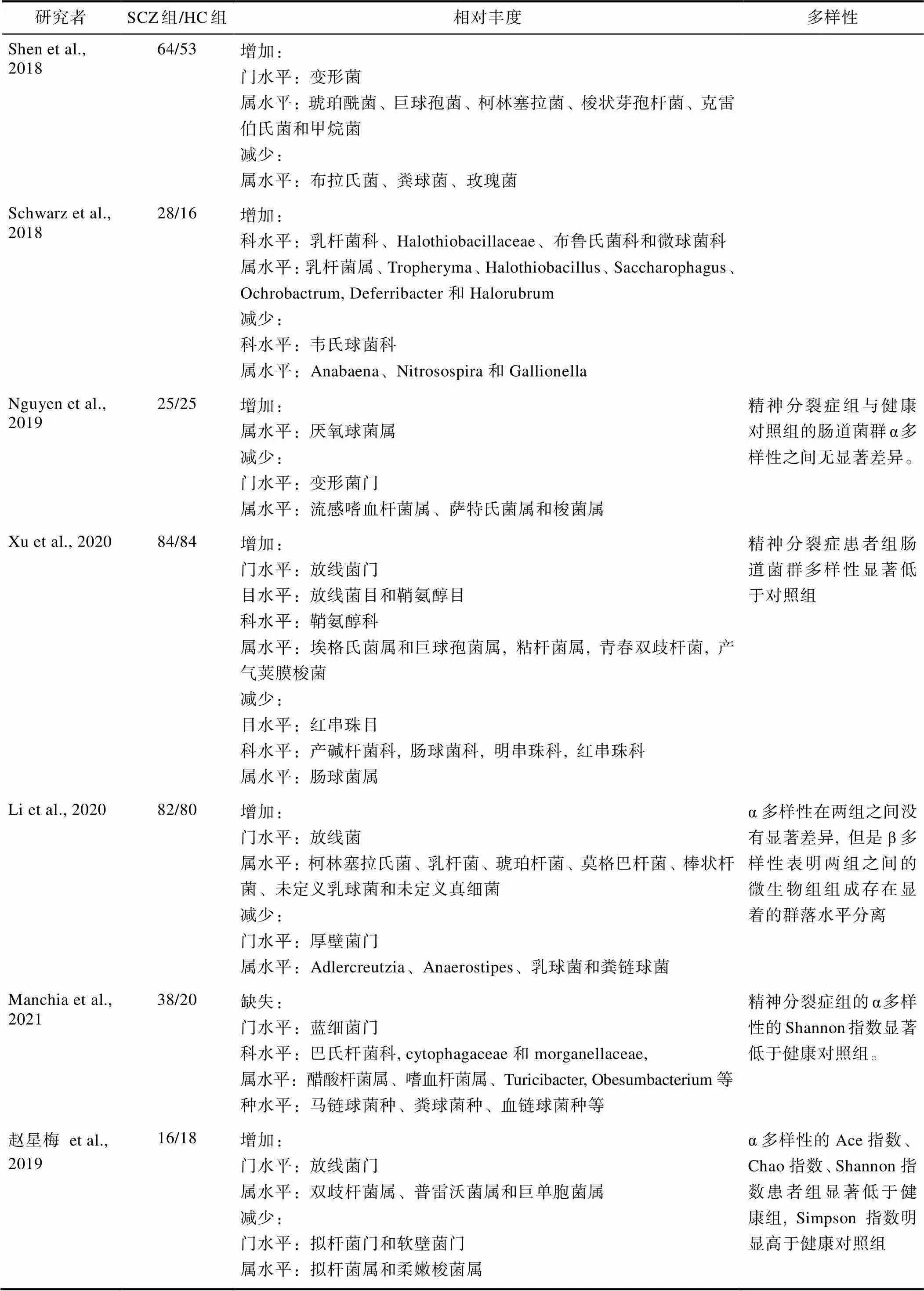
表1 精神分裂症患者与正常人肠道微生物构成差异性的研究结果总结
注:SCH, 精神分裂症; HC, 健康对照; α多样性, 单个样本中的微生物多样性; β多样性, 样本间微生物组成差异; Ace指数, 评估样本中物种组成的丰富度和均匀度; Chao指数, 估算样本中OUT数目的指数。
2.2 精神分裂症患者肠道微生物差异的原因及其应用
精神分裂症患者的肠道微生物差异受多方面因素影响。一方面, 精神分裂症患者的肠道微生物来源于早期的定植, 主要来源有产道菌群、分娩环境的菌群以及母乳菌群(Ferretti et al., 2018; Singh et al., 2017)。这些早期定植的肠道微生物在精神分裂症患者的肠道内具有一定的结构稳定性, 长期影响宿主的中枢神经系统和免疫系统的功能, 造成精神分裂症的个体易感性, 并与正常个体的肠道微生物结构之间存在显著差异。另一方面, 造成精神分裂症患者肠道菌群差异的一个重要因素是炎症反应。一些临床研究发现, 精神分裂症患者的免疫功能异常升高, 血液和大脑中都出现异常升高的促炎性细胞因子, 全身处于低度炎症状态(Cai et al., 2020; Pedraz-Petrozzi et al., 2020; Upthegrove & Khandaker, 2019)。弥漫性低度炎症作用于肠道, 引起肠道菌群生态的多样性降低。这一过程并非是单向的, 产生具有抗炎作用的短链脂肪酸(SCFA)的梭状杆菌受炎症影响, 导致SCFA的产生减少, 反过来又强化了炎症状态(Morgan et al., 2012)。此外, 抗精神病药物也会对精神分裂症患者的肠道微生物产生重要影响。一项研究发现, 接受抗精神病药物治疗效果较差的患者, 其肠道菌群也表现出较大差异, 其中乳酸杆菌科在精神分裂症患者不同治疗效果亚组中变化差异最大, 治疗后患者肠道的乳酸杆菌的数量与精神分裂症症状的严重程度成正相关(Schwarz et al., 2018)。现有的研究结果证明了肠道微生物的异常普遍存在于精神分裂症患者中, 并且部分研究已经表明某些肠道微生物可以作为区分精神分裂症患者与健康群体的生物标记物, 但其他外部因素以及治疗(例如抗精神病药物)对精神分裂症患者肠道微生物的影响还需进一步探究。
肠道微生物异常指标应用于精神分裂症的诊断方面, Shen等人(2018)发现12种肠道微生物群可以用作生物标志物来区分精神分裂症患者与对照组, 其中包括纲水平的Gammaproteobacteria, 目水平的Enterobacteriales以及种水平的Bacteroides fragilis。另一项小鼠模型的研究的结果显示, 双歧杆菌科, 布鲁氏菌科, 巴氏杆菌科, Aerococcaceae和Rikenellaceae等肠道菌群足以区分患者组和对照组(Zheng et al., 2019)。但精神分裂症患者与正常人肠道微生物的差异, 能否为辅助诊断和治疗精神分裂症提供新的方法和角度, 还需要进行更大范围的纵向研究, 以推论因果关系。此外, 在肠道微生物与精神分裂症诊断指标的关系上, 有证据表明, 精神分裂症患者肠道微生物群构成的紊乱(包括微生物多样性指数的下降), 与特定的精神分裂症表型、症状严重程度、大脑结构和功能异常、认知功能缺陷以及治疗反应等指标有关(Bioque et al., 2020; Guo et al., 2021; Zeng et al., 2021)。其中, 大脑结构和认知功能作为精神分裂症重要的评估指标, 与肠道微生物的关系越来越受到关注。
3 精神分裂症患者的肠道微生物与脑影像
3.1 肠道微生物与大脑结构和功能关系
肠道微生物与个体大脑结构和功能之间可能存在联系, 除了前文所述的肠道菌群早期定植和免疫介导的微生物−肠−脑轴对中枢神经系统的影响的相关证据之外, 在小鼠模型和健康人群中的研究结果也支持了这一假设(Tillisch et al., 2017; Ong et al., 2018)。以往研究结果显示, 在以小鼠为研究对象的实验中, Ong等人(2018)对标准饮食(对照组)、高脂饮食、高纤维饮食和高蛋白低碳水饮食四组小鼠大脑进行弥散张量成像(DTI)的数据采集, 并对小鼠粪便的V3-V4片段进行16S rRNA基因测序。结果显示, 不同饮食小鼠的潜在白质结构完整性发生了显著变化, 进一步的结果分析证明了微生物组可以潜在地预测小鼠白质结构完整性的变化。在一项以健康人为对象的研究中, Tillisch等人(2017)对40名健康女性进行了粪便样本的16S rRNA分析, 同时获得大脑磁共振成像数据。肠道微生物的结果确定了两组高相对丰度的组别:高拟杆菌组和高普氏杆菌组。在情绪诱导任务中, 负性情绪图片对高普氏杆菌组有显著负面影响, 而正性情绪图片对两组影响无显著差异。高普氏杆菌组被试在负性图片的观察过程中, 海马体 (与情绪调节有关的脑区) 体积较小的被试对刺激的反应较大, 海马体体积的减少可能与情绪唤醒增加有关。这些结果显示了肠道微生物与大脑结构和功能之间存在一定的联系, 占据大多数的厚壁菌和拟杆菌相对丰度的变化, 可能与特定区域的大脑体积有关。
3.2 精神分裂症患者的肠道微生物与大脑结构和功能的关系
如前所述, 肠道微生物可以通过微生物−肠−脑轴对大脑结构和功能产生影响, 这种影响同样也存在于精神分裂症患者中。当前研究结果显示, 某些与肠道微生物有关的生物标志物的水平与精神分裂症患者的区域脑容量异常有关, 例如犬尿氨酸与色氨酸的比率与大脑背外侧前额叶的体积减小有关系, 血清中脑源性神经营养因子(BDNF)水平与双侧海马体积相关(Ahmed et al., 2021; Kindler et al., 2020)。目前, 有关精神分裂症患者的肠道微生物构成与大脑结构和大脑功能关系的研究还较少, 但已有的研究已经发现两者之间存在相关的证据。我们在中国知网、万方、维普网数据库将关键词“精神分裂症”、“精神疾病”与“肠道微生物”、“肠道菌群”以及“脑结构”“脑功能”“脑灰质”“脑白质”、“MRI”、“DTI”进行匹配检索, 接着将关键词:“schizophrenia”、“Psychiatry”与“gut microbiome”、“gut microbiota”、“gastrointestinal microbiome”、“gastrointestinal microbiota”以及“brain structure”、“brain function”、“brain imaging”、“grey matter”、“white matter”、“MRI”、“DTI”进行匹配, 在Web of Science、Pub Med、Cochrane Library和Science Direct数据库中检索, 搜索篇名、关键词及摘要中包含此类关键词的期刊与论文, 检索截止日期为2021年12月。检索结果发现了三项符合纳入标准的实证研究(表2)。
这些研究一致地发现精神分裂症患者肠道菌群中放线菌门及其部分下属菌群的相对丰度显著上升, 另外也包括变形菌门及其部分下属菌群, 这与之前的研究结果一致(Li et al., 2020; Shen et al., 2018; Xu et al., 2020; 赵星梅等, 2019)。神经影像的结果显示精神分裂症患者的肠道微生物与大脑之间存在联系主要体现在大脑结构和大脑功能这两个方面。
3.2.1 肠道微生物与大脑结构的关系
在肠道微生物与大脑结构的关系上, 现有研究主要发现了肠道微生物的构成与大脑区域灰质体积的关系。在肠道微生物构成的相对丰度上, Ma等人(2020)的一项探索性研究分析发现, 首发的精神分裂症患者的大肠埃希菌、放线杆菌和梭状杆菌的相对丰度, 相较于与正常健康被试的肠道菌群减少, 且存在显著差异。除此之外, 长期服药的精神分裂症患者的消化链球菌和韦氏球菌的相对丰度显著增加, 这表明抗精神病药对肠道微生物的改变存在一定影响。进一步的分析发现放线杆菌和韦氏球菌的相对丰度与首发精神分裂症患者异常的右侧额中回的灰质体积呈正相关, 而在长期服药的精神分裂症患者中未发现这种相关。这暗示了精神分裂症患者肠道微生物组与大脑结构之间存在联系, 且这种联系会受到抗精神病药物的影响。在肠道微生物构成的多样性上, 最新一项有关精神分裂症患者肠道微生物与大脑结构关系的研究发现, 精神分裂症患者的肠道微生物的α多样性与脑岛、岛盖部额下回、右侧中央后回的灰质体积呈显著正相关(Li et al., 2021)。
3.2.2 肠道微生物与大脑功能的关系
在肠道微生物与大脑功能的关系上, 吴位东(2019)基于静息态功能磁共振成像的血氧水平依赖性反应信号中低频部分信号的平均强度(ALFF值)和区域同质性指数(ReHo值), 探究了精神分裂症患者的大脑功能与肠道内相对丰度显著增加的肠道微生物之间的关系。结果显示, 放线菌属和韦氏菌属的相对丰度与大脑外侧前额叶、右侧额中回的ALFF值呈显著正相关, 梭菌目的氨基酸球菌的相对丰度与枕叶的ALFF值呈正相关, 而与颞叶呈显著负相关。基于ReHo值与肠道菌群的相关性分析发现, 精神分裂症患者放线菌门和红蝽菌纲的相对丰度与背外侧前额叶的ReHo值呈显著正相关, 而与颞下回、颞中回呈负相关。这些结果提示精神分裂症患者的肠道微生物与大脑功能的关联性更多地体现在额叶和颞叶, 这些脑区主要负责躯体运动、语言、记忆等活动。除此之外, 精神分裂症患者显著增加的肠道微生物红蝽菌与背侧前额叶、感觉运动皮层呈显著正相关、与内侧额上回、颞叶呈显著负相关, 而背侧前额叶功能的异常与精神分裂症患者的阴性症状和认知损害有关。已知大多数红蝽菌属于致病菌, 且红蝽菌纲的Collinsclla与直肠癌的发病有关。这提示了精神分裂症患者肠道菌群中的红蝽菌纲丰度的增加可能是精神分裂症发病的一个诱因。Li等人(2021)则探究了精神分裂症患者肠道微生物构成多样性与大脑功能的关系, 结果显示, 精神分裂症患者肠道微生物α多样性的香农指数, 与双侧大脑皮层、双侧舌回、左侧枕上皮层和右侧顶上皮层的ReHo值呈正相关。肠道微生物α多样性的均匀度与大脑右侧楔叶、双侧梭状回、左侧中央后回和左侧顶叶皮层的ReHo值呈正相关, 这些结果提示精神分裂症患者的脑功能异常可能与肠道微生物α多样性改变有关。
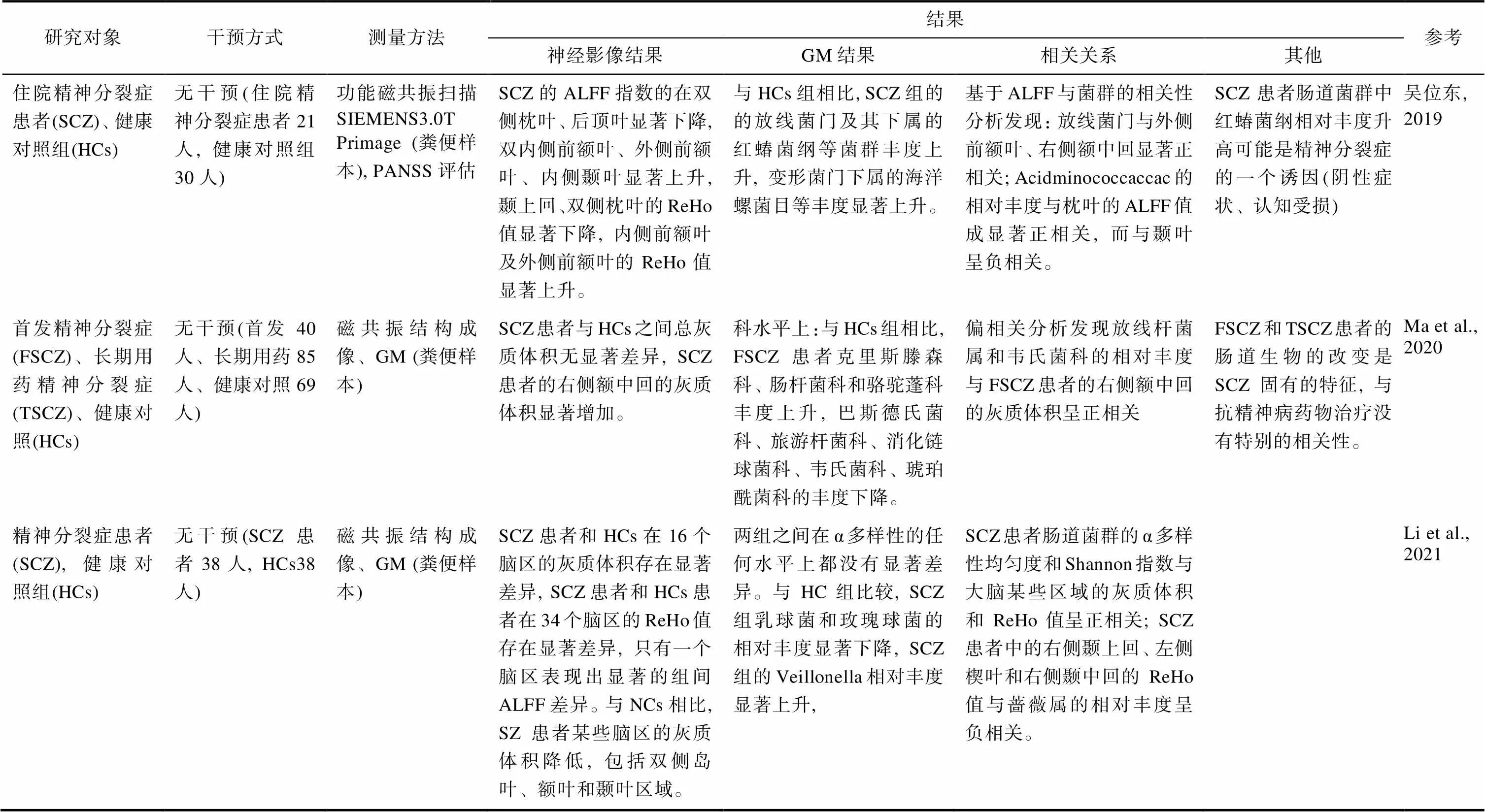
表2 精神分裂症患者肠道微生物与脑影像相关性研究结果总结
注:GM, 肠道微生物; ALFF, 反应每个体素的BOLD信号中低频部分信号的平均强度; ReHo指数, 测量的是某个体素和周围体素时间信号的一致性。
3.3 肠道微生物群影响精神分裂症患者大脑结构的机制假设
以上证据表明, 肠道微生物在精神分裂症中的潜在作用与大脑结构的改变有关。虽然精神分裂症患者的肠道微生物作用于大脑结构的具体方式还不明确, 但现有证据揭示了这种影响的可能性。已知精神分裂症患者存在严重的神经递质失调, 并且个体中枢神经系统的发育与神经递质的水平有关, 而肠道微生物具有识别和产生化学物质的能力, 可以通过多种途径作用于神经系统(Jameson & Hsiao, 2018)。肠道微生物的代谢产物中包括了许多重要的神经递质以及合成神经递质的前体(Strandwitz, 2018; Williams et al., 2014)。虽然肠道微生物产生的神经递质大多不能穿过血脑屏障, 但其产生的神经递质前体, 如色氨酸和酪氨酸, 可以突破肠脑屏障, 影响大脑内血清素和多巴胺水平(Jameson & Hsiao, 2018)。血清素和多巴胺水平的紊乱也常见于精神分裂症等精神疾病(Stępnicki et al., 2018)。这种紊乱可能是肠道微生物在精神分裂症病理过程中发挥作用的一种可能的机制途径(Zhang et al., 2015)。在肠道微生物对神经发育影响的临床结果支持下, 本文根据肠道微生物影响精神分裂症患者大脑结构的证据提出以下机制假设(见图1)。
首先, 免疫介导通路可能是肠道微生物影响精神分裂症患者大脑结构的重要通路。肠道微生物的失调可能会导致炎性介质的增加和保护介质的减少, 从而导致神经元和突触的损伤, 成为精神分裂症患者大脑结构异常的潜在影响因素。肠道微生物产生的炎症因子可以直接作用于大脑或激活下丘脑−垂体−肾上腺轴(HPA) (Rodrigues- Amorim et al., 2018)。研究证据表明, 拟杆菌干预治疗可通过降低肠道通透性来减弱大鼠对束缚应激的HPA轴反应(Ait-Belgnaoui et al., 2012)。原核微生物和真核微生物会产生多种神经激素的受体, 肠道微生物群能够生产生物活性内分泌激素多巴胺和去甲肾上腺素, 其数量足以影响宿主神经生理活动(Jadhav et al., 2018; El Aidy et al., 2017)。还有研究发现, 移植精神分裂症患者粪便的无菌小鼠, 前额叶皮层中基底细胞外多巴胺和海马体中的五羟色胺水平的增加, 并出现了精神活动亢进的症状(Zhu, Guo et al., 2020)。
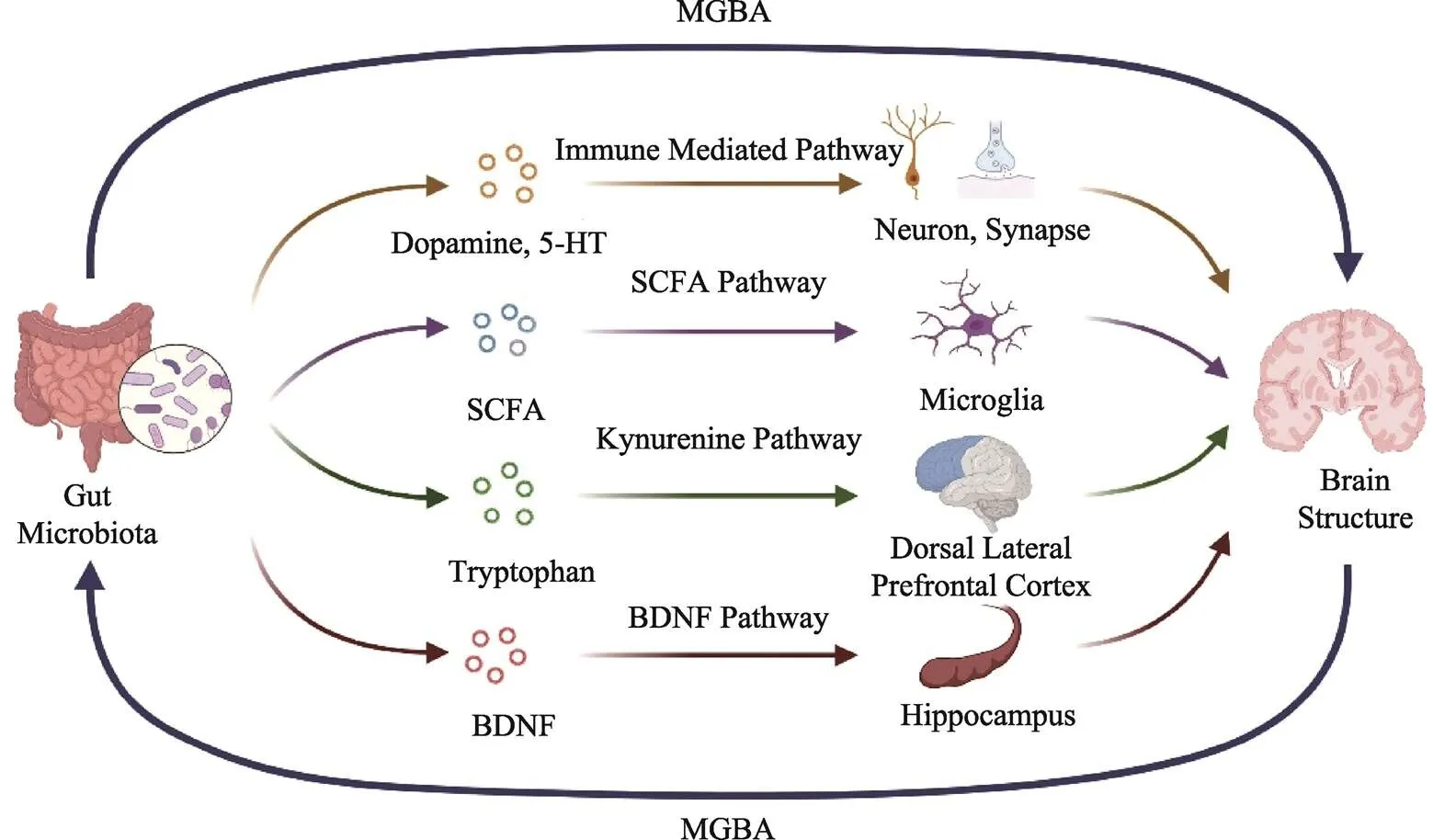
图1 精神分裂症患者肠道微生物作用于大脑结构的机制假设
注:MGBA, 微生物−肠−脑轴; Gut Microbiota, 肠道微生物; Dopamine, 多巴胺; 5-HT, 五羟色胺; Neuron, 神经元; Synapse, 突触; Microglia, 小胶质细胞; Tryptophan, 色氨酸; Kynurenine Pathway, 犬尿氨酸通路; Dorsal Lateral Prefrontal Cortex, 背外侧前额叶; Hippocampus, 海马体; Brain Structure, 大脑结构; SCFA, 短链脂肪酸; BDNF, 脑源性神经营养因子
其次, SCFA通路是也可能在肠道微生物对精神分裂症患者大脑结构的影响中起重要作用。SCFA被认为在神经免疫内分泌调节中具有重要作用, 包括乙酸盐、丙酸盐和丁酸盐, 主要由肠道微生物代谢合成产生。精神分裂症患者肠道微生物α多样性增加, 与血清中的SCFA的浓度呈正相关, 同时表现出免疫激活水平的升高(Zhu, Ju et al., 2020)。除此之外, 醋酸盐、丙酸盐等SCFA水平的异常会引起广泛的代谢和神经功能紊乱, 特别是会影响小胶质细胞的成熟(Bauer et al., 2019)。
此外, 犬尿氨酸通路也是肠道微生物影响精神分裂症患者大脑结构的重要通路。肠道微生物可以参与色氨酸代谢, 影响精神分裂症患者的中枢神经系统的功能, 通过犬尿氨酸途径, 肠道微生物可以影响脑内5-羟色胺的水平, 进一步影响情绪和认知功能的调节(Jenkins et al., 2016)。无菌小鼠移植精神分裂症患者的粪菌后, 在前额叶皮层样本中观察到细胞外多巴胺浓度的增加, 血清素水平升高。这种通过激活犬尿氨酸途径诱导的色氨酸代谢失调是小鼠出现精神分裂样行为的原因(Chiappelli et al., 2014)。Kindler等人(2020)发现, 在精神分裂症患者的前额叶皮层中, 犬尿氨酸与色氨酸的比率显著高于正常对照组, 并与背外侧前额叶体积呈负相关。这可能是促炎因子引起外周的色氨酸转化为犬尿氨酸, 影响星形胶质细胞酶的合成活性, 导致背外侧前额叶体积的损失, 造成注意力的损害。而肠道微生物可调节95%的肠道色氨酸通过犬尿氨酸途径进行代谢, 这一过程在大脑的犬尿氨酸的合成中起重要作用, 进而影响精神分裂症患者的脑结构和认知功能(Schwarcz et al., 2012; Wang et al., 2019; Zhu, Guo et al., 2020)。
最后一条重要通路是BDNF通路。肠道微生物衍生的代谢产物可能会影响BDNF和其它认知中重要的蛋白质在中枢神经系统的表达, 进而影响宿主行为(Munawar et al., 2021; Rogers et al., 2016)。BDNF是大脑神经发育过程中重要的神经营养因子, 参与神经元髓鞘的形成和突触的修剪(Lv et al., 2017)。精神分裂症通常伴随着BDNF的改变, 患者海马体和血浆中均可见BDNF水平的下降, 这与学习和记忆等认知功能障碍有关(Man et al., 2018)。Ahmed等人(2021)的一项研究发现, 精神分裂症患者血清中BDNF水平与左右侧海马体存在显著相关, 并且结果提示了精神分裂症患者脑容量与BDNF水平关联的证据。虽然当前研究结果未直接证实BDNF通路在精神分裂症患者的肠道微生物和脑结构之间的作用, 但已有研究发现肠道微生物可通过影响海马体区域的络氨酸激酶受体B (TrkB)的水平和BDNF的水平来影响罹患精神分裂症的风险(Gupta & Hoffman, 2021)。未来研究可在检查精神分裂症患者肠道微生物结构(或单个微生物种, 如乳酸杆菌)与BDNF水平之间相关性的同时, 对患者的脑结构也进行检查, 以探究精神分裂症患者肠道微生物构成与脑结构如何受BDNF通路的影响。
4 精神分裂症患者的肠道微生物与临床表征的联系
认知功能损伤在精神分裂患者中, 是除阳性症状和阴性症状外的第三大症状群(Meltzer & McGurk, 1999)。精神分裂症患者的认知功能损伤包括较差的社会认知功能和个人认知功能, 主要体现在注意、记忆、语言、执行功能和思维等方面的障碍(Fett et al., 2011; Green et al., 2019)。虽然当前抗精神病药物对精神分裂症患者的阳性和阴性症状的治疗效果较好, 但对患者的认知功能损伤没有较好的治疗效果, 因此需要进一步探究精神分裂症患者认知功能损伤的原因(Hori et al., 2006)。目前研究发现, 在精神分裂症的早期阶段, 认知功能的损伤被认为与炎症过程有关, 而肠道微生物可通过影响糖皮质激素和免疫介质的产生参与这一过程(Cabrera et al., 2016; Cussotto et al., 2018)。大脑多个脑区的异常激活、脑结构的异常被认为与认知功能的受损以及临床症状有关, 以往的研究报告了肠道微生物可能参与了精神分裂症发病的几种神经发育途径, 表明肠道微生物构成与精神分裂症认知功能损伤以及临床症状之间的联系可以由MGBA理论进行解释(Sharon et al., 2016)。另外, 遗传基础、脑源性营养因子和免疫功能异常都被认为与精神分裂症的认知功能的损伤有关, 而肠道微生物影响BDNF和免疫功能的通路暗示了其与认知功能损伤之间的可能联系(Rogers et al., 2016; Zheng et al., 2019)。
现有研究结果显示精神分裂症患者的肠道微生物与认知功能之间存在联系(Schwarz et al., 2018; He et al., 2018; Li et al., 2021)。在一项临床研究中, Schwarz等人(2018)发现, 与健康对照组相比, 首发精神分裂症患者肠道内乳酸杆菌的数量显著升高, 并且与心理社会功能评分呈负相关。He等人(2018)针对高危和超高危精神分裂症群体的研究发现, 肠道菌群聚类分析异质性较强的一组被试的功能大体评估量表(GAF-M)的得分较低。Li等人(2021)研究发现, 精神分裂症患者的感知觉障碍与肠道菌群的α多样性改变有关, 比如, 精神分裂症患者肠道菌群的α多样性可能与幻视有关, 这种关系可能由距状裂的功能性大脑活动所介导。
此外, 现有研究也发现精神分裂症患者的肠道微生物构成与临床症状之间也存在联系。He等人(2018)在一项针对高危和超高危精神分裂症群体的研究时发现, 按肠道菌群聚类分析将研究对象分为聚类外和聚类内两组后, 肠道菌群聚类外的一组被试的精神分裂症的阳性症状、阴性症状以及分离性症状的得分较高。Schwarz等人(2018)的研究也发现精神分裂症患者的某些肠道菌群的数量与精神分裂症症状的严重程度呈显著正相关, 这些菌群包括乳杆菌属、乳酸杆菌科、乳球菌科和拟杆菌属。Yuan等人(2021)在研究精神分裂症患者的肠道微生物与临床症状之间的关系时也发现, 拉克氏菌属和厚壁菌门的相对丰度与被试的阴性症状(PANSS-FSNS)评分显著正相关。这些证据表明, 精神分裂症患者肠道内某些菌属的相对丰度的增加与精神分裂症的临床症状有关。
5 未来研究方向
根据微生物−肠−脑轴理论以及相关研究证据, 我们已知精神分裂症患者肠道微生物的异常与大脑结构和功能的联系可追溯到生命早期, 并且在之后的时期肠道微生物对大脑的影响一直存在。以往的研究聚焦于横断面的相关研究, 仅能探索两者之间的相关性。因此, 需要进一步的纵向研究来更好地揭示这两者之间的因果关系。在研究对象上, 鉴于精神分裂症的高风险人群在精神分裂症的预防和早期治疗中的重要作用, 我们可对精神分裂症的高危人群进行进一步的研究。尽管相关研究初步揭示了特定的肠道微生物群与精神分裂症患者的特定脑区的联系, 但由于研究样本量较少, 且受样本地域因素的影响, 研究结果较难统一, 因此需要进行大样本的研究来进行验证, 并寻找合适的测量指标, 进行数据统计的标准化, 为精神分裂症的综合诊断提供辅助手段。此外, 研究精神分裂症患者的大脑结构必然要与认知功能联系起来, 且认知功能损伤如记忆损伤并不随着精神分裂症症状的好转而恢复, 这种不可逆的损伤与肠道微生物之间是否存在联系仍需要进一步探究(Guo et al., 2019)。
另外, 以往对精神分裂症的预防和治疗方案制定, 大多依据基于多巴胺假说和五羟色胺假说, 在治疗效果上存在较多不足 (例如对认知功能损伤无明显疗效), 并且存在病情反复和严重的副作用的问题(Seeman, 2021; Stahl, 2018; Cadinu et al., 2018; MacKenzie et al., 2018; Gillespie et al., 2017)。而基于微生物−肠−脑轴假说的精神分裂症的微生物治疗现已初步应用, 在缓解传统抗精神病药物副作用方面有一定的效果, 如治疗精神分裂症常伴的胃肠道疾病(Dickerson et al., 2014)。此外, 使用益生菌和益生元的治疗虽然在改善精神分裂症的阳性、阴性症状上不显著, 但可辅助用于认知功能损伤的治疗(Mörkl et al., 2020; Ng et al., 2019; Szeligowski et al., 2020)。目前对肠道微生物进行干预治疗精神分裂症的方式还处在初步阶段, 因此需要探索更多具体的治疗方案进行临床干预的研究, 以进一步探究肠道微生物作用于精神分裂症大脑结构和功能以及临床表征的具体方式, 并为精神分裂症的预防和治疗提供更综合全面的方案。
6 结论
本文回顾了近几年有关精神分裂症患者肠道微生物的异常及其与大脑结构和功能关系的研究, 以及与临床表征关系的研究, 主要有以下几点发现:1) 在肠道微生物构成的差异方面, 精神分裂症患者肠道微生物与正常人的差异表现在微生物多样性的降低和重要菌群的相对丰度变化, 这种异常主要由精神分裂症引起的低水平炎症反应导致, 首发精神分裂症患者的肠道微生物的研究验证了这一观点。此外, 抗精神病药物的对肠道菌群存在一定影响, 但很难引起微生物构成的变化; 2) 在肠道微生物与大脑结构和大脑功能的关系上, 精神分裂症患者肠道菌群的相对丰度和多样性与异常脑区的灰质体积之间存在联系, 如放线杆菌和韦氏球菌的相对丰度与首发精神分裂症患者异常的右侧额中回的灰质体积呈正相关, 并且精神分裂症患者的大脑影像结果显示脑功能异常可能与肠道微生物α多样性改变有关; 3) 在肠道微生物影响精神分裂症大脑结构的机制假设上, 本文提出肠道微生物可能通过免疫介导通路、SCFA通路、犬尿氨酸通路和BDNF通路影响精神分裂症患者大脑结构; 4) 在肠道微生物与认知功能和临床症状的关系上, 精神分裂症患者肠道内的乳酸杆菌的相对丰度与认知功能的损伤和临床症状之间存在显著正相关, 并且肠道菌群的α多样性的改变可能与精神分裂症患者的幻视症状有关。
吴位东. (2019).(硕士学位论文). 内蒙古医科大学.
赵星梅, 王喜苹, 周火祥, 张红梅, 王秀丽, 罗予, 郭葳. (2019). 基于高通量测序的精神分裂症患者肠道菌群多样性.,(1), 1–7.
Ahmed, A. O., Kramer, S., Hofman, N., Flynn, J., Hansen, M., Martin, V., Pillai, A., & Buckley, P. F. (2021). A meta-analysis of brain-derived neurotrophic factor effects on brain volume in schizophrenia: Genotype and serum levels.,(5), 411–424.
Ait-Belgnaoui, A., Durand, H., Cartier, C., Chaumaz, G., Eutamene, H., Ferrier, L., Houdeau, E., Fioramonti, J., Bueno, L., & Theodorou, V. (2012). Prevention of gut leakiness by a probiotic treatment leads to attenuated HPA response to an acute psychological stress in rats.,(11), 1885–1895.
Bauer, K. C., Rees, T., & Finlay, B. B. (2019). The gut microbiota–brain axis expands neurologic function: A nervous rapport.(10), e1800268. https://doi. org/10.1002/bies.201800268
Bioque, M., González-Rodríguez, A., Garcia-Rizo, C., Cobo, J., Monreal, J. A., Usall, J., Soria, V., Labad, J., & Group, P. (2020). Targeting the microbiome-gut-brain axis for improving cognition in schizophrenia and major mood disorders: A narrative review.,, Article 110130. https://doi.org/10.1016/j.pnpbp.2020.110130
Cabrera, B., Bioque, M., Penadés, R., González-Pinto, A., Parellada, M., Bobes, J., Lobo, A., García-Bueno, B., Leza, J., & Bernardo, M. (2016). Cognition and psychopathology in first-episode psychosis: Are they related to inflammation?(10), 2133–2144.
Cadinu, D., Grayson, B., Podda, G., Harte, M. K., Doostdar, N., & Neill, J. C. (2018). NMDA receptor antagonist rodent models for cognition in schizophrenia and identification of novel drug treatments, an update.(11)41–62.
Cai, H. Q., Catts, V. S., Webster, M. J., Galletly, C., Liu, D., O’Donnell, M., Weickert, T. W., & Weickert, C. S. (2020). Increased macrophages and changed brain endothelial cell gene expression in the frontal cortex of people with schizophrenia displaying inflammation.(4), 761–775.
Chiappelli, J., Pocivavsek, A., Nugent, K. L., Notarangelo, F. M., Kochunov, P., Rowland, L. M., Schwarcz, R., & Hong, L. E. (2014). Stress-induced increase in kynurenic acid as a potential biomarker for patients with schizophrenia and distress intolerance.(7), 761–768.
Cussotto, S., Sandhu, K. V., Dinan, T. G., & Cryan, J. F. (2018). The neuroendocrinology of the microbiota-gut- brain axis: A behavioural perspective.,(4), 80–101.
Dickerson, F. B., Stallings, C., Origoni, A., Katsafanas, E., Savage, C. L., Schweinfurth, L. A., Goga, J., Khushalani, S., & Yolken, R. H. (2014). Effect of probiotic supplementation on schizophrenia symptoms and association with gastrointestinal functioning: A randomized, placebo-controlled trial(1), Article 13m01579. https://doi.org/ 10.4088/PCC.13m01579
El Aidy, S., Ramsteijn, A. S., Dini-Andreote, F., van Eijk, R., Houwing, D. J., Salles, J. F., & Olivier, J. D. (2017). Serotonin transporter genotype modulates the gut microbiota composition in young rats, an effect augmented by early life stress.,, Article 222. https://doi.org/10.3389/fncel.2017.00222
Ferretti, P., Pasolli, E., Tett, A., Asnicar, F., Gorfer, V., Fedi, S., … Segata, N. (2018). Mother-to-infant microbial transmission from different body sites shapes the developing infant gut microbiome.(1), 133–145.e5.
Fett, A.-K. J., Viechtbauer, W., Dominguez, M.-D.-G., Penn, D. L., van Os, J., & Krabbendam, L. (2011). The relationship between neurocognition and social cognition with functional outcomes in schizophrenia: A meta- analysis.,(3), 573–588.
Foster, J. A., & Neufeld, K.-A. M. (2013). Gut–brain axis: How the microbiome influences anxiety and depression.(5), 305–312.
Gillespie, A. L., Samanaite, R., Mill, J., Egerton, A., & MacCabe, J. H. (2017). Is treatment-resistant schizophreniacategorically distinct from treatment-responsive schizophrenia? A systematic review.(1), 1–14.
Green, M. F., Horan, W. P., & Lee, J. (2019). Nonsocial and social cognition in schizophrenia: Current evidence and future directions.,(2), 146–161.
Guo, J., Ragland, J. D., & Carter, C. S. (2019). Memory and cognition in schizophrenia.(5), 633–642.
Guo, L., Xiao, P., Zhang, X., Yang, Y., Yang, M., Wang, T., Lu, H., Tian, H., Wang, H., & Liu, J. (2021). Inulin ameliorates schizophrenia via modulation of the gut microbiota and anti-inflammation in mice.(3), 1156–1175.
Gupta, L., & Hoffman, K. W. (2021). Exploring the intersection of the microbiome and the developing brain: Impacts on schizophrenia risk.Advance online publication. https://doi.org/10.1016/j. schres.2021.08.010
He, Y., Kosciolek, T., Tang, J., Zhou, Y., Li, Z., Ma, X., Zhu, Q., Yuan, N., Yuan, L., Li, C., Jin, K., Knight, R., Tsuang, M. T., & Chen, X. (2018). Gut microbiome and magnetic resonance spectroscopy study of subjects at ultra-high risk for psychosis may support the membrane hypothesis.(5), 37–45.
Heijtz, R. D., Wang, S., Anuar, F., Qian, Y., Björkholm, B., Samuelsson, A., Hibberd, M. L., Forssberg, H., & Pettersson, S. (2011). Normal gut microbiota modulates brain development and behavior.(7), 3047–3052.
Hori, H., Noguchi, H., Hashimoto, R., Nakabayashi, T., Omori, M., Takahashi, S., … Kunugi, H. (2006). Antipsychotic medication and cognitive function in schizophrenia.(1–3), 138–146.
Insel, T. R. (2010). Rethinking schizophrenia.(7321), 187–193.
Jadhav, K. S., Peterson, V. L., Halfon, O., Ahern, G., Fouhy, F., Stanton, C., Dinan, T. G., Cryan, J. F., & Boutrel, B. (2018). Gut microbiome correlates with altered striatal dopamine receptor expression in a model of compulsive alcohol seeking.,(8), 249–259.
Jameson, K. G., & Hsiao, E. Y. (2018). Linking the gut microbiota to a brain neurotransmitter.(7), 413–414.
Jenkins, T. A., Nguyen, J. C., Polglaze, K. E., & Bertrand, P. P. (2016). Influence of tryptophan and serotonin on mood and cognition with a possible role of the gut-brain axis.(1), 56. https://doi.org/10.3390/nu8010056
Jiang, H., Ling, Z., Zhang, Y., Mao, H., Ma, Z., Yin, Y., … Ruan, B. (2015). Altered fecal microbiota composition in patients with major depressive disorder.(3), 186–194.
Kelly, D., Conway, S., & Aminov, R. (2005). Commensal gut bacteria: Mechanisms of immune modulation.(6), 326–333.
Kelly, J. R., Minuto, C., Cryan, J. F., Clarke, G., & Dinan, T. G. (2021). The role of the gut microbiome in the development of schizophrenia.(2)4–23.
Kindler, J., Lim, C. K., Weickert, C. S., Boerrigter, D., Galletly, C., Liu, D., … Weickert, T. W. (2020). Dysregulation of kynurenine metabolism is related to proinflammatory cytokines, attention, and prefrontal cortex volume in schizophrenia.(11), 2860–2872.
Li, Q., Han, Y., Dy, A. B. C., & Hagerman, R. J. (2017). The gut microbiota and autism spectrum disorders., Article 120. https://doi.org/ 10.3389/fncel.2017.00120
Li, S., Song, J., Ke, P., Kong, L., Lei, B., Zhou, J., … Wu, K. (2021). The gut microbiome is associated with brain structure and function in schizophrenia.(1), 9743.
Li, S., Zhuo, M., Huang, X., Huang, Y., Zhou, J., Xiong, D., … Wu, K. (2020). Altered gut microbiota associated with symptom severity in schizophrenia.,, Article 9574. https://doi.org/10.7717/peerj.9574
Lloyd-Price, J., Abu-Ali, G., & Huttenhower, C. (2016). The healthy human microbiome.(1), 51.
Lv, F., Chen, S., Wang, L., Jiang, R., Tian, H., Li, J., Yao, Y., & Zhuo, C. (2017). The role of microbiota in the pathogenesis of schizophrenia and major depressive disorder and the possibility of targeting microbiota as a treatment option.(59), 100899–100907.
Ma, E. L., Smith, A. D., Desai, N., Cheung, L., Hanscom, M., Stoica, B. A., Loane, D. J., Shea-Donohue, T., & Faden, A. I. (2017). Bidirectional brain-gut interactions and chronic pathological changes after traumatic brain injury in mice.(6), 56–69.
Ma, X., Asif, H., Dai, L., He, Y., Zheng, W., Wang, D., … Chen, X. (2020). Alteration of the gut microbiome in first-episode drug-naïve and chronic medicated schizophrenia correlate with regional brain volumes.(2)136–144.
MacKenzie, N. E., Kowalchuk, C., Agarwal, S. M., Costa-Dookhan, K. A., Caravaggio, F., Gerretsen, P., Chintoh, A., Remington, G. J., Taylor, V. H., Müeller, D. J., Graff-Guerrero, D., & Hahn, M. K. (2018). Antipsychotics, metabolic adverse effects, and cognitive function in schizophrenia., Article 622. https://doi.org/10.3389/fpsyt.2018.00622
Man, L., Lv, X., Du, X.-D., Yin, G., Zhu, X., Zhang, Y., Soares, J. C., Yang, X.-N., Chen, X., & Zhang, X. Y. (2018). Cognitive impairments and low BDNF serum levels in first-episode drug-naive patients with schizophrenia.(2)1–6.
Manchia, M., Fontana, A., Panebianco, C., Paribello, P., Arzedi, C., Cossu, E., Garzilli, M., Montis, M. A., Mura, A., Pisanu, C., Congiu, D., Copetti, M., Pinna, F., Pazienza, V., Squassina, A., & Carpiniello, B. (2021). Involvement of gut microbiota in schizophrenia and treatment resistance to antipsychotics.,(8), Article 875 https://doi.org/10.3390/biomedicines9080875
Meltzer, H. Y., & McGurk, S. R. (1999). The effects of clozapine, risperidone, and olanzapine on cognitive function in schizophrenia.(2), 233–256.
Morgan, X. C., Tickle, T. L., Sokol, H., Gevers, D., Devaney, K. L., Ward, D. V., … Huttenhower, C. (2012). Dysfunction of the intestinal microbiome in inflammatory bowel disease and treatment.(9), 1–18.
Mörkl, S., Butler, M. I., Holl, A., Cryan, J. F., & Dinan, T. G. (2020). Probiotics and the microbiota-gut-brain axis: Focus on psychiatry.(3), 171–182.
Munawar, N., Ahsan, K., Muhammad, K., Ahmad, A., Anwar, M. A., Shah, I., Al Ameri, A. K., & Al Mughairbi, F. (2021). Hidden role of gut microbiome dysbiosis in schizophrenia: Antipsychotics or psychobiotics as therapeutics?(14), 7671. https://doi.org/10.3390/ijms22147671
Nemani, K., Ghomi, R. H., McCormick, B., & Fan, X. (2015). Schizophrenia and the gut–brain axis.,(8), 155–160.
Ng, Q. X., Soh, A. Y. S., Venkatanarayanan, N., Ho, C. Y. X., Lim, D. Y., & Yeo, W.-S. (2019). A systematic review of the effect of probiotic supplementation on schizophrenia symptoms.(1), 1–6.
Nguyen, T. T., Kosciolek, T., Maldonado, Y., Daly, R. E., Martin, A. S., McDonald, D., Knight, R., & Jeste, D. V. (2019). Differences in gut microbiome composition between persons with chronic schizophrenia and healthy comparison subjects.(9), 23–29.
Oliphant, K., Ali, M., D’Souza, M., Hughes, P. D., Sulakhe, D., Wang, A. Z., Xie, B., Yeasin, R., Msall, M. E., Andrews, B., & Claud, E. C. (2021). Bacteroidota and Lachnospiraceae integration into the gut microbiome at key time points in early life are linked to infant neurodevelopment.,(1), Article 1997560. https://doi.org/10.1080/19490976.2021.1997560
Ong, I. M., Gonzalez, J. G., McIlwain, S. J., Sawin, E. A., Schoen, A. J., Adluru, N., Alexander, A. L., & Yu, J.-P. J. (2018). Gut microbiome populations are associated with structure-specific changes in white matter architecture.(1), 6.
Pedraz-Petrozzi, B., Elyamany, O., Rummel, C., & Mulert, C. (2020). Effects of inflammation on the kynurenine pathway in schizophrenia—A systematic review.(1), 56.
Rodrigues-Amorim, D., Rivera-Baltanás, T., Regueiro, B., Spuch, C., de Las Heras, M. E., Vázquez-Noguerol Méndez, R., Nieto-Araujo, M., Barreiro-Villar, C., Olivares, J. M., & Agís-Balboa, R. C. (2018). The role of the gut microbiota in schizophrenia: Current and future perspectives.(8), 571–585.
Rogers, G., Keating, D. J., Young, R. L., Wong, M.-L., Licinio, J., & Wesselingh, S. (2016). From gut dysbiosis to altered brain function and mental illness: mechanisms and pathways.(6), 738–748.
Schwarcz, R., Bruno, J. P., Muchowski, P. J., & Wu, H. Q. (2012). Kynurenines in the mammalian brain: when physiology meets pathology.(7), 465–477.
Schwarz, E., Maukonen, J., Hyytiäinen, T., Kieseppä, T., Orešič, M., Sabunciyan, S., Mantere, O., Saarela, M., Yolken, R., & Suvisaari, J. (2018). Analysis of microbiota in first episode psychosis identifies preliminary associations with symptom severity and treatment response.(4), 398–403.
Seeman, M. V. (2021). History of the dopamine hypothesis of antipsychotic action.,(7), 355–364.
Sharon, G., Sampson, T. R., Geschwind, D. H., & Mazmanian, S. K. (2016). The central nervous system and the gut microbiome.(4), 915–932.
Shen, Y., Xu, J., Li, Z., Huang, Y., Yuan, Y., Wang, J., Zhang, M., Hu, S., & Liang, Y. (2018). Analysis of gut microbiota diversity and auxiliary diagnosis as a biomarker in patients with schizophrenia: A cross-sectional study.(1)470–477.
Singh, R. K., Chang, H.-W., Yan, D., Lee, K. M., Ucmak, D., Wong, K., Abrouk, M., Farahnik, B., Nakamura, M., Zhu, T. H., Bhutani, T., & Liao, W. (2017). Influence of diet on the gut microbiome and implications for human health.(1), 73.
Stahl, S. M. (2018). Beyond the dopamine hypothesis of schizophrenia to three neural networks of psychosis: Dopamine, serotonin, and glutamate.,(3), 187–191.
Stępnicki, P., Kondej, M., & Kaczor, A. A. (2018). Current concepts and treatments of schizophrenia.(8), Article 2087. https://doi.org/10.3390/molecules23082087
Strandwitz, P. (2018). Neurotransmitter modulation by the gut microbiota.(3), 128–133.
Szeligowski, T., Yun, A. L., Lennox, B. R., & Burnet, P. W. (2020). The gut microbiome and schizophrenia: The current state of the field and clinical applications., Article 156. https://doi.org/ 10.3389/fpsyt.2020.00156
Tillisch, K., Mayer, E., Gupta, A., Gill, Z., Brazeilles, R., Le Nevé, B., van Hylckama Vlieg, J. E., Guyonnet, D., Derrien, M., & Labus, J. (2017). Brain structure and response to emotional stimuli as related to gut microbial profiles in healthy women.(8), 905–913.
Upthegrove, R., & Khandaker, G. M. (2019). Cytokines, oxidative stress and cellular markers of inflammation in schizophrenia.. (Vol. 44, pp. 49–66). New York: Springer International Publishing.
Vogt, N. M., Kerby, R. L., Dill-McFarland, K. A., Harding, S. J., Merluzzi, A. P., Johnson, S. C., … Rey, F. E. (2017). Gut microbiome alterations in Alzheimer’s disease.(1), 13537.
Wang, Y., Yuan, X., Kang, Y., & Song, X. (2019). Tryptophan-kynurenine pathway as a novel link between gut microbiota and schizophrenia: A review.,(4), 897–905.
Williams, B. B., van Benschoten, A. H., Cimermancic, P., Donia, M. S., Zimmermann, M., Taketani, M., Ishihara, A., Kashyap, P. C., Fraser, J. S., & Fischbach, M. A. (2014). Discovery and characterization of gut microbiota decarboxylases that can produce the neurotransmitter tryptamine.(4), 495–503.
Xu, R., Wu, B., Liang, J., He, F., Gu, W., Li, K., … Wang, M. (2020). Altered gut microbiota and mucosal immunity in patients with schizophrenia.(6), 120–127.
Yuan, X., Wang, Y., Li, X., Jiang, J., Kang, Y., Pang, L., Zhang, P., Li, A., Lv, L., Andreassen, O. A., Fan, X., Hu, S., & Song, X. (2021). Gut microbial biomarkers for the treatment response in first-episode, drug-naïve schizophrenia: A 24-week follow-up study.(1), 422.
Zeng, C., Yang, P., Cao, T., Gu, Y., Li, N., Zhang, B., Xu, P., Liu, Y., Luo, Z., & Cai, H. (2021). Gut microbiota: An intermediary between metabolic syndrome and cognitive deficits in schizophrenia., Article 110097. https://doi.org/10.1016/j.pnpbp.2020.110097
Zhang, J., Guo, Z., Xue, Z., Sun, Z., Zhang, M., Wang, L., … Zhang, H. (2015). A phylo-functional core of gut microbiota in healthy young Chinese cohorts across lifestyles, geography and ethnicities.(9), 1979–1990.
Zheng, P., Zeng, B., Liu, M., Chen, J., Pan, J., Han, Y., … Xie, P. (2019). The gut microbiome from patients with schizophrenia modulates the glutamate-glutamine-GABA cycle and schizophrenia-relevant behaviors in mice.(2), Article eaau8317. https://doi.org/ 10.1126/sciadv.aau8317
Zhu, F., Guo, R., Wang, W., Ju, Y., Wang, Q., Ma, Q., … Ma, X. (2020). Transplantation of microbiota from drug-free patients with schizophrenia causes schizophrenia-like abnormal behaviors and dysregulated kynurenine metabolism in mice.(11), 2905– 2918.
Zhu, F., Ju, Y., Wang, W., Wang, Q., Guo, R., Ma, Q., … Ma, X. (2020). Metagenome-wide association of gut microbiome features for schizophrenia.(1), 1612.
Zou, Y., Xue, W., Luo, G., Deng, Z., Qin, P., Guo, R., … Xiao, L. (2019). 1, 520 reference genomes from cultivated human gut bacteria enable functional microbiome analyses.(2), 179–185.
The relationship between gut microbiota and brain imaging and clinical manifestation in schizophrenia
ZHOU Zhenyou1, KONG Li1,2, CHAN Raymond3
(1Department of Psychology, Shanghai Normal University, Shanghai 200234, China)(2Shanghai Key Lab for Urban Ecological Processes and Eco-restoration, East China Normal University, Shanghai 200241, China) (3Neuropsychology and Applied Cognitive Neuroscience Laboratory, CAS Key Laboratory of Mental Health, Institute of Psychology, Chinese Academy of Sciences, Beijing 100101, China)
The microbiota-gut-brain axis hypothesis has attracted more and more attention in the research of the pathogenesis of schizophrenia. Previous research has preliminarily investigated the relationship between the composition of gut microbiota and the brain imaging and clinical manifestation of patients with schizophrenia, but the specific action path is still unclear. This research summarized the latest research progress, and on this basis, proposed the mechanism hypothesis of gut microbiota affecting the brain structure and function of patients with schizophrenia. The related contents will provide a theoretical basis for further elucidation of the pathological mechanism of schizophrenia and for incorporating gut microbiota into the assessment and intervention of schizophrenia.
schizophrenia, gut microbiota, microbiota-gut-brain axis, brain imaging, clinical manifestation
2021-10-09
* 国家自然科学项目(82071501, 81601170); 上海市城市化生态过程与生态恢复重点实验室开放课题(SHUES2020A04)。
孔丽, E-mail: likong1224@126.com
陈楚侨, E-mail: rckchan@psych.ac.cn
B845
