白蒺藜皂苷对系统性红斑狼疮模型小鼠免疫功能和肾功能的影响*
2022-08-09王晶孟祖东方勇阿彩岭许雪
王晶,孟祖东,方勇,阿彩岭,许雪
(湖北省十堰市人民医院·湖北医药学院附属人民医院,湖北 十堰 442000)
系统性红斑狼疮(SLE)是一种难治性自身免疫性疾病,涉及多个器官和系统,临床表现复杂[1]。SLE 易引起全身或局部组织和器官损伤[2]。糖皮质激素可有效治疗SLE,但长期使用会引起代谢紊乱、组织愈合延迟等不良反应[3]。自身免疫系统在SLE的发病机制中非常重要,Janus 激酶(JAK)起主导作用,其异常表达或过度激活均可能导致SLE发生[4]。JAK是参与Toll样受体(TLR)信号传导的重要蛋白激酶,抑制JAK 信号通路有利于减少炎性级联反应介导的组织损伤[5]。信号转导及转录激活因子(STAT)是一种氧化还原敏感的转录因子,可调节免疫反应和炎性反应,STAT的异常表达已在SLE 中得到证实[6]。此外,JAK 是STAT 通路的关键调节因子,在自身免疫性疾病的发病中起重要作用[7]。生化实验和临床证据表明,白蒺藜皂苷具有调节免疫、控制炎症、减少西药副作用、降低感染发生率等作用[8-10]。本研究中探讨了白蒺藜皂苷对SLE 模型小鼠免疫功能与肾功能的改善作用,以及对JAK/STAT 通路的影响,为其临床治疗提供参考。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:AU-480 型全自动生化分析仪(贝克曼库尔特生命科学有限公司);ZeissLSM880 型荧光显微镜(德国徕卡有限公司)。
试药:醋酸泼尼松原料药(上海施贵宝制药有限公司,批号为MN-569696.3);抗双链DNA(dsDNA)抗体、抗SM、补体C3、补体C4、24 h 尿蛋白定量(24 h pro)、血肌酐(SCr)、血尿素氮(BUN)试剂盒(贝克曼库尔特生命科学有限公司,批号分别为SD-48596.6,41529.5,52149.3,48972.7,89546.6,23984.3,51269.5);10%苏木精染色(北京索拉尔生物科技有限公司,批号为1526963);0.5%曙红染色(北京索拉尔生物科技有限公司,批号为5263963),Tissue-TekOCT 复合物(美国赛默飞世有限公司,批号为XD-41589.36);0.3%Tri⁃tonX-100(美国Sigma 生物有限公司,批号为YU-526986.36);异硫氰酸荧光素(FITC)偶联的山羊抗小鼠IgG(1∶1 000,批号为ab23836),兔抗小鼠C3(1∶2 000,批号为ab23836),购于英国Abcam生物有限公司;4',6-二脒基-2-苯基吲哚(DAPI,中生北控生物科技有限公司,批号425969),Trizol试剂(美国Invitrogen有限公司,批号为CD-599696.65);RevertAidTMM-MuLV 逆转录酶(日本Fermentas 有限公司,批号为MB-596563.36);蛋白酶抑制剂缓冲液(美国Cell Signaling Technology 有限公司,批号为MN-658963.63);硝酸纤维素膜(德国Schleicher&Schuell BioScience Inc 有限公司,批号为5896369);JAK3、STAT5、GAPDH 一抗(美国SantaCruz有限公司,批号分别为CD-59693.33、XC-74856.69、KI-58741.36);偶联辣根过氧化物酶的二抗(美国Cell Signaling Technology 有限公司,批号为56987.69);增强化学发光试剂盒(ECL,美国Cell Signaling Technol⁃ogy 有限公司,批号为DC-574896.65);白细胞介素2(IL -2)、肿瘤坏死因子-α(TNF -α)、白细胞介素4(IL -4)酶联免疫吸附(ELISA)试剂盒(北京索拉尔生物科技有限公司,批号分别为B2021034、B2021095、B2021018)。
动物:12 只C57BL/ 6 小鼠,6~8 周龄,雌雄各半,体质量(25.2±2.5)g,实验动物生产许可证号为SCXK(沪)2018-0035,实验动物许可证号为SYXK(浙)2016-0158,购自西普尔可凯实验动物有限公司。饲养于本院实验中心的屏障环境(室温20 ℃,相对湿度40%~60%,日光12 h),隔离于全封闭清洁状态,自由饮水进食。48 只MRL/ lpr 狼疮小鼠(MRL/ lpr 小鼠第19 号染色体Faslps 突变,可自发产生系统性免疫性自身疾病,淋巴结肿大、T 细胞增生、关节炎和免疫复合物型肾小球肾炎),6~8 周龄,体质量(25.3±2.4)g,实验动物生产许可证号为SCXK(沪)2017-0005,实验动物许可证号为SYXK(浙)2019-0012,购自上海Slac 实验动物有限公司。饲养于浙江中医药大学动物实验中心屏障环境(室温20 ℃,相对湿度40%~60%,日光12 h),隔离于常闭无特定病原体(SPF)状态,自由饮水和进食。本研究已通过我院动物伦理协会批准。
1.2 方法
给药与分组:醋酸泼尼松组(45 mg/ kg),白蒺藜皂苷低、高剂量组(100,200 mg/ kg)MRL/ lpr 狼疮小鼠给予相应药物灌胃,正常对照组(C57BL/ 6 小鼠)和模型对照组小鼠灌胃等量生理盐水,各12只,均持续8 周。
抗dsDNA、抗SM、补体C3、补体C4、24 h 尿蛋白、SCr、BUN 测定:末次治疗后,所有小鼠空腹隔夜取血,静置30 min,离心(转速为3 000 r/min)10 min,分离取血清,同时收集小鼠24 h 尿液;采用贝克曼AU-480 型全自动生化分析仪测定抗dsDNA、抗SM、补体C3、补体C4、24 h尿蛋白、SCr、BUN水平。
小鼠肾脏病理、荧光切片制作:肾脏在4%甲醛中固定24 h,常规脱钙,脱水,用切片机切成5µm 厚的切片。二甲苯Ⅰ、二甲苯Ⅱ脱蜡,无水乙醇水化,10%苏木精染色,盐酸和乙醇分化,用0.5%曙红染色1 min,乙醇、二甲苯脱水。使用LeicaDM4000B 型光学显微镜观察肾脏组织的病理变化。将速冻的肾组织用于IgG、补体C3 的免疫荧光检查,将冷冻肾组织包埋在Tissue -TekOCT 复合物中,用4% 多聚甲醛固定30 min,用0.3%TritonX-100 透化30 min,用3%牛血清白蛋白在室温下封闭30 min,用FITC 偶联的山羊抗小鼠IgG、兔抗小鼠C3 在4 ℃下孵育过夜,用DAPI 染色5 min,用荧光显微镜观察染色情况。
小鼠肾脏JAK3及STAT5基因水平检测:Trizol试剂提取肾脏中的总RNA,使用RevertAidTMM -MuLV 逆转录酶将RNA逆转录成cDNA,对JAK3,STAT5,GAPDH进行反转录聚合酶链式反应(RT -PCR)。95 ℃预变性30 s后,将Rotor -Gene TM6000 PCR 系统的循环程序设置为在95 ℃下进行40次循环5 s,在56 ℃下进行30 s。当最后的循环结束时,将样品在65 ℃保持5 s,以进一步延长。序列如下,JAK3,正向5'-TACGTAGTCGATC⁃GTAGCTAGCTAGCTAGCTAGTCGATCGATCGATCGCT⁃AGT -3',反向5' -TGTCGTAGCTAGTCGATCGTAGC⁃TAGCTAGCTAGCTGATCGATCGTAGCTCG-3';STAT5,正向5'-TGCTAGTCGTAGTCGTAGCTAGTAGTCGTAGT⁃GTCGATCGTG -3',反向5' -TGTGATGTAGCTGATC⁃GATGTCGTAGTAGTGATGTCGTACTG-3';GAPDH,正向5' -TGTGCTGATGATGCTAGTCGTAGCTAGTCGAT⁃GCTAGCTGA -3',反 向5' -TGTCGTATCGATCG⁃TAGCTAGTCGATCGTAGTGTAGTGTAGT -3'。每个反应重复3 次。JAK3 和STAT5 mRNA 的相对水平分别为JAK3和STAT5吸光度与GAPDH吸光度之比。
小鼠肾脏JAK3 和STAT5 蛋白水平检测:采用蛋白质印迹(Western blotting)法测定,肾组织在蛋白酶抑制剂缓冲液中裂解并匀浆,离心(15 000g)。将提取的蛋白质用7%凝胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS -PAGE),并将蛋白质转移到硝酸纤维素膜上。用含5%脱脂奶粉的TBST(含0.1%Tween-20的TBS,pH 7.4)封闭后,将膜与JAK3,STAT5,GAPDH 于4 ℃温度下过夜。洗涤后,印迹与偶联辣根过氧化物酶的二抗一起孵育。膜上的蛋白印迹通过ECL 试剂盒检测。使用Quantity One(德国慕尼黑BioRad 实验室)对测定结果进行定量。
小鼠肾组织炎性因子IL -2,TNF -α,IL -4 水平检测:取细胞培养液100µL 于96 孔板内,覆膜,37 ℃孵育2 h。弃去孔内液体,每孔加IL-2、TNF-α、IL-4 生物素抗体工作液100µL,覆膜,37 ℃孵育1 h,弃去孔内液体,每孔加酶结合物工作液100µL,37 ℃孵育1 h。弃去孔内液体,洗板5 次。每孔用200 µL 的洗涤液洗涤,浸泡2 min,弃去酶标板内的液体,在吸水纸上将酶标板拍干。每孔加入TMB 显色底物溶液90µL,37 ℃避光孵育15~20 min。每孔加入终止液50µL,终止反应,立即用酶标仪测量。采用ELISA法测定小鼠肾组织炎性因子IL-2,TNF-α,IL-4的水平。
1.3 统计学处理
采用SPSS 23.0 统计学软件分析。计量资料以X±s表示,采用单因素方差分析,多重比较采用LSD -t检验。P<0.05为差异有统计学意义。
2 结果
2.1 抗dsDNA、抗SM、补体C3、补体C4 水平
由表1可见,模型对照组小鼠抗dsDNA、抗SM 水平均显著高于正常对照组,补体C3、补体C4 水平均显著低于正常对照组(P<0.05);醋酸泼尼松组,白蒺藜皂苷低、高剂量组小鼠抗dsDNA、抗SM 水平均显著低于模型对照组,补体C3、补体C4 水平均显著高于模型对照组(P<0.05);随着白蒺藜皂苷剂量的增加,白蒺藜皂苷低、高剂量组小鼠抗dsDNA、抗SM 水平逐渐降低,补体C3、补体C4水平逐渐升高(P<0.05),且上述指标水平均较醋酸泼尼松组变化显著(P<0.05)。
表1 各组小鼠抗dsDNA、抗SM、补体C3、补体C4水平比较(,n=12)Tab.1 Comparison of anti-dsDNA,anti-SM,complement C3 and complement C4 levels of mice in each group(,n=12)

表1 各组小鼠抗dsDNA、抗SM、补体C3、补体C4水平比较(,n=12)Tab.1 Comparison of anti-dsDNA,anti-SM,complement C3 and complement C4 levels of mice in each group(,n=12)
注:与正常对照组比较,aP <0.05;与模型对照组比较,bP <0.05;与醋酸泼尼松组比较,cP <0.05;与白蒺藜皂苷低剂量组比较,dP <0.05。表2至表4同。Note:Compared with those in the normal control group,aP <0.05;Compared with those in the model control group,bP <0.05;Compared with those in the prednisone acetate group,cP <0.05;Compared with those in the STT low-dose group,dP <0.05(for Tab.1-4).
2.2 BUN,SCr,24 h 尿蛋白水平
由表2 可见,模型对照组小鼠BUN、SCr、24 h 尿蛋白水平均显著高于正常对照组(P<0.05);醋酸泼尼松组,白蒺藜皂苷低、高剂量组小鼠上述指标水平均显著低于模型对照组(P<0.05);随着白蒺藜皂苷剂量的增加,白蒺藜皂苷低、高剂量组小鼠上述指标水平逐渐降低(P<0.05),且显著高于醋酸泼尼松组(P<0.05)。
表2 各组小鼠BUN、SCr、24 h尿蛋白水平比较(,n=12)Tab.2 Comparison of BUN,SCr and 24 h urinary protein levels of mice in each group(,n=12)

表2 各组小鼠BUN、SCr、24 h尿蛋白水平比较(,n=12)Tab.2 Comparison of BUN,SCr and 24 h urinary protein levels of mice in each group(,n=12)
2.3 肾组织苏木精-伊红(HE)染色
由图1 可见,正常对照组小鼠肾小球结构正常,模型对照组小鼠肾小球体积变大,可见炎性细胞浸润;醋酸泼尼松组,白蒺藜皂苷低、高剂量组小鼠肾小球体积变小,炎性细胞浸润减轻。
2.4 肾组织免疫荧光染色
由图2可见,正常对照组小鼠IgG和补体C3染色为阴性,模型对照组小鼠可见IgG 沿毛细血管袢呈不连续的颗粒样沉积,荧光强度为++++;醋酸泼尼松组,白蒺藜皂苷低、高剂量组小鼠肾小球IgG 和补体C3 沉积情况变弱。
2.5 肾组织JAK3 及STAT5 mRNA 和蛋白水平
由表3 可见,模型对照组小鼠JAK3 及STAT5 mRNA 和蛋白水平均显著高于正常对照组(P<0.05);醋酸泼尼松组,白蒺藜皂苷低、高剂量组小鼠JAK3 及STAT5mRNA和蛋白水平均显著低于模型对照组(P<0.05);随着白蒺藜皂苷剂量的增加,白蒺藜皂苷低、高剂量组小鼠JAK3 及STAT5 mRNA 和蛋白水平均逐渐降低(P<0.05),且均显著高于醋酸泼尼松组(P<0.05)。各组小鼠肾组织JAK3 及STAT5 蛋白表达水平电泳图见图3。
表3 各组小鼠肾组织JAK3及STAT5 mRNA和蛋白水平比较(,n=12)Tab.3 Comparison of the levels of JAK3,STAT5 mRNA and pro⁃tein in the kidney tissue of mice in each group(,n=12)

表3 各组小鼠肾组织JAK3及STAT5 mRNA和蛋白水平比较(,n=12)Tab.3 Comparison of the levels of JAK3,STAT5 mRNA and pro⁃tein in the kidney tissue of mice in each group(,n=12)
2.6 肾组织炎性因子IL-2,TNF-α,IL-4 水平
由表4可见,模型对照组小鼠IL-2,TNF-α,IL-4水平均显著高于正常对照组(P<0.05);醋酸泼尼松组和白蒺藜皂苷低、高剂量组小鼠上述指标水平均显著低于模型对照组(P<0.05);随着白蒺藜皂苷剂量的增加,白蒺藜皂苷低、高剂量组小鼠上述指标水平均逐渐降低(P<0.05),且均显著高于醋酸泼尼松组(P<0.05)。
表4 各组小鼠肾组织炎性因子IL-2,TNF-α,IL-4水平比较(,mol/mL,n=12)Tab.4 Comparison of the inflammatory factors IL-2,TNF-α and IL-4 levels in the kidney tissue of mice in each group(,mol/mL,n=12)
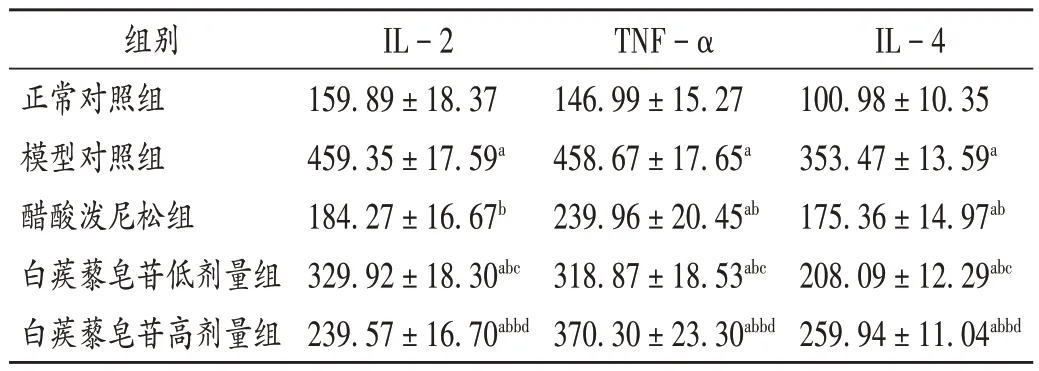
表4 各组小鼠肾组织炎性因子IL-2,TNF-α,IL-4水平比较(,mol/mL,n=12)Tab.4 Comparison of the inflammatory factors IL-2,TNF-α and IL-4 levels in the kidney tissue of mice in each group(,mol/mL,n=12)
3 讨论
随着免疫抑制方案和一般医疗保健措施的改进,增殖性和膜性狼疮性肾炎长期治疗结果已无差异,但SLE患者肾炎完全缓解率仍低于12%,且40%的Ⅲ~Ⅴ期狼疮性肾炎患者仍存在一定程度的肾功能损害[11]。即使在良好的情况下,免疫抑制剂对SLE肾炎的治疗效果仍远不能令人满意。因此,有必要为SLE 寻找新的药物靶点。
白蒺藜皂苷具有抗氧化、抗炎和镇痛作用,肝炎、高血压、关节炎、支气管炎、恶性肿瘤等多种疾病具有潜在的治疗作用[12]。白蒺藜皂苷诱导鼠和人CD4+T 淋巴细胞扩增为Foxp3+调节性T(Treg)细胞,可用于缓解急性结肠炎[13]。白蒺藜皂苷还可调节外周单核细胞的活性,抑制SLE相关致病细胞因子的产生,如TNF-α,IL -1β,IL -12,IL -6[14]。近期的研究表明,白蒺藜皂苷能与模式识别受体如dectin-1发生潜在相互抑制作用。Dectin -1 是一种c 型凝集素,可与TLR2 协同触发抗原呈递细胞中的先天免疫反应,诱导促炎作用。此外,TLR2 信号可能具有潜在增强体外和体内Treg 细胞增殖的作用,导致Foxp3 表达的瞬时增加[15]。本研究结果显示,模型对照组小鼠抗dsDNA、抗SM、BUN、SCr、24 h尿蛋白水平均显著高于正常对照组,补体C3、补体C4水平均显著低于正常对照组;醋酸泼尼松组,白蒺藜皂苷低、高剂量组小鼠抗dsDNA、抗SM、BUN、SCr、24 h 尿蛋白水平均显著低于模型对照组,补体C3、补体C4 水平均显著高于模型对照组。结果表明,白蒺藜皂苷能明显抑制SLE 模型小鼠的免疫功能,并改善肾功能。由病理、荧光染色结果可知,经醋酸泼尼松、白蒺藜皂苷治疗后,各组小鼠肾小球减少,炎性细胞浸润减轻,肾小球IgG 和补体C3 沉积情况变弱。结果表明,白蒺藜皂苷可抑制SEL模型小鼠肾脏的炎性反应。
有研究表明,抑制JAK3可改善核因子-κB抑制因子α(IκBα)磷酸化,抑制免疫活性细胞中核因子-κB(NF-κB)信号传导和下游促炎细胞因子产生,减少狼疮相关的肾功能损伤[16]。STAT5 是一种广泛表达的核转录因子,在调节各种炎性介质中起重要作用,通常存在于细胞质中。IKBα的磷酸化使STAT5易位到细胞核,并诱导转录[17]。JAK3 是SLE 发展的危险因素,JAK3 抑制剂可减弱易患狼疮的MRL/lpr 小鼠和具有外周血单个核细胞(PBMC)的SLE 患者脾单核细胞中的NF-κB信号传导,同时减少小鼠中促炎细胞因子的产生。因此,抑制JAK3 活性可能有助于发现SLE 和其他炎性疾病的新疗法[18]。另有研究表明,脂多糖刺激MRL/lpr小鼠腹腔巨噬细胞后,炎性信号通路JAK3/ STAT5 和炎性因子TNF-α 及IL-6 的表达显著增加[19]。这表明脂多糖与JAK 受体,特别是JAK3 的特异性结合,异常激活STAT5 信号通路,启动免疫相关基因的转录并诱导各种炎性反应。在细胞试验中,JAK3 通过shRNA 慢病毒转染过表达,作用于MRL/ lpr 小鼠腹腔巨噬细胞,JAK3 过表达后STAT5 表达显著增加,下游炎性分子的表达增加;而抑制JAK3 表达后,JAK3 下游分子中STAT5、IKBα、IKB 激酶(IKK)和NF-κB 的表达水平降低,磷酸化水平显著降低[20]。IL -2,TNF -α,IL -4 是JAK3/STAT5 通路的下游因子。本研究结果显示,模型对照组小鼠JAK3 及STAT5 mRNA 和蛋白水平均显著高于正常对照组(P<0.05);醋酸泼尼松组,白蒺藜皂苷低、高剂量组小鼠JAK3 及STAT5 mRNA 和蛋白水平均显著低于模型对照组(P<0.05),且随着白蒺藜皂苷剂量的增加,白蒺藜皂苷低、高剂量组小鼠的JAK3 及STAT5 mRNA 和蛋白水平均显著降低(P<0.05),均显著高于醋酸泼尼松组(P<0.05);同时,IL-2,TNF-α,IL-4水平也被抑制。
综上所述,白蒺藜皂苷能明显抑制SLE模型小鼠的免疫功能,改善肾功能,其作用机制可能与白蒺藜皂苷能抑制JAK3/STAT5通路的激活有关。
