绵羊附睾GPX5的抗氧化功能研究
2022-08-09栾兆进赵勇超宋慧子张家新
栾兆进,赵勇超,宋慧子,张家新
(1 内蒙古农业大学 动物科学学院/内蒙古自治区动物遗传育种与繁殖重点实验室,内蒙古 呼和浩特 010018; 2 包头医学院 基础医学与法医学院,内蒙古 包头 014040)
附睾对精子的成熟和储存具有重要作用[1],在附睾液中发现的大多数蛋白质都是附睾上皮细胞的分泌产物[2]。谷胱甘肽过氧化物酶5(glutathione peroxidase 5,GPX5)是谷胱甘肽过氧化物酶家族中的重要成员,其活性部位不含硒代半胱氨酸,而是含有半胱氨酸残基[3]。研究表明,GPX5主要表达于附睾头部区域,可以调节附睾微环境[4-6]。如果附睾中高表达的GPX5与雄性动物生育能力的关系被完全证明,将有助于解释附睾的功能。
线粒体呼吸是细胞活性氧(reactive oxygen species,ROS)的主要来源[7],细胞中的氧化剂和抗氧化剂之间失衡时,过量的ROS会通过多种机制损伤组织,如DNA损伤、脂质过氧化、蛋白质氧化和羰基化、细胞巯基耗竭和促炎性细胞因子释放的激活等[8-9]。因此,研究细胞内存在的抗氧化机制具有重要的现实意义。研究表明,与GPX5基因敲除的1岁雄性小鼠交配的野生型雌性小鼠发生自然流产和胎儿发育缺陷的概率增大[10],这是由于在GPX5蛋白缺乏的情况下,精子的DNA受到一定程度的氧化损伤增加所致。Chabory等[5]研究发现,在GPX5基因敲除的小鼠附睾尾部,GPX1、GPX3、GPX4和过氧化氢酶的水平升高,表明附睾发生了氧化应激反应,以应对过量的ROS,这可能是GPX5缺乏而导致的一种补偿反应,这种补偿性的表型变化是GPX5基因敲除的次要结果而非主要结果。因此,用一种更直接的方法验证GPX5的抗氧化作用是很有必要的。本试验以体外连续稳定传代的附睾上皮细胞(epididymal epithelial cells,EECs)为材料,利用小干扰RNA(small interfering RNA,siRNA)干扰其GPX5的表达,检测干扰后EECs的增殖能力及ROS、丙二醛(malondialdehyde,MDA)和核酸氧化损伤标记8-羟基脱氧鸟苷(8-hydroxydeoxyguanosine,8-OHdG)水平的变化,旨在探究GPX5在附睾抗氧化损伤保护中的作用。
1 材料与方法
1.1 材 料
从屠宰场采集12月龄健康绵羊的睾丸,置于含有双抗(200 IU/mL青霉素和200 μg/mL链霉素)的磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)中冷藏保存,2 h内带回实验室,并于超净台中取出附睾头部组织,用于细胞体外培养。
主要试剂和试剂盒有LipofectamineTM3000 Reagent(Introvergen)、核糖核酸酶(Sigma)、ROS和MDA检测试剂盒(碧云天)、CCK-8试剂盒(全式金)、蛋白酶K(Tiangen)、反转录试剂盒和PrimeScriptTMRT试剂盒(TaKaRa)、BCA蛋白浓度检测试剂盒(博士德)、绵羊源GPX5 ELISA试剂盒(上海宝曼)、OHdG抗体(E-8)sc-393871(Santa Cruz)。主要仪器有NANODROP 2000紫外分光光度仪(Thermo)、酶标仪(Bio-Tek)、Imager A2 显微镜(蔡司)、LightCycler480高通量实时荧光定量PCR系统(Roche)和激光共聚焦显微镜(Olympus)。
1.2 绵羊EECs的体外分离培养与鉴定
将附睾头部组织剪成小块(直径1~3 mm),于2.5 mg/mL胰酶(含0.91 mmol/L EDTA)中37 ℃水浴振荡消化30 min后用血清终止消化,置于胶原酶Ⅳ中振荡消化40 min,用孔径0.15 mm不锈钢滤网过滤消化液,获得细管状组织。使用PBS清洗细管状组织,1 000 r/min离心5 min,重复3次,弃上清,沉淀加入RPMI 1640培养基(含体积分数10%胎牛血清、5 μg/mL转铁蛋白、100 nmol/L雄激素、50 U/mL青霉素、50 μg/mL链霉素、50 ng/mL EGF和100 mmol/L海藻糖),接种于直径60 mm培养皿中,于37 ℃、体积分数5% CO2培养箱内培养,待细胞融合度达80%时用2.5 mg/mL胰酶(含0.91 mmol/L EDTA)消化1 min,弃去上清液(此时上清液主要为成纤维细胞),继续用胰酶消化2~3 min。用移液枪轻轻吹打皿底,使未悬浮的贴壁细胞悬浮,将上清液以1∶2的体积比接种至新的直径60 mm培养皿中,即得P1代 EECs。
制备P1代EECs爬片,用预冷甲醇溶液固定5 min,体积分数0.2% Triton X-100通透15 min,体积分数3%过氧化氢(H2O2)去除内源性过氧化物酶,用质量浓度50 mg/mL BSA封闭,加鼠源抗角蛋白18(cytokeratin 18,CK18)抗体(1∶100倍稀释),4 ℃孵育过夜,加FITC标记的山羊抗鼠二抗(1∶100倍稀释),37 ℃孵育1 h,滴加抗荧光淬灭剂封片,荧光显微镜拍照记录。本试验以从附睾分离出的成纤维细胞为对照组,试验重复3次。
1.3 siRNA的筛选
从GenBank中下载GPX5基因mRNA CDS序列,利用Invitrogen在线设计工具(https://rnaidesigner.thermofisher.com/rnaiexpress/design.do)查找GPX5特异性siRNA序列,结果得到siRNA-N.1、siRNA-N.2和siRNA-N.3共3条序列;同时,随机设计一段不与GPX5重合的扰码(scramble)序列(siRNA-NC)作为阴性对照。4条序列(表1)交由汉恒生物公司合成后,与pHB-U6-MCS-CMV-ZsGreen连接构建干扰载体。

表1 GPX5基因的siRNA序列
1.4 siRNA对 EECs的瞬时转染
siRNA对EECs的瞬时转染严格按照LipofectamineTM3000试剂说明书进行操作。试验分为siRNA-N.1、siRNA-N.2和siRNA-N.3转染组及siRNA-NC转染对照组和正常EECs对照组(CK)。转染前取生长旺盛期的EECs均匀接种于6孔板,采用无双抗的完全培养基于37 ℃、体积分数5% CO2细胞培养箱内培养24 h,待细胞汇合度达到70%~90%时开始转染。将干扰载体用Opti-MEM稀释,加入P3000TMReagent混匀。取LipofectamineTM3000转染试剂,用 Opti-MEM稀释。将干扰载体稀释液和LipofectamineTM3000稀释液按照体积比1∶1混合,静置约15 min,即得瞬时转染试剂。将上述配好的瞬时转染试剂加入六孔板内轻轻混匀,置于37 ℃、体积分数5% CO2细胞培养箱中培养34 h后,取样用于后续试验。
1.5 GPX5表达水平的检测
1.5.1 mRNA表达水平的检测 以β-actin为内参基因,采用实时荧光定量PCR(RT-qPCR)检测GPX5基因mRNA的表达水平。从GenBank核酸库中检索绵羊GPX5和β-actin基因序列(GenBank登录号分别为NM_001267883和NM_001009784.1),利用Primer 5.0设计特异性引物,由上海生工技术有限公司合成,引物序列见表2。
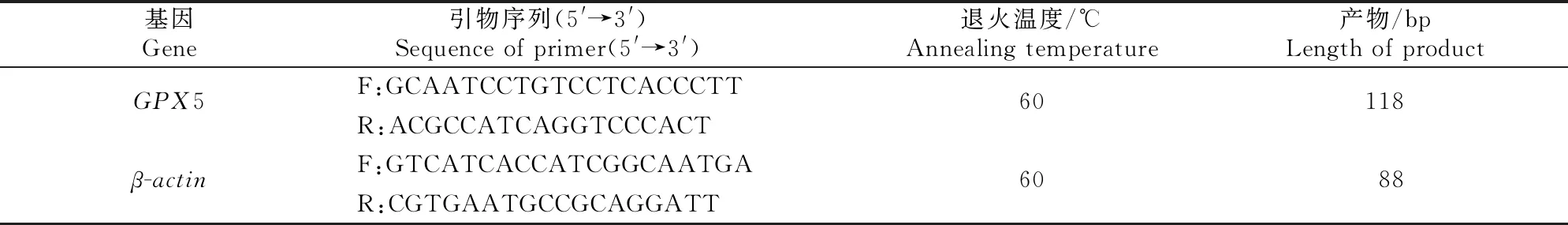
表2 试验所用的引物序列
使用TRIzol试剂提取各组细胞的RNA,用PrimeScriptTMRT Master Mix合成cDNA,进行RT-qPCR反应。RT-qPCR反应体系(20 μL)为: SYBR Premix ExTaqTMⅡ 10 μL,cDNA 1 μL,上、下游引物各1 μL,ROX 0.4 μL,ddH2O 6.6 μL。PCR反应条件为:95 ℃ 10 min,95 ℃ 30 s,62 ℃ 30 s, 72 ℃ 30 s,40个循环。每个待测样本设置3个重复,采用 2-ΔΔCt方法分析数据。以CK为基准(其表达水平定为1)确定其他4个处理组的表达水平。
1.5.2 蛋白表达水平的检测 采用绵羊源GPX5 ELISA试剂盒检测GPX5蛋白的表达水平,具体操作按试剂盒说明书进行。每组样本重复3次。
1.6 GPX5干扰对EECs增殖及其ROS、MDA和8-OHdG含量的影响
1.6.1 EECs增殖活力检测 采用CCK-8法检测EECs的增殖活力。将siRNA-N.3(又称siRNA-GPX5,下同)、siRNA-NC转染对照组和CK组EECs分别用0,0.5,0.8,1.0和1.5 mmol/L H2O2处理2 h,加入CCK-8溶液10 μL,37 ℃、体积分数5% CO2培养箱中继续孵育3 h后,用酶标仪于450 nm波长处检测吸光度(A450)。每组样本重复10次。
1.6.2 ROS水平检测 将siRNA-GPX5、siRNA-NC转染对照组和CK组的EECs用1 mmol/L H2O2处理2 h,向6孔板中加入足量的10 μmol/L DCFH-DA荧光探针孵育30 min,然后通过流式细胞仪分析DCF荧光强度,DCF值越大ROS水平越高。以CK的ROS水平为基准(其含量定为1),确定其他2组的ROS水平。每组样本重复3次。
1.6.3 MDA水平检测 将siRNA-GPX5、siRNA-NC转染组和CK组的EECs用1 mmol/L H2O2处理2 h,加0.1 mL裂解液冰浴裂解15 min,4 ℃下10 000 r/min离心10 min,取上清液即为待测蛋白液,用BCA法检测蛋白浓度。用MDA检测试剂盒检测MDA水平,以CK的MDA水平为基准(其含量定为1),确定其他2组的MDA水平。每组样本重复3次。
1.6.4 8-OHdG水平检测 将siRNA-GPX5、siRNA-NC转染组和CK组EECs用1 mmol/L H2O2处理2 h,使用100%甲醇室温固定细胞5 min,体积分数0.1% Triton X-100通透15 min,PBS清洗2次,然后用核糖核酸酶于37 ℃培养箱处理60 min,再用20 mg/mL蛋白酶K室温处理15 min,2 mol/L HCl室温变性5 min,2 mol/L Tris碱中和7 min,用10 mg/mL BSA室温封闭1 h,用稀释的8-OHdG鼠源一抗(1∶100倍稀释)4 ℃孵育细胞过夜,再用山羊抗鼠二抗(1∶300倍稀释)孵育30 min,最后用1 μg/mL DAPI染色15 min。将染色后的细胞转移到载玻片中,用抗荧光淬灭剂封片后在Olympus FluoView FV10i共聚焦激光扫描显微镜系统(Olympus)下观察8-OHdG的染色情况。每组样本重复3次。
1.7 数据统计与分析
试验数据用“平均值±标准差”表示。使用SPSS19.0软件中的ANOVA对试验结果进行单因素方差分析,比较不同试验组细胞的GPX5 mRNA和蛋白表达水平、细胞增殖活力及ROS和MDA水平的差异情况。
2 结果与分析
2.1 绵羊EECs鉴定
采用免疫荧光鉴定P1代EECs,结果表明分离的目标细胞可与CK18特异性抗体反应,而对照组附睾中的成纤维细胞不表达CK18(图1)。表明试验分离的细胞为EECs,可以用于后续试验。
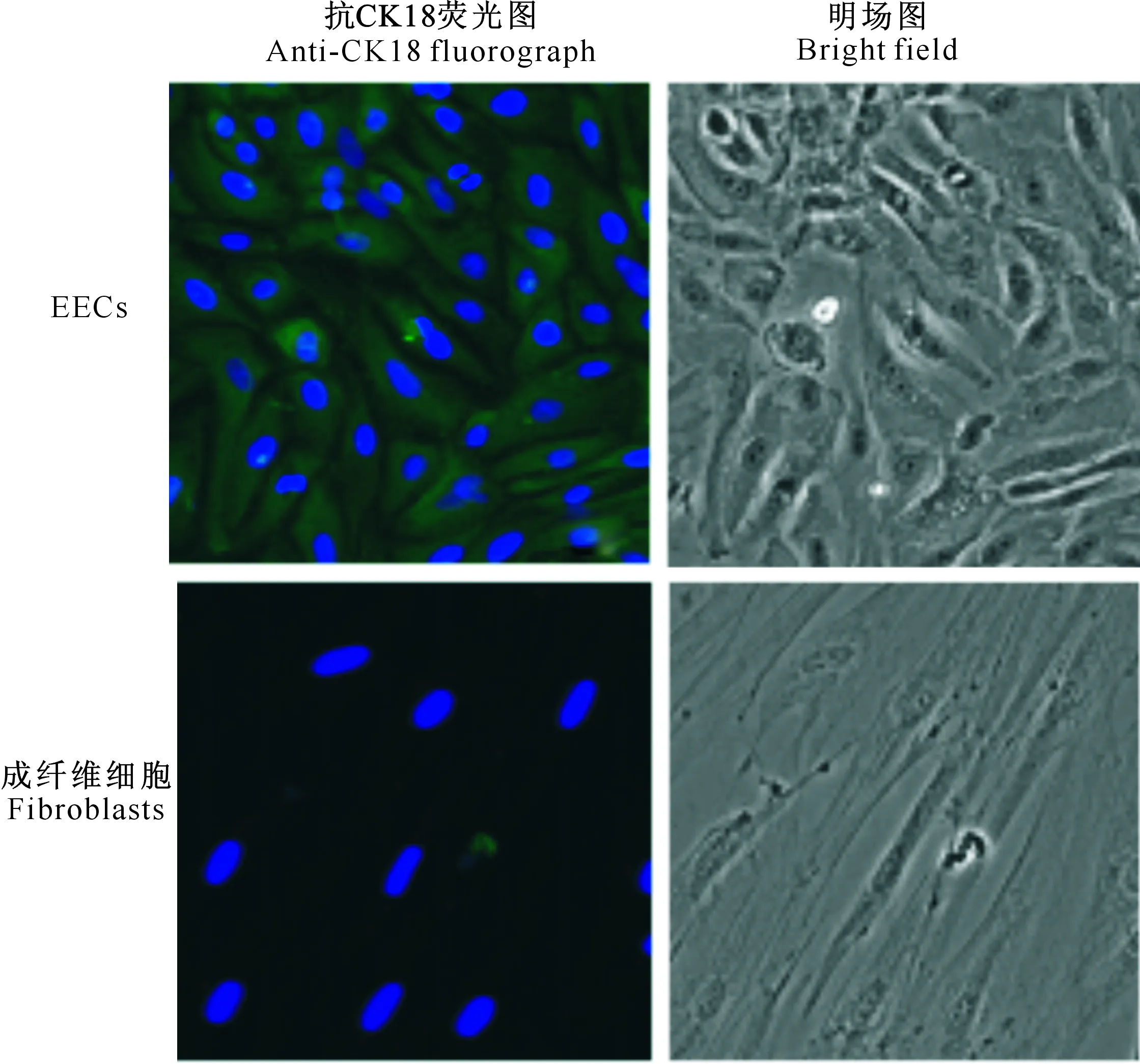
图1 绵羊EECs的鉴定(20×)
2.2 siRNA对EECs GPX5 mRNA表达水平的影响
RT-qPCR结果(图2)显示,与CK组相比,siRNA-N.1和siRNA-N.2组GPX5 mRNA 的表达水平显著降低(P<0.05),siRNA-N.3组极显著降低(P<0.01);而siRNA-NC组GPX5 mRNA 的表达水平与CK组差异不显著(P>0.05)。上述结果表明,siRNA-N.3组的干扰效果最佳。
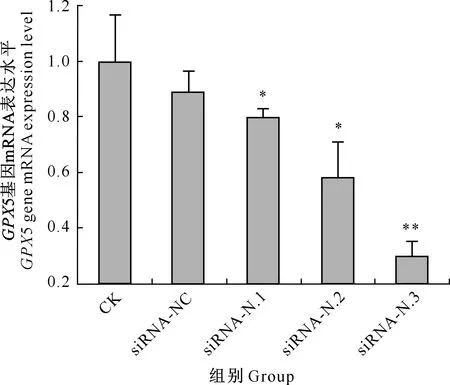
与CK组相比,标*表示差异显著(P<0.05),标**表示差异极显著(P<0.01)。下图同
2.3 siRNA对EECs GPX5蛋白表达量的影响
GPX5蛋白表达量结果(图3)显示,与CK组相比,siRNA-N.1、siRNA-N.2和siRNA-N.3组GPX5蛋白的表达量均显著降低(P<0.05),其中siRNA-N.3组的下调幅度最大,这与mRNA检测结果一致;siRNA-NC组GPX5蛋白的表达量与CK组差异不显著(P>0.05)。GPX5 mRNA和蛋白检测结果均表明,siRNA-N.3可用于后续试验。
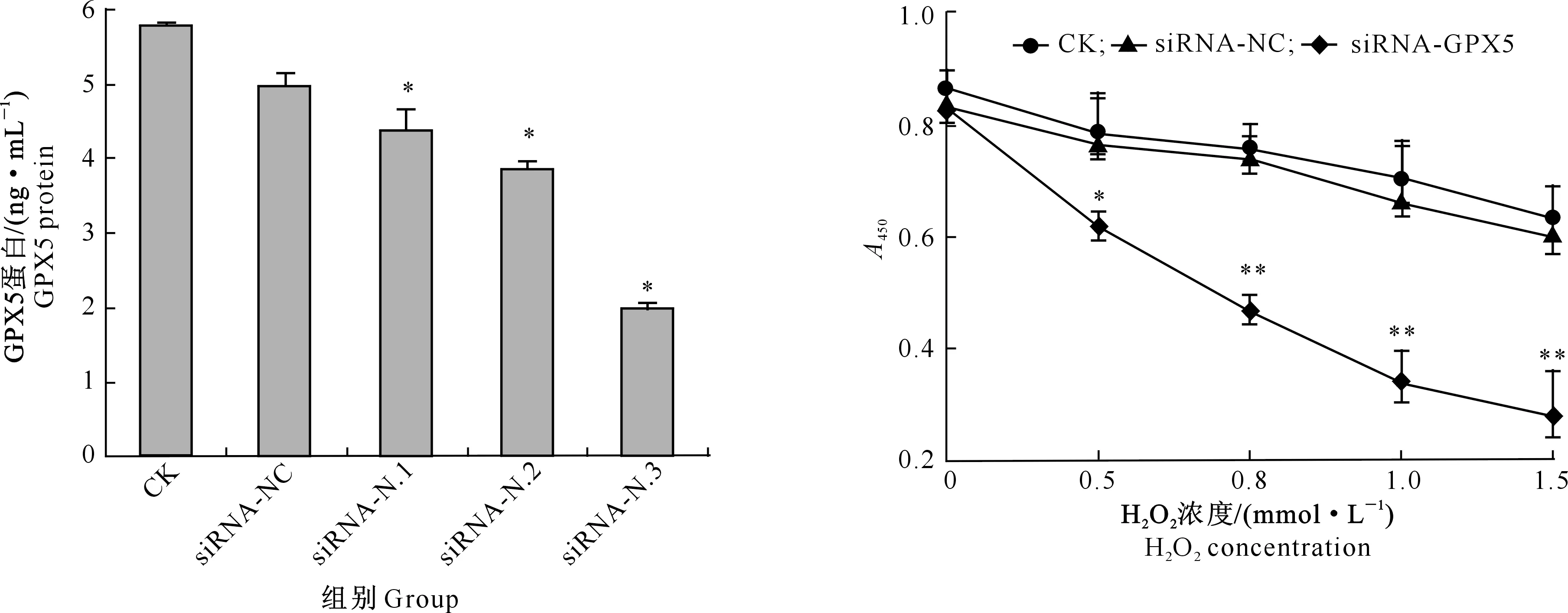
图3 siRNA干扰后EECs GPX5蛋白的表达量
2.4 GPX5干扰对EECs增殖活力的影响
试验结果(图4)显示,随着H2O2处理浓度的增加,与CK组相比,siRNA-GPX5组EECs的增殖活力逐渐下降,其中0.5 mmol/L H2O2使siRNA-GPX5组EECs的增殖活力显著低于CK组(P<0.05),0.8~1.5 mmol/L H2O2使siRNA-GPX5组EECs的增殖活力极显著低于CK组(P<0.01);0.5~1.5 mmol/L H2O2处理的siRNA-NC组EECs的增殖活力与CK组差异不显著(P>0.05)。
2.5 GPX5干扰对EECs中ROS水平的影响
试验结果(图5)表明,与CK组相比,siRNA-GPX5组EECs中的ROS水平极显著升高(P<0.01),而siRNA-NC组的ROS水平无明显变化(P>0.05)。
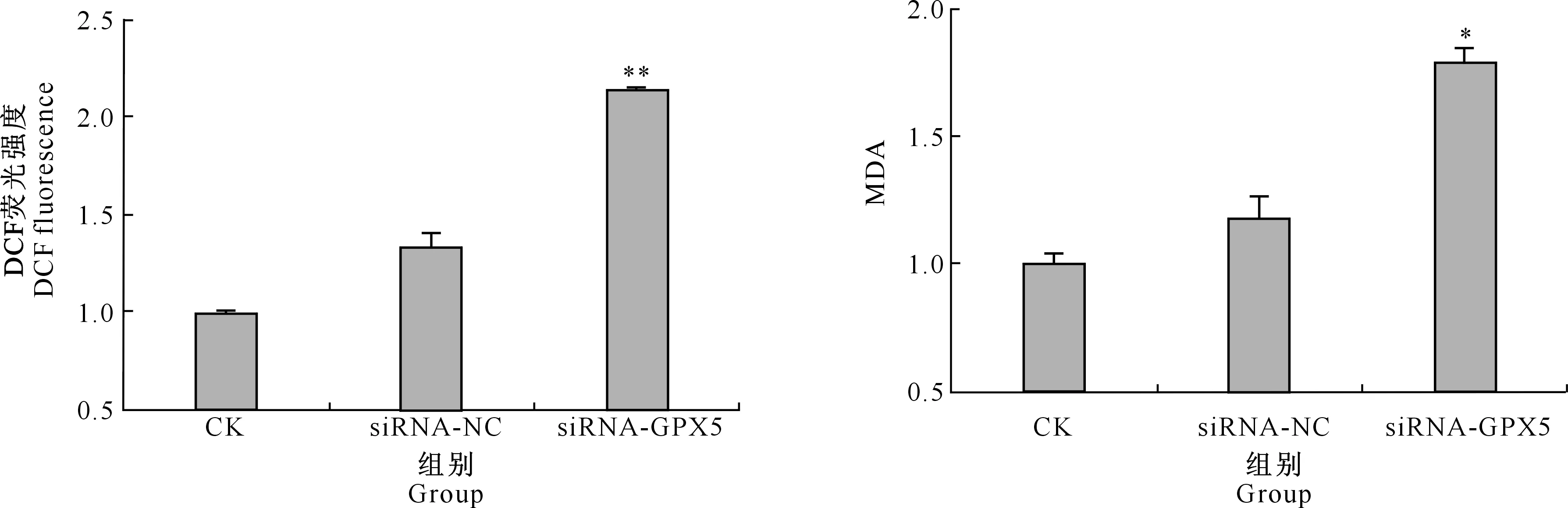
图5 siRNA-GPX5干扰后EECs 中的ROS水平
2.6 GPX5干扰对EECs脂质过氧化的影响
结果(图6)显示,siRNA-GPX5组EECs的MDA水平显著高于CK组(P<0.05),而siRNA-NC组EECs的MDA水平与CK组差异不显著(P>0.05)。
2.7 GPX5干扰对EECs中8-OHdG水平的影响
试验结果(图7)显示,与CK组相比,siRNA-GPX5组EECs中的8-OHdG水平显著升高(图中红色为8-OHdG特异性染色),而siRNA-NC组EECs内的8-OHdG水平变化不明显。
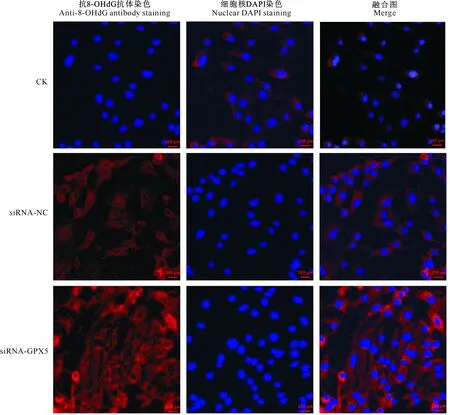
图7 siRNA-GPX5干扰后EECs中的8-OHdG水平检测(20×)
3 讨 论
本试验首先采用siRNA干扰技术建立了GPX5基因干扰模型,通过RT-qPCR和ELISA在转录和翻译水平对siRNA-N.1、siRNA-N.2和siRNA-N.3的干扰效果进行了鉴定,发现siRNA-N.3的干扰效果最佳,可用于进一步研究GPX5的抗氧化作用。
精子在附睾中运输时,其膜的磷脂构成和胆固醇/磷脂比发生改变,其表面会增加一些重要修饰蛋白[11],如去整合素和金属蛋白酶7(ADAM7)[12]、GPX5[13]、半胱氨酸丰富分泌蛋白1(CRISP1)[14]、精子粘附分子1(SPAM1)[15]、质膜Ca2+ATPase 4(PMCA4)[16]和连接粘附分子A(JAM-A)[17]等。附睾细胞合成并分泌的抗氧化剂可以清除ROS,从而保护精子免受细胞内外ROS的攻击[18]。有研究表明,大多数人的GPX5转录物是异常拼接的,包含118 bp的移位缺失[19]。有研究报道,人类精子、附睾液和精浆中的GPX5蛋白水平很低,甚至无法检测到[20],精子的质量与其他哺乳动物相比较差[21],而导致精子功能障碍和DNA损伤最常见的原因就是氧化应激[22]。本研究结果显示,随着H2O2处理浓度的增加,siRNA-GPX5组EECs的增殖活力在不断下降,说明GPX5的干扰降低了EECs对抗氧化应激的能力,GPX5一定程度上可以增加EECs对H2O2氧化刺激的抵抗力。GPX5干扰的EECs中ROS和MDA水平均显著升高,这也揭示了GPX5在保护精子细胞免受脂质过氧化损伤中的作用,说明GPX5在绵羊EECs中发挥磷脂氢过氧化物酶的抗氧化作用。本试验结果与Noblanc等[23]研究得出的GPX5基因缺失小鼠过氧化氢活性增加的结果一致。
脂质过氧化产生的高活性醛是DNA损伤的主要来源[24],而8-OHdG是最常见的由氧化应激引起的核酸损伤的标记物。Chabory等[5]研究表明,与野生型小鼠相比,GPX5敲除小鼠附睾尾部的精子中8-OHdG和MDA水平升高,认为GPX5的缺失造成了小鼠精子的DNA氧化损伤。本研究结果表明,与CK组相比,siRNA-GPX5组EECs中的8-OHdG水平显著升高,说明GPX5可有效避免细胞DNA的氧化损伤,这与Taylor等[25]研究得出的外源性GPX5可在一定程度上保护CHO-K1细胞的DNA免受损伤的结果趋于一致。总而言之,本试验通过检测GPX5干扰的EECs中的氧化应激指标,得到的结果均表明GPX5是附睾重要的抗氧化剂,并参与维持细胞和DNA的完整性。
