表现类似脑淀粉样血管病相关性炎症的孤立皮质静脉血栓形成1例及文献复习
2022-08-09贺忠延朱旭贞任永富
贺忠延, 朱旭贞, 陈 静, 任永富
颅内静脉血栓形成(cerebral venous thrombosis,CVT)较动脉源性脑梗死相对少见,约占所有脑血管病的0.5%~1%[1],包括硬脑膜窦血栓形成、深静脉血栓形成和皮质静脉血栓形成。但最近研究表明,随着影像技术的进展,它比既往估计的更常见。皮质静脉血栓形成(cortical vein thrombosis,CoVT)是大脑浅静脉血栓,通常伴随静脉窦血栓发生,而不伴随静脉窦血栓的孤立皮质静脉血栓形成(isolated cortical vein thrombosis,ICoVT)临床少见,约占CVT的6%[2],仅见单病例或小系列报道,对其特征仍缺乏足够认识,使其诊断上存在误诊、漏诊情况。
本文结合我科的1例ICoVT和既往文献报道对ICoVT病因和临床表现、临床影像学特征以及治疗和预后进行文献回顾,旨在为本病早期诊治提供依据。
1 临床资料
患者,女性,84岁,主因“突发精神行为异常2 d”于2021年7月25日入院。患者家属诉患者2 d前出现精神亢奋,持续自发言语,语声高亢,辱骂丈夫,情绪急躁,尖酸刻薄,易激惹,昼夜不眠,无主动进食需求。曾就诊于当地医院急诊,头部CT提示左侧顶叶异常病灶,转入我院。既往2021年7月4日曾因“突发右侧肢体抽搐伴活动不利1 h”就诊于当地,诊断为“癫痫持续状态Todd麻痹”,予左乙拉西坦0.5 g qdpo、吡仑帕奈 2 mg qnpo抗癫痫。神经内科查体:烦躁不安,查体欠配合,声音嘶哑,自言自语,余无殊。辅助检查:头部CT(2021年7月24日):左侧顶叶大片低密度灶(见图1B)。凝血功能:D-二聚体 0.67 mg/L(正常值0~0.55 mg/L);血常规、甲状腺类、肿瘤标记物、糖化血红蛋白、生化检查、传染病4项、抗核抗体谱测定+抗中性粒细胞浆抗体、抗心磷脂抗体全套均无殊。初步诊断:器质性精神障碍:颅内占位性病变?脑梗死?自身免疫性脑炎?颅内静脉血栓形成?治疗:奥氮平2.5 mg qnpo、喹硫平12.5 mg qdpo改善精神症状;左乙拉西坦0.5g qdpo、丙戊酸钠缓释片 0.5 g qnpo抗癫痫。7月26日腰椎穿刺压力100 mmH2O,脑脊液常规检查:红细胞2×106/L,白细胞1×106/L;脑脊液生化:脑脊液蛋白577.40 mg/L(正常值0500 mg/L),墨汁染色、抗酸染色、细菌涂片及培养均阴性。患者家属补充影像资料:头部CT(2021年7月4日):未见异常(见图1A)。头部MRI平扫(2021年7月6日):左侧顶叶片状异常,呈T1WI等信号,T2WI高信号,FLAIR高信号,ADC高信号,DWI未见弥散受限(见图2A~C)。头部MRI增强(2021年7月日9):左侧顶叶病灶基本同前(7月6日),T1增强未见强化。患者前后两次头部CT间隔20 d,新增左侧顶叶皮质下片状低密度灶,未累及皮质,不符合典型动脉供血区,头部DWI弥散不受限,基本排除动脉源性脑梗死。病灶短期内快速出现,不符合常规肿瘤影像表现,头部MRI增强无明显强化,基本排除肿瘤性病变。修正诊断:器质性精神障碍?自身免疫性脑炎? 颅内静脉血栓形成? 调整治疗予以甲强龙500 mg静滴冲击治疗。7月28日头部MRI增强:左侧顶叶片状异常信号较前(7月6日)明显增大,累及左侧侧脑室后角,呈T1WI低信号,T2WI高信号,FLAIR高信号,ADC高信号,DWI未见弥散受限,增强脑回样强化,DWI可见左侧额顶叶旁条索状等高信号(见图2D~F)。头部CTA:未见明显血管狭窄。1.5脑静脉(MRV):左侧乙状窦及横窦未见显影(见图3A、B)。脑电图:未见明显痫样活动。自免免疫性脑炎8项抗体(脑脊液和血清)阴性,副肿瘤综合征11项抗体(血清)阴性。头部CTP:左侧顶叶TTP、MTT较对侧明显延长,CBF、CBV对侧明显降低(见图3C~E)。患者老年女性,急性起病,以精神行为异常、癫痫等高级皮质异常为主症,病灶短期内出现并逐渐进展,由皮质下白质向脑室旁白质进展,影像呈血管源性水肿,病灶位于上矢状窦引流区,但MRV上矢状窦通畅,需考虑孤立皮质静脉血栓形成。此外从患者临床特征及影像表现需要鉴别脑淀粉样血管病相关炎症,拟进一步完善SWI。因自勉脑抗体均阴性予减停甲泼尼龙。7月31日头部MRI+SWI:SWI可见皮质静脉血栓形成、静脉代偿扩张及微出血,余同前(7月28日)(见图2G、H)。蛋白C测定 77.0%(正常值70%~140%),蛋白S测定41.6%(正常值59%~118%)。考虑患者微出血相对局限,仅位于病灶内,且SWI可见血管低密度信号条索征提示静脉血栓形成,明确诊断:孤立皮质静脉血栓形成,易栓症(蛋白S活血缺乏),予克赛4000 U ihbid(2021年7月31日-8月17日),后改予口服利伐沙班15 mg qdpo抗凝治疗。8月9日复查头部CT提示左侧顶叶病变较前明显消退(见图1C)。12月6日患者未再出现癫痫发作,无明显精神行为异常,复查头部MRI+SWI提示左侧顶、侧脑室后角异常信号基本消退,T1WI可见皮质高信号,考虑皮质层状坏死,SWI仍可见条索状低信号,代偿扩张静脉影较前减少(见图2 I~L)。
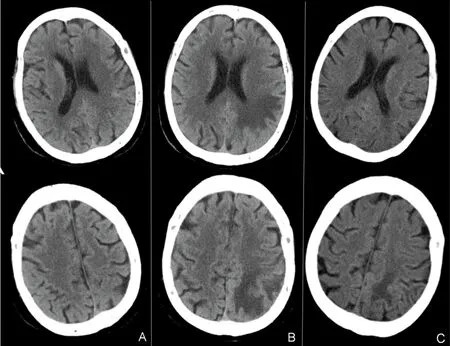
图1 头部CT影像。A:2021年7月4日;B:2021年7月24日;C:2021年8月9日
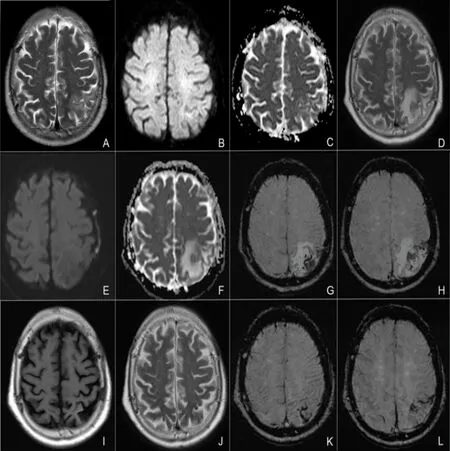
图2 头部MRI影像。A~C:2021年7月6日,A:T2WI;B:DWI;C:ADC;D~F:2021年7月28日;D:T2WI;E:DWI;F:ADC;G、H:2021年7月31日,SWI;I~L:2021年12月6日,I:T1WI,J:T2WI,K、L:SWI
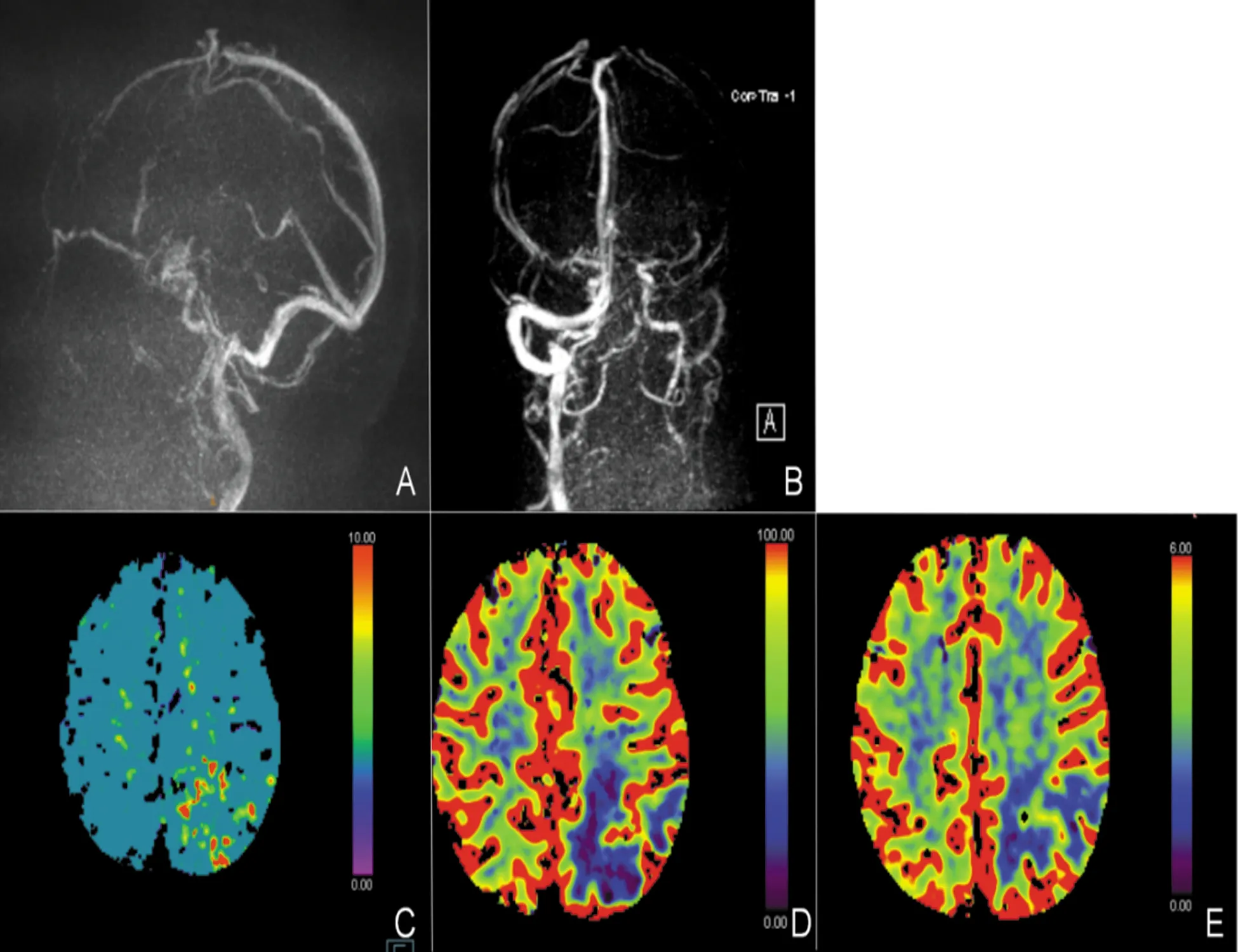
图3 A、B :头部MRV;C~E:头部CTP;C:MTT,D:CBF,E:CBV
2 讨 论
由于ICoVT临床特征、影像表现缺乏特异性,易出现漏诊误诊,造成不可逆的神经功能残障。本患者以急性精神行为异常为突出表现的ICoVT,患者入院前20 d曾因癫痫就诊于外院,诊断为“癫痫持续状态”,未进行进一步病因诊断。通过对患者入院前后影像表现(近皮质脑实质异常)动态变化及其他辅助检查,最终将诊断缩小在孤立皮质静脉血栓形成(ICoVT)和脑淀粉样血管病相关性炎症(cerebral amyloid angiopathy-related inflammation,CAA-I),最终经磁敏感加权成像(susceptibility weighted imaging,SWI)明确诊断ICoVT。
2.1 ICoVT病因 许多局灶或全身性因素可导致孤立性皮质静脉血栓形成,如感染、妊娠或产褥期、脱水、口服避孕药、腰椎穿刺、凝血功能障碍和自身免疫性疾病、恶性肿瘤、外科手术、低颅压、创伤和药物治疗等[3,4],但仍有20%~35%病因是不明的[5]。一项病例报道分析了51例ICoVT,排在前3位病因凝血功能异常(44.2%)、低颅压(23.3%)和感染(14%)[4]。相关病因对ICoVT具有提示意义,且病因的识别决定抗凝治疗疗程。
2.2 ICoVT临床表现 临床表现取决于血栓形成的位置和程度,以及功能性侧支循环的存在。在一项大规模研究中[3],ICoVT从症状出现到明确诊断的中位时间间隔为7 d(平均23 d),71%的患者出现头痛,58%出现癫痫发作,62%的患者存在局灶性神经功能缺损,包括运动和感觉障碍、失语、阅读障碍等。另一篇文献报道ICoVT主要临床表现为癫痫(66.7%)和头痛(64.7%)[4],而CVT临床表现主要以头痛为主(约90%),其次为癫痫(约40%)[6],与CVT静脉窦阻塞常引起颅内压增高有关。既往文献报告还可见精神障碍[7]等。虽然孤立皮质静脉血栓形成较少产生颅内压升高的症状,但若诊断及治疗不及时可表现为明显占位效应导致颅高压症状[8]。虽然不同研究中临床症状占比有所不同,但最常见的症状都是头痛、癫痫和局灶性神经功能缺损[9],要提高此类非特异性症状警惕性,注意识别ICoVT可能。
2.3 ICoVT影像特征 早期诊断和治疗可以有效逆转ICoVT的疾病进程,并显著降低急性并发症和长期后遗症的风险,因此,对ICoVT的早期识别至关重要。诊断是基于皮质静脉血栓形成的识别,没有静脉窦和深静脉受累。ICoVT的影像表现可以分为直接征象和间接征象。影像检查可直接显示皮质静脉内血栓形成,称为直接征象,但它的出现与时间(从血栓形成到影像学检查)直接相关。在CT上可表现为条带状高密度或“条索征”,只有大约5%的病例可以看到这种征象[10],并在1 w~2 w内消失[11]。MRI上的信号特点取决于成像时血栓的期龄,信号演变同血肿相似,急性期(0~5 d)可表现为T1WI等信号、T2WI低信号,与正常静脉留空影相似,亚急性期(6~15 d)T1WI和T2WI均为高信号,而慢性期(>15 d) T1WI和T2WI均为低信号,因此,亚急性期影像特征较易识别[12],若病程为急性期,至亚急性期复查影像可提到诊断率。但单纯依赖头部MRI平扫(T1WI、T2WI)、MRV成像诊断ICoVT存在困难,主要原因有以下几个方面:(1)皮质静脉数量、大小和位置解剖变异较大;(2)通过常规MRI很难在皮质层面发现闭塞的小静脉;(3)只有闭塞大的静脉或累及静脉窦才可在MRV中发现[12]。当MRI、MRV不能识别ICoVT时,进一步通过数字减影血管造影(Digital subtraction angiography,DSA)来确认血管异常。但DSA在诊断单纯皮质静脉血栓形成不具有明显的优势[2]。
综上所述,常规MRI在ICoVT急性期较难做出诊断,如何在早期选择恰当的影像检查手段对诊断ICoVT尤为重要。弥散加权成像(Diffusion-weighted images,DWI)可观察到静脉腔内“血栓高信号”及血栓临近部位“血栓磁敏感信号”[13]。血栓高信号多发生在超急性期和亚急性晚期[14],约41%的亚急性期 CVT患者在DWI上可观察到静脉腔内的高信号血栓[15]。而血栓磁敏感信号,多发生于急性-亚急性早期。因此,血栓高信号和血栓磁敏感信号同时评估,近80%的CoVT可能出现DWI阳性发现,这是对常规序列的重要补充[13]。其中,SWI对急性期CoVT的诊断敏感度最高,皮质静脉血栓形成时,局部还原型血红蛋白浓度增加,在磁敏感成像上表现为受累静脉较为特征性的低信号改变,特别是在血栓形成的早期阶段[16]。此外SWI还可显示病灶内周围代偿扩张的静脉(早期)和微出血(中晚期),提高ICoVT诊断率。因此,SWI是目前诊断ICVT最敏感的成像技术[17]。此患者复查的头部DWI可观察到“血栓高信号”,但是在明确诊断ICoVT后复习影像时才注意到,因此,ICoVT“直接”影像征象建立在临床怀疑或诊断的基础上更容易发现,故要保持ICoVT警惕性。
皮质静脉血栓形成可导致静脉高压、水肿、梗死或出血等继发性改变,称为间接征象,通常位于皮质下,不符合典型的动脉供血区,符合相应的静脉引流区。这些征象往往是首先被观察到的或者是唯一的发现,CoVT脑实质性改变发生率大于CVT(84.3% vs 63%)[6]。CT可见脑沟消失、弥漫性脑实质水肿、灰白界限模糊、出血或脑室受压[18]。脑实质的改变在MRI上更容易观察,影像特征往往不符合典型动脉供血区,此外,轻微的瘀点出血,通常在CT上隐匿,往往在SWI更容易显现。
与动脉源性脑梗死相比,许多继发于静脉闭塞的实质异常是可逆的。皮质静脉梗死导致回流受阻,静脉内压力升高,形成血管源性水肿(ADC值升高),严重时可导致动脉灌注减低造成细胞毒性水肿(ADC值降低)[19]。血管源性水肿(ADC值升高)区域随静脉闭塞再通或侧支开放往往是可逆的。然而,细胞毒性水肿(ADC值降低)区域,可残留后遗病灶,也可能是可逆的,这与动脉源性梗死不同,其可能原因是由于脑血流减少、神经元肿胀和膜泵衰竭而没有神经元死亡[20]。同动脉源性梗死一样,可以利用CT perfusion(CTP)评估颅内静脉闭塞脑实质病变区域灌注情况,病理生理学特征是灌注异常(MTT延长,CBF正常或降低,CBV增高、正常或降低)导致脑组织功能紊乱,而MRI、DWI可无异常脑实质发现[21]。虽然间接征象不具有特异性,但其异常的影像特征却是首先引起关注的,它提示我们需要重视并积极寻找皮质和(或)静脉窦血栓直接征象[11]。影像的动态变化与颅内静脉血栓形成病理生理相关,由静脉高压到水肿到出血,影像表现为近皮质逐渐进展的白质血管源性水肿,合并脑出血或微出血。影像记录了此患者发病整个过程,可以看到血管源性水肿、低灌注、微出血,以及治疗后血管源性水肿逐渐消退。此患者CTP提示MTT延长,CBF降低,CBV降低,但对症治疗后患者头部MRI除遗留部分皮质层状坏死外基本完全回复,提示静脉源性梗死与动脉源性梗死差异较大,预后较好,大多数情况下病灶可逆。
基于ICoVT的神经放射学表现的鉴别诊断包括动脉源性脑梗死、脑肿瘤、进行性多灶性白质脑病、可逆性后部脑病综合征、可逆性脑血管收缩综合征、原发性中枢神经系统血管炎、脑淀粉样血管病相关性炎症(CAA-I)等。因CAA-I和ICoVT在临床表现和影像特征具有诸多相似性,尤其需要注意鉴别。CAA-I是血管壁对β淀粉样蛋白(amyloid β-protein,Aβ)的炎性反应,Aβ沉积可引起血管内炎症、血管周围炎症。以急性或亚急性精神状态或行为异常、局灶性神经功能缺损、癫痫发作和头痛为主要临床表现。影像表现为MRI可见单发或多发白质高信号并延伸至皮质下白质,SWI皮质、皮质下出血性病灶(脑微出血、脑出血、皮质表面铁沉积)[22]。虽然SWI对皮质静脉血栓形成具有重要的诊断价值[23],但ICoVT和CAA-I影像表现上有存在相似性,包括近皮质白质病变、微出血、凸面蛛网膜下腔出血、低灌注,且皮质静脉血栓“条索征”和蛛网膜下腔出血在SWI影像表现相似[24]。考虑到CAA-I往往需要大剂量类固醇激素冲击治疗[25],而激素是静脉血栓形成危险因素[26],对于颅内静脉血栓形成非治疗基础疾病的激素使用往往是无益的[27],同样皮质静脉血栓形成需要抗凝,而抗凝是CAA-I出血的危险因素[28]。然而有文献指出CAA是静脉血栓形成危险因素可存在共病[29]。此患者此次住院以精神行为异常为主要特征,除SWI外影像特征基本符合CAA-I,最终经SWI诊断为ICoVT,经抗凝治疗后复查影像病灶消退,进一步支持ICoVT。
2.4 ICoVT治疗和预后 根据CVT的治疗指南[30],CoVT急性期推荐使用治疗剂量的肝素或低分子肝素进行抗凝。急性期抗凝治疗后,一般应继续口服抗凝药物,常用药物为华法林,新型口服抗凝药达比加群的疗效和安全性与华法林类似,但比华法林使用方便[2]。抗凝治疗的持续时间取决于病因学,对于可去除的诱发CVT抗凝3~6个月,对于危险因素不明CVT抗凝6-12个月,复发CVT或伴有严重遗传性血栓形成的CVT考虑长期抗凝[2]。除抗凝治疗外,潜在的病因也应进行筛查和管理。抗癫痫药物不应常规给予预防,但如果癫痫发作应迅速开始[2]。ICoVT未见血管内治疗报道[3],但CoVT合并静脉窦血栓形成有血管内治疗报道[9],部分ICoVT出现明显占位性、颅高压症状可去骨瓣减压[3]。通常的总体预后良好,79%的ICoVT患者完全恢复[6],及时诊断和治疗可能是良好预后和预防并发症的关键。
综上,ICoVT病因多为凝血功能异常,颅高压症状在皮质静脉血栓形成中不常见,多表现为癫痫、头痛、精神行为异常等非特异性症状。明确的诊断通常是基于临床怀疑,通过影像学证实。影像学SWI可见血栓低信号影、病灶内微出血及代偿扩张静脉影,DWI可见血栓高信号影,尤其是SWI对于皮质静脉血栓形成诊断具有重要意义。尤其强调头部MRI动态复查对于ICoVT亦具有重要指导意义,因皮质静脉血栓形成静脉压增高致血管源性水肿,病灶呈动态进展:由皮质下白质向深部白质,抗凝治疗后或血栓再通后血管源性水肿逐渐消退,如同“潮涨潮落”。因此,对于非特异性临床表现,如癫痫、精神行为异常、认知障碍等,颅内病灶不符合经典动脉供血区并累及皮质,多种影像手段评估是必要的,尤其是SWI,有利于早期识别ICoVT。
