基于基因芯片对癫痫小鼠海马组织miRNA-204表达的研究及生物信息学分析
2022-08-09吕婷婷刁丽梅
吴 琼, 吕婷婷, 刁丽梅
癫痫(Epilepsy)是由于大脑神经元异常放电引起短暂大脑功能失调的神经系统疾病,对患者学习和生活产生严重影响。全球每年有240万人被诊断为癫痫,近30%的患者抗癫痫药物无法控制癫痫发作,急需新的治疗方法[1]。MicroRNA(miRNA)是一种长度为20~24个核苷酸的内源性非编码蛋白的RNA,其通过与靶基因特定序列相互作用,调节靶基因表达的活性。miRNA异常的调节对癫痫的发生发展产生重要的影响,可能成为癫痫的潜在生物标记物和治疗靶点。本研究利用基因芯片技术挖掘差异基因,并对差异基因进行生物信息学分析,探索miRNA对癫痫治疗靶点作用机制,开拓癫痫诊断与治疗新的思路。
1 材料与方法
1.1 材 料
1.1.1 实验动物 雄性昆明小鼠20只,清洁级,约25~30 g。昆明小鼠由广西医科大学动物实验中心购买。
1.1.2 实验试剂和仪器 盐酸匹罗卡品(美国Sigma公司)、氯化锂(中国医药集团上海试剂公司)、硫酸阿托品注射液(郑州铃锐制药有限公司)、Aglient 2100 Bioanalyzer(美国Agilent公司)、Thremo Nanodrop 2000(美国 Thremo公司)、GeneChip Scanner 3000(美国Affymetrix公司)、GeneChip Fluidics Station 450(美国Affymetrix公司)、GeneChip Hybridization Oven 645(美国Affymetrix公司)。
1.2 方 法
1.2.1 模型制备 将制昆明小鼠按随机数字表法随机分为造模组和对照组。造模组:昆明小鼠腹腔注射氯化锂(127 mg/kg),18~24 h后注射阿托品 (1 mg/kg),30 min后腹腔注射匹罗卡品(10 mg/kg),每2 d进行造模实验1次,共5次,Ⅳ级以上发作为造模成功。对照组:同样方法注射生理盐水。
1.2.2 实验过程 分别取造模组和对照组小鼠脑部海马组织,进行基因芯片检测,选出模型组和对照组表达差异的基因。采用miRNA靶基因预测工具TargetScan、rna22、miRBase进行预测并取交集。利用DAVID数据库,将取交集后靶基因基因按功能分为3大类:生物学过程、细胞组分和分子功能3类,后进行KEGG通路分析。
1.2.3 统计学分析数据 使用SPSS 21.0进行处理,组间比较使用t检验,P<0.05 为差异有统计学意义。
2 结 果
2.1 差异基因 根据实验结果,筛选|FC|≥ 1.5的miRNA进行预测分析:相对表达增多的差异miRNA 10个,相对表达减少差异miRNA 18个,结合实验结果及相关文献,选取 miRNA-204进行预测分析。
2.2 靶基因预测 采用TargetScan共预测到miRNA-204靶基因6762个,rna22共预测到miRNA-204靶基因14335个,miRBase共预测到miRNA-204靶基因587个,取三者交集得到457个共同的靶基因。
2.3 靶基因GO分析 通过DAVID分析工具对miRNA-204靶基因进行分析发现,miRNA-204靶基因靶基因富集于21个基因功能(P<0.01)。miRNA-204靶基因富集在生物学过程:大脑发育、磷脂酰肌醇代谢过程、离子运输、蛋白质运输、蛋白质硫酸化、类固醇激素介导的信号传导、线粒体去极化、细胞对缺氧的反应、GTP酶介导的信号转导、肌动蛋白细胞骨架组织等相关生物学过程。miRNA-204靶基因主要作用在:突触后膜、高尔基体膜、细胞核、细胞质内等细胞组分。miRNA-204靶基因富集的分子功能包括:与蛋白质结合和金属离子结合、调控类固醇激素受体活性及GTPase活化剂活性(见图1)。
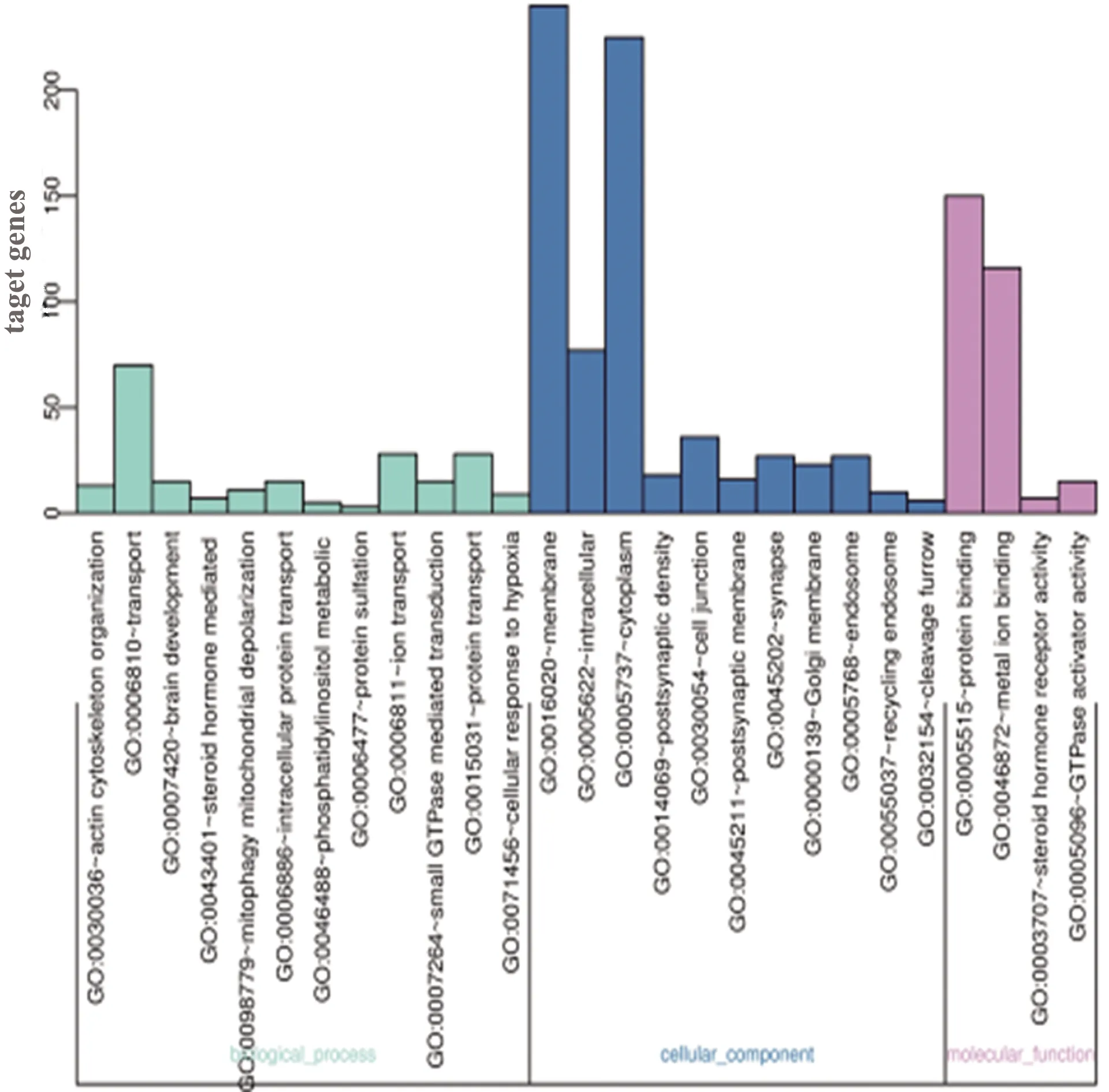
图1 miRNA-204靶基因富集分析
2.4 miRNA-204靶基因KEGG分析 miRNA-204靶基因主要富集在16条通路中(P<0.05):Wnt信号传导通路、磷脂酰肌醇信号系统、神经活性配体-受体相互作用通路、鞘脂信号转导通路、钙信号通路、Hippo信号通路、cGMP-PKG信号传导通路、癌细胞胆碱代谢、血管平滑肌收缩、昼夜节律、胰腺分泌、唾液分泌等相关通路(见图2)。
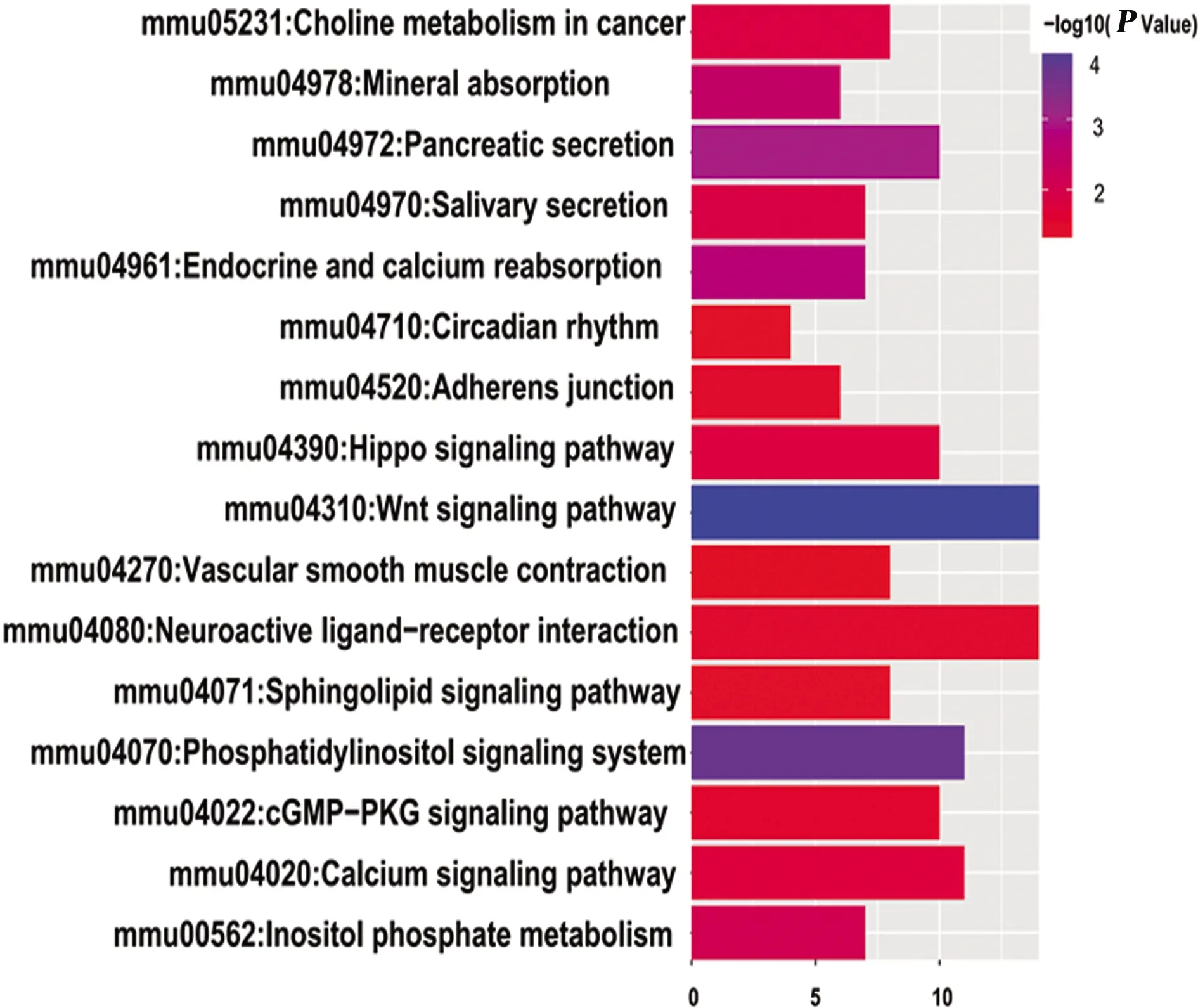
图2 miRNA-204靶基因KEGG分析
3 讨 论
本实验研究利用基因芯片发现miRNA-204在氯化锂-匹罗卡品癫痫小鼠海马组织表达减少。已有研究报道与本实验基因芯片检测结果相一致:Raoof R等[2]研究发现,miRNA-204在颞叶癫痫及癫痫持续状态患者的脑脊液中表达显著减少,Xiang等[3]研究也显示在体外培养的癫痫持续状态海马神经细胞中miRNA-204显著下调,miRNA-204 通过调节 TrkB 和下游ERK1/2-CREB信号通路在海马神经元模型中发挥抗癫痫作用。在Xia等[4]在胶质细胞瘤继发的癫痫脑组织中发现,miRNA-204表达水平明显低于正常脑组织的表达量,并且发现miRNA-204可以显著抑制了胶质瘤细胞的生长、迁移和侵袭。
本实验研究中预测的miRNA-204靶基因的功能GO富集显示:miRNA-204与大脑发育关系密切,相关研究也证实miRNA-204在神经发育过程中起关键作用,包括在轴突诱导控制中的作用和在神经系统发育中的重要作用[5]。miRNA-204在惊厥性脑损伤后表达显著增加,可减少惊厥诱导的神经细胞凋亡,加速神经细胞轴突的生长与延伸[6]。然而,一些研究也提示miRNA-204可导致大脑海马神经元突触可塑性下降,影响海马组织调控的认知功能改变。随着年龄增长,海马中miRNA-204表达上调,而EphB2和NR1表达降低,miRNA-204可通过调控EphB2和NR1影响海马突触可塑性下降,可能导致年龄相关认知功能的改变[7]。在KEGG通路分析显示miRNA-204靶基因富集于Wnt信号通路的有:AF366264、VANGL1、BTRC、PRKCG、FZD3、DAAM1、DAAM2、WNT2、MAP3K7、RAC2、SFRP1、PRICKLE2、PLCB1、FBXW11。
经典Wnt/β-catenin通路调节海马神经发生、突触分裂和线粒体调节,对中枢神经系统的发育和功能至关重要[8]。相关的研究发现,β-catenin在对低氧发作反应中出现巨大的转录变化,β-catenin在神经元结构的形成和维持以及促进突触可塑性方面具有重要作用[9]。另一项研究通过使用Wnt通路抑制剂,减少了红藻氨酸诱导小鼠癫痫发作次数,显示了Wnt通路治疗癫痫潜在有效性[10]。Wnt信号通路参与癫痫急性期和慢性期,诱发的神经发生和神经元死亡[11],急性期癫痫发作时Wnt信号通路激活,导致了短暂的神经代谢的改变,随着癫痫发作的持续,Wnt信号通路将激活mTOR通路,导致癫痫慢性发作。癫痫发生的早期有一个治疗窗口,Wnt信号通路启动了短暂的代谢,这一系列的代谢重组变化可能影响神经异常发生和分化,从而影响癫痫敏感性[12]。同时值得注意的是,长链非编码RNA Uca1可以通过降低miRNA-375的水平来促进Sfrp1的表达,进而通过抑制Wnt/β-catenin通路的激活,抑制癫痫小鼠神经元细胞的异常增殖,预防癫痫发作[13]。长链非编码RNA Peg13可通过miRNA-490-3p/Psmd11轴抑制Wnt/β-catenin通路,减缓小鼠癫痫进展[14]。
癫痫是最常见的神经系统疾病之一,在临床中有许多患者对目前所有可用的治疗药物都有一定的耐药性。现有的抗癫痫药物治疗主要是减少兴奋和预防癫痫发作,但不能影响疾病的潜在病理生理。最近,有许多研究工作集中在确定抗癫痫治疗的机制靶点,以防止慢性癫痫的进展。在本实验中预测miRNA-204的靶基因富集功能和KEGG通路部分已经被证实,其中Wnt/β-catenin信号通路可能是未来抗癫痫治疗的十分有前景的癫痫治疗靶点。本课题组将在以后的研究中对miRNA-204靶基因和Wnt/β-catenin信号通路完善相关实验研究,进一步验证其对癫痫发生发展的影响。
