基于CRISPR/Cas13a技术检测肿瘤驱动基因TP53 R248W的研究
2022-08-09邝振展孙朝晖何洁雯李林海
邝振展,肖 斌,孙朝晖,罗 镕,何洁雯,李林海*
1中国人民解放军南部战区总医院检验科,广东 广州 510010;2广州医科大学附属第六医院(清远市人民医院)检验医学部,广东 清远 511518;3广州医科大学金域检验学院,广东 广州 510180;4广州南方学院云康医学与健康学院,广东 广州 510970
肿瘤蛋白53(tumor protein 53,TP53)是最重要的抑癌基因之一,其编码蛋白P53 是胞内关键的转录因子,能够调控P21、Bcl⁃2相关X蛋白(BCL2 asso⁃ciated X,BAX)等多种靶基因的表达水平,广泛参与DNA 损伤修复、细胞凋亡、细胞周期调控等多种重要进程[1]。TP53 功能获得性突变常导致其抑癌功能的丧失,如R273H、R175H、R248W 等,其中R248W突变不仅导致其抑癌功能丧失,还能够促进肿瘤恶性表型和侵袭,导致患者预后较差,而有研究发现阿霉素对携带TP53 R248W突变的患者治疗更为敏感[2-3]。因此,对TP53 R248W 变异体的检测不仅有助于预警肿瘤的发生发展,还能指导肿瘤的治疗和用药。目前,组织和血浆中TP53 R248W 的检测手段主要有数字PCR、高通量测序、突变扩增系统等。数字PCR 准确度高,但成本高,对仪器和操作人员要求高;高通量测序灵敏度高但实验流程复杂;突变扩增系统操作简单但稳定性欠佳,所以亟需寻找一个新的灵敏度高、稳定性好及成本低的肿瘤驱动基因检测方法[4]。
成簇的规律间隔的短回文重复序列(clustered regularlyinterspacedshortpalindromicrepeats,CRISPR)及其相关蛋白是近年来火爆的研究热点,在RNA干扰和基因编辑等领域有着巨大的潜力[5]。其中,CRISPR 相关蛋白13a(CRISPR⁃associated protein 13a,Cas13a)是一种新发现的Ⅱ类、Ⅵ型Cas 效应蛋白,其活性由高等真核生物和原核生物核苷酸结合(higher eukaryotes and prokaryotes nucleotide⁃bind⁃ing,HEPN)结构域决定[6]。与Ⅱ型Cas9 不同,Cas13a 属于RNA 酶分子,在CRISPR RNA(crRNA)的引导下,Cas13a 结合靶RNA,激活HEPN 结构域,从而特异性水解靶RNA 及‘连带剪切’周围RNA 分子[7⁃8],但当Cas13a/crRNA 复合物与非靶RNA 结合时,Cas13a的RNA酶特性被抑制[9]。
本研究利用Over⁃lap PCR 技术,构建TP53 R248W变异体质粒作为检测对象,设计特异性的靶标crRNA,并根据Cas13a 蛋白的‘连带剪切’特性,实现对TP53 基因R248W 突变的快速检测,以期建立新的、快速、简便以及灵敏的肿瘤驱动基因检测方法,为肿瘤的治疗及监控提供帮助。
1 材料和方法
1.1 材料
Cas13a 蛋白(M20201)、FAM 荧光探针(H2001⁃2023)和本研究设计的crRNA 购自于广州博徕斯生物公司,所设计扩增引物由威海四合生物公司合成,具体序列见表1。T7转录酶试剂盒(JT101⁃01)、高保真DNA 聚合酶(AP231⁃13)、RNA 酶抑制剂(AI101⁃01)(北京全式金生物)。Top10 感受态细胞(B528412)(上海生工生物工程公司)。RAA试剂盒(TABAS03KIT)(TwistDx 生物公司,英国)。T4 连接酶(6022Q)、XhoⅠ限制酶(1094S)及KpnⅠ限制酶(1068S)(TaKaRa 公司,日本)。血浆DNA 提取试剂盒(D3182⁃03C)(Magen 生物公司,美国)。ABI 9700 PCR仪(赛默飞公司,美国)。荧光检测仪(Bio⁃Rad 公司,美国)。TP53 野生型质粒、pENTER 空载体由本课题组实验室提供。

表1 突变株的构建引物、RAA引物、crRNA序列和探针序列Table 1 Mutant strain primer,RAA primer,crRNA sequence and probe sequence
1.2 方法
1.2.1 TP53 R248W标准品的构建
以野生型TP53质粒为模板,使用TP53⁃F&Rm和Fm&TP53⁃R两对引物分别扩增TP53 R248W突变位点前后段序列,使扩增前后段序列均携带有R248W点突变,然后进行重叠(Over⁃lap)PCR将上述两个片段融合。融合产物经限制酶XhoⅠ和KpnⅠ双酶切后,使用T4 连接酶将它与pENTER 载体进行连接。连接产物转化入Top10细胞,取菌液进行测序鉴定。
1.2.2 PCR或RAA扩增TP53 R248W变异体
本研究使用两对扩增引物Primer1(R248W⁃RAA⁃F&R248W⁃RAA⁃R1)和Primer2(R248W⁃RAA⁃F&R248W⁃RAA⁃R2),利用PCR 或重组酶介导链置换核酸扩增技术(recombinase aided amplification,RAA)扩增技术,按说明书指导扩增出含TP53 R248W 突变序列片段。PCR 的扩增体系如下:TP53 R248W 质粒(1 μmol/L)1 μL,前、后引物混合物(10 μmol/L)2 μL,高保真聚合酶混合物25 μL,纯水22 μL。将上述试剂充分混匀后,进行PCR扩增,PCR 的扩增程序如下:98 ℃预热5 min,然后98 ℃10 s,58 ℃15 s,72 ℃30 s,循环40 次,最后72 ℃孵育10 min。RAA的扩增体系如下:TP53 R248W质粒(1 μmol/L)1 μL,前、后引物混合物2 μL,RAA反应液29.5 μL,MgCl22.5 μL,纯水15 μL。将上述试剂充分混匀后,加入RAA干粉管中,然后39 ℃孵育20 min。
1.2.3 CRIPSR/Cas13a 方法对TP53 R248W变异体检测
对步骤1.2.2 的扩增产物进行检测,体系如下:扩增产物2 μL,crRNA(1 μmol/L)1 μL,Cas13a蛋白(10 μmol/L)1 μL,荧光探针(10 μmol/L)1 μL,T7转录酶1 μL,RNA酶抑制剂1 μL,T7 buffer(5×)4 μL,NTP 2 μL,无RNA酶纯水补足反应体系至20 μL,混匀后置于Bio⁃Rad CFX 荧光检测仪,37 ℃检测1 h,记录各时间段的相对荧光值(relative fluorescence unit,RFU)。
1.2.4 CRIPSR/Cas13a检测体系中crRNA浓度的优化
将crRNA 梯度稀释成5 个浓度,使检测反应体系中的crRNA 终浓度分别为0.05、0.10、0.15、0.20、0.25 μmol/L。除crRNA 外,CRIPSR/Cas13a 检测反应体系如步骤1.2.3。
1.2.5 CRIPSR/Cas13a 方法对不同突变率TP53 R248W的检测
将浓度为1×103、1×104、1×105、1×106拷贝数(copies)/μL的TP53 R248W质粒分别与1×107copies/μL的TP53 野生株混合1∶1 混合,形成突变频率为0.01%、0.1%、1%、10%,取2 μL混合物进行PCR扩增,然后用上述优化的CRIPSR/Cas13a方法进行检测。
1.2.6 CRIPSR/Cas13a方法对模拟血浆ctDNA的检测
将浓度为1×103、1×104、1×105、1×106、1×107、1×108copies/μL 的TP53 R248W 质粒取1 μL 分别与1 mL 经基因检测无TP53 突变的人血浆混合,构建TP53 R248W 突变基因浓度分别为1×100、1×101、1×102、1×103、1×104、1×105copies/μL的模拟血浆。使用血浆DNA提取试剂盒,按说明书操作提取模拟血浆ctDNA,取2 μL 模拟血浆ctDNA 进行PCR 扩增,随后使用上述优化的CRIPSR/Cas13a方法进行检测。
1.3 统计学方法
采用SPSS 19.0 软件进行统计学分析。计量资料经K⁃S正态性检验,若呈正态分布,采用方差分析或者t检验,若呈偏态分布,采用非参数Mann⁃Whit⁃neyU检验。计数资料用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 TP53 R248W变异体质粒的构建
根据PCR 点突变技术,利用两对携带TP53 R248W(C>T)点突变的引物,将TP53野生型序列扩增成前后2个片段,这两片段均含有突变位点序列,以及前段的3′端及后段5′端存在互补序列(图1A),然后使用Over⁃lap PCR 将2个基因片段融合成完整的TP53 R248W 变异体(图1B),经与pENTER 质粒连接后转化入Top10 感受态,测序结果显示TP53 R248W变异体质粒构建成功。

图1 TP53 R248W突变株构建电泳结果与测序结果Figure 1 The result of electrophoresis and sequencing of TP53 R248W mutant strain
2.2 CRISPR/Cas13a 联合PCR 或RAA技术检测TP53 R248W突变株
根据TP53 R248W变异体序列设计两对扩增引物(Primer 1和Primer 2)。对于Primer 1和Primer 2,PCR 和RAA 技术均成功扩增出约110 bp 和368 bp的片段(图2A)。使用CRISPR/Cas13a 方法检测扩增产物,结果表明,在10 min内,各组RFU值均达到平台期,但基于Primer 1 扩增的片段,TP53 R248W变异体的RFU 值与野生型相比无显著性差异(P>0.05);而基于Primer 2 扩增的片段,变异体的RFU值显著高于野生型(P<0.001,图2B、C)。

图2 Primer1和Primer2扩增产物的电泳结果及CRISPR/Cas13a检测结果Figure 2 The result of electrophoresis and CRISPR/Cas13a for Primer1 and Primer2 amplification product
2.3 不同浓度crRNA对TP53 R248W变异体检测结果的影响
为了探究不同浓度的crRNA对TP53 R248W变异体检测结果的影响,对crRNA 进行了梯度浓度稀释,并分别进行CRISPR/Cas13a检测。结果表明,在0.05~0.25 μmol/L 范围内,随着crRNA 浓度的增加,RFU值也随之增大,其中crRNA浓度达到0.20 μmol/L及以上时,差异具有统计学意义(P<0.001),表明crRNA 浓度的上升会提高TP53 R248W 变异体的检测强度(图3)。

图3 不同浓度crRNA对CRISPR/Cas13a检测强度的影响Figure 3 The effect of different crRNA concentrations for CRISPR/Cas13a detection
2.4 CRISPR/Cas13a 检测不同突变频率的TP53 R248W
为探究CRISPR/Cas13a方法对不同突变频率的TP53 R248W 的检测效果,通过按比例混合TP53 野生型和R248W变异体质粒,获得了不同突变频率的变异体。以混合质粒为模板,扩增含突变位点的序列片段(图4A)。使用CRISPR/Cas13a 技术检测扩增产物,结果显示,不同突变频率的变异体检测结果RFU 值显著高于野生型,差异具有统计学意义(P<0.05),其中,本研究方法最低可以检测出突变频率为0.01%的混合质粒(含有1×103copies 的变异体),表明TP53 基因野生型的存在基本不影响TR248W变异体的检出(图4B)。
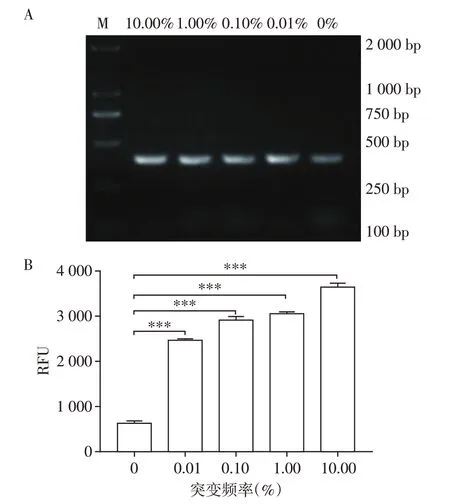
图4 CRISPR/Cas13a对不同突变频率TP53 R248W的检测Figure 4 CRISPR/Cas13a detection to different mutation frequency of TP53 R248W
2.5 CRISPR/Cas13a对模拟血浆ctDNA的检测
为探究CRISPR/Cas13a 技术对模拟血浆ctDNA的检测效果,以模拟血浆ctDNA 为模板,扩增含突变位点的序列片段(图5A)。使用CRISPR/Cas13a技术检测扩增产物,结果显示,当血浆中的TP53 R248W 变异体浓度达到1×104copies/μL,其RFU 值明显高于野生型血浆,差异具有统计学意义(P<0.01),表明本研究方法最低能检测出模拟血浆中浓度为1×104copies/μL的TP53 R248W变异体(图5B)。

图5 CRISPR/Cas13a对模拟血浆ctDNA的检测Figure 5 CRISPR/Cas13a detection to mimic plasma ctDNA
3 讨论
Cas13a 蛋白在体外具有RNA 酶活性,因此,研究者探索了其在病原微生物核酸检测及基因分型中具有潜在的应用价值[10-12]。Gootenberg 等[13]通过对Cas13a 蛋白、RNA荧光探针及侧向层析试纸的联合使用,成功对登革热或和寨卡病毒单链RNA进行了检测。Fozouni 等[14]为提高Cas13a 蛋白对SARS⁃CoV⁃2 病毒核酸检测的灵敏度,在同一反应中使用多个crRNA,并且通过一个手持小型设备,实现快速便携地获取结果。Ke 等[15]为降低Cas13a 蛋白的脱靶效应,在crRNA 的3′末端添加发夹结构,并将改进的技术成功应用在乙肝病毒DNA 的分型。本文探究了CRISPR/Cas13a 技术可否对多态性核酸(如TP53 R248W)进行鉴别,从而为肿瘤驱动基因的检测提供新的帮助。
本研究设计了两对扩增引物Primer1和Primer2,其扩增产物长度分别为110 bp和368 bp。结果显示CRISPR/Cas13a 技术不能检测Primer1 的扩增产物,而可以有效检测Primer2 的扩增产物,说明靶RNA长度可能影响CRISPR/Cas13a 的的检测效能,推测是较短的靶标RNA 与Cas13a/crRNA 形成的复合物所获得的自由能不能激活Cas13a的RNA酶活性[15]。
为了探究不同扩增方法对CRISPR/Cas13a技术的影响,本研究使用了PCR 和RAA 两种扩增技术。结果表明CRISPR/Cas13a检测结果没有因扩增方法不同而显示出差异。一般而言,RAA方法不需要专用的仪器,实验时间短,大多30 min内可完成扩增,但目前测试价格比较昂贵;PCR 需要专用的PCR仪,实验所需时间长,但价格相比RAA 便宜[16]。目前,肿瘤驱动基因检查对结果报告时间没有太高的要求,因此扩增技术可以选用更为便宜的PCR方法。
据报道,crRNA的间隔序列在重复序列的3′端,且长度为28 nt时,功能发挥最佳[17],因此,本研究的crRNA间隔序列也设计在重复序列的3′端且长度为28 nt,并通过CRISPR/Cas13a 检测结果证实了这一结论。同时报道称,当crRNA与靶RNA结合出现碱基配对错误时,Cas13a 依旧具有RNA 酶活性,这对多态性 单核苷酸(single nucleotide polymorphism,SNP)的鉴定造成了干扰[18]。因此,本研究将R248W 突变碱基设计在crRNA 的间隔序列的5′末端,并引入新的错配碱基C,结果发现,当crRNA 的间隔序列的5′末端与野生型RNA之间有两个错配碱基,而与变异体RNA 之间只有一个错配碱基时,可以有效地区分野生型和变异体。另外,本研究发现crRNA 浓度与CRISPR/Cas13a 检测强度呈正相关,在0.05~0.25 μmol/L 范围内,crRNA 浓度越高,CRISPR/Cas13a检测强度越大。
通过混合TP53 野生型和R248W 变异体,构建了不同突变频率的TP53 R248W 变异体,结果显示CRISPR/Cas13a 方法最低可检出突变频率为0.01%的TP53 R248W 变异体(1×103copies),与同类型报道检测的灵敏度相当[13]。最后,通过对模拟血浆ctDNA的检测,发现CRISPR/Cas13a检测方法可以在血浆中检测出浓度为1×104copies/μL的TP53 R248W变异体,为下一步临床样本的检测提供重要依据。
综上所述,本研究建立的CRISPR/Cas13a检测方法能够快速、灵敏且高效地检出TP53 R248W 变异体,有效区分TP53 R248W 变异体与TP53 野生型,从而为TP53 R248W突变肿瘤的诊断及治疗提供极大帮助。另外,本研究建立的方法学也可应用于其他肿瘤驱动基因变异体的检测,从而为肿瘤基因检测提供了新的、多样性的技术手段。
