维生素D受体核定位信号的鉴定
2022-08-09马泽萌陈允梓
马泽萌,陈允梓
南京医科大学基础医学院免疫学系,江苏 南京 211166
维生素D(vitamin D,VD)是一种脂溶性维生素[1],不仅调节钙磷代谢和骨健康,在免疫系统[2]、神经系统和代谢系统中也发挥重要的调节作用,它通过与维生素D受体(vitamin D receptor,VDR)结合而发挥作用[3-4]。VD 与VDR 的结合能激活VDR 发生核转位,在细胞核内发挥转录因子功能,启动下游基因的表达,从而参与细胞的生长分化与免疫应答的调控[5-7]。
核定位信号(nuclear localization sequence,NLS)是蛋白质实现核转位的重要结构域,通常由4~8 个氨基酸组成的短序列,含有Pro、Lys和Arg。有研究表明,VD 在细胞内主要通过激活VDR 发生核转位发挥转录因子功能[8-9],VDR核定位信号可能位于两个锌指结构之间,其氨基酸序列与核定位相关[10-11],但缺乏精确定位和实验鉴定。研究表明,VDR在胞质中也发挥功能,它能与IKKβ相互作用并抑制NF⁃κB的激活[12]。因此,VDR的生物学功能与其细胞定位密切相关,确定VDR 的NLS 对深入了解VDR 信号具有重要意义。本研究采用软件分析预测NLS并进行点突变验证,确定了VDR的NLS序列及其对VDR 活性的影响,为VD 及VDR 的入核信号通路的调控提供理论依据。
1 材料和方法
1.1 材料
VD 由美国芝加哥大学Yanchun Li 教授赠送。胰酶、胎牛血清(Gibco 公司,美国),PVDF 膜(Bio⁃Rad公司,美国),Triton X⁃100、Tris、NP40、甘油和吐温20(合肥Biosharp公司),NaCl、KCl、EDTA(上海凌峰化学试剂有限公司),胶回收试剂盒、质粒小提试剂盒(上海Omega Bio⁃tek公司),HA抗体(Abmart公司,美国),Tublin 抗体、VDR 抗体(Santa Cruz 公司,美国),HRP 标记抗兔IgG 抗体、HRP 标记抗鼠IgG抗体(Jackson Immune Research 公司,美国),LaminB抗体、Tris⁃HCl pH 8.8、Tris⁃HCl pH 6.8、抗荧光猝灭剂、细胞核蛋白与细胞浆蛋白抽提试剂盒(上海碧云天技术有限公司),组织固定液(武汉赛维尔生物科技有限公司),Poly⁃JET(济南Signa⁃Gen),GAPDH抗体(武汉三鹰生物技术有限公司),所有引物由南京金斯瑞公司合成。SYBR Green QPCR 试剂盒、逆转录酶试剂盒、点突变试剂盒(Mut Express ⅡFast Mutagenesis Kit V2)(南京诺唯赞生物科技有限公司)。
pCMV⁃HA⁃VDR 质粒由本实验室提供[6],HEK293T和HeLa细胞来自美国ATCC。
1.2 方法
1.2.1 引物的设计
对质粒引入单碱基或多碱基的定点突变,引物设计如表1,采用点突变试剂盒在质粒pCMV⁃HA⁃VDR 上构建了突变体HA⁃VDR(R49W/R50G)、HA⁃VDR(K53Q/R54G/K55EP)、HA⁃VDR(R49W/R50G/K53Q/R54G/K55E)。
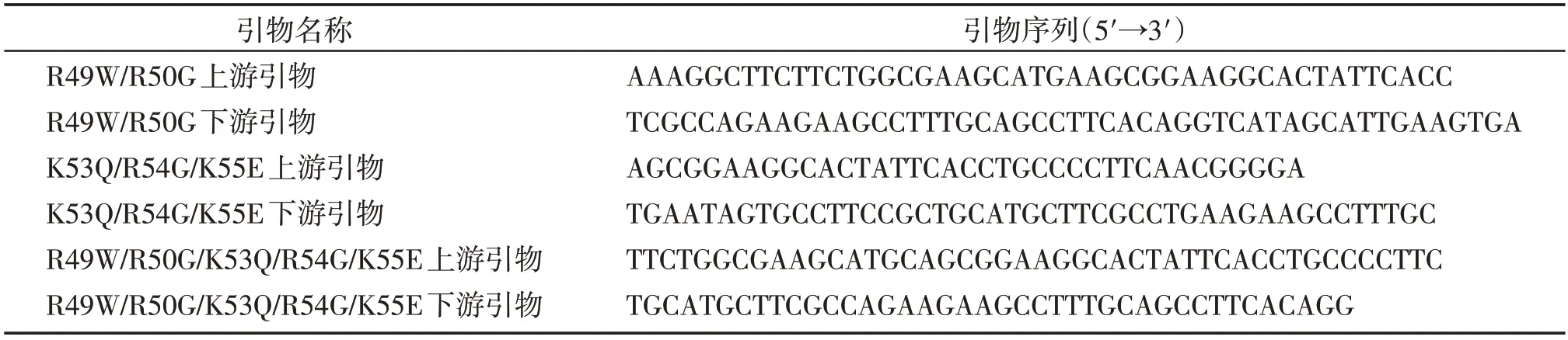
表1 VDR基因点突变引物Table 1 VDR gene point mutation primers
1.2.2 实时荧光定量PCR分析
在质粒转染及VD 刺激后,收集HeLa 细胞,采用TRIzol 试剂提取总RNA,并根据逆转录酶试剂盒说明书将其逆转录为cDNA,然后采用SYBR Green QPCR 试剂盒,在StepOnePlus(Applied Biosystems)上分析cDNA,进行靶基因的扩增(表2)。

表2 实时荧光定量PCR引物Table 2 Real⁃time fluorescent quantitative PCR primers
1.2.3 VDR的亚细胞定位分析
HEK293T 细胞进行质粒转染,经VD 处理后收集细胞。采用细胞核蛋白与细胞浆蛋白抽提试剂盒分别获得胞质和胞核组分,点样10%聚丙烯酰胺凝胶(SDS⁃PAGE)进行电泳分离,再经湿转法将蛋白转移到PVDF膜上,进行5%BSA室温封闭1 h。一 抗分别采用VDR、Tubulin和Lamin B 抗体,4 ℃孵育过夜,二抗为辣根过氧化物酶标记的羊抗免多聚抗体,室温孵育1 h。最后采用ECL 化学发光法检测,在蛋白分析仪拍摄下进行结果分析。
1.2.4 免疫荧光分析
细胞样品采用4%多聚甲醛固定,室温15 min,PBS清洗2遍,再用0.02%NP⁃40处理15 min。然后用QuickBlockTM免疫染色封闭液封闭15 min,进行一抗HA 抗体孵育,4 ℃过夜。次日,PBS(含0.5%Tri⁃tion X⁃100)清洗后,加入荧光标记的二抗室温孵育1 h。最后复染DAPI,细胞样品进行荧光显微镜的图像采集并分析。
1.3 统计学方法
实验数据用GraphPad Prism 7.0 软件进行统计学分析,各组数据用均数±标准差(x ± s)表示,多组定量资料比较采用单因素方差分析(one⁃way ANOVA)检验,多组间数据两两比较采用LSD 法。两组定量数据比较用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 VDR核定位信号的预测
为了初步确定VDR的核定位信号位置,借助在线预测网站对VDR 氨基酸全序列进行了分析(http://nls ⁃ mapper.iab.keio.ac.jp/cgi ⁃ bin/NLS_Map⁃per_form.cgi),预测结果显示核定位信号序列为49RRSMKRKALFLT61(图1A)。对不同物种来源的VDR进行序列比对,发现预测的核定位信号序列具有很好的保守性(图1B)。

图1 预测VDR核定位信号Figure 1 Predicting the nuclear localization signal of VDR
2.2 VDR突变体的构建
根据预测的结果和文献报道[10],针对VDR核定位序列中的保守氨基酸精氨酸(R)和赖氨酸(K)进行点突变设计,采用点突变试剂盒(Mut Express ⅡFast Mutagenesis Kit V2)以质粒pCMV⁃HA⁃VDR 为模板,构建了一系列突变体(R49W/R50G、K53Q/R54G/K55E 和R49W/R50G/K53Q/R54G/K55E),通过Vector NTI 软件对测序结果进行分析,结果显示VDR突变体成功引入突变点(图2)。

图2 构建VDR点突变Figure 2 Constructing VDR point mutations
2.3 VDR点突变抑制其入核能力
为了验证点突变是否对VDR核定位产生影响,将VDR 突变体(HA⁃VDR、HA⁃VDR⁃R49W/R50G、HA⁃VDR⁃K53Q/R54G/K55E、HA⁃VDR⁃R49W/R50G/K53Q/R54G/K55E)转染HEK 293T 细胞进行表达。在VD 100 nmol/L处理前后,分别获取细胞样品进行核质分离,并采用Western blot 分析,其中Tubulin为胞质内参,Lamin B为胞核内参。结果表明,VD处理能诱导野生型VDR 转位细胞核内(图3A),而VDR突变体VDR(R49W/R50G),VDR(K53Q/R54G/K55E)和VDR(R49W/R50G/K53Q/R54G/K55E)的表达主要停留在胞质中,不能被VD 诱导转位入细胞核(图3B~D)。由此可见,在预测的NLS里这些保守位点的突变抑制了VDR进入细胞核,初步确定它们是VDR入核的关键位点。
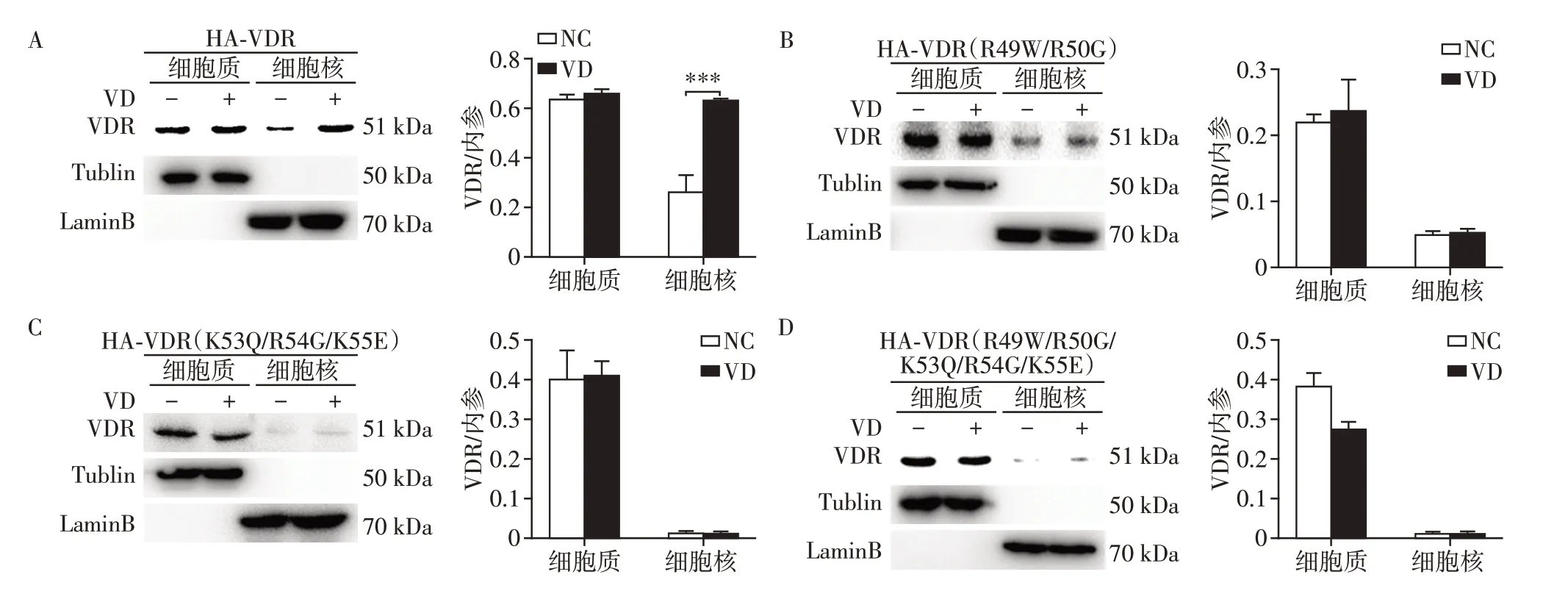
图3 VDR的点突变抑制其核定位Figure 3 VDR point mutations inhibit the transfer of VDR to the nucleus
接着,采用免疫荧光法直接观察VDR点突变对其空间分布的影响。在HeLa细胞中转染VDR及其突变体载体,观察这些蛋白的表达在VD 刺激前后在细胞空间上的分布差异,以DAPI 标记细胞核,红色荧光标记HA⁃tag 指示VDR 及变体的所在位置。如图4 结果所示,在VD 刺激下,野生型HA⁃VDR 发生明显转位进入细胞核,而VDR 突变体在VD 刺激前后,细胞内的空间分布并未发生明显变化,与上述Western blot 结果一致,表明这些点突变位点是VDR核定位的关键位点。
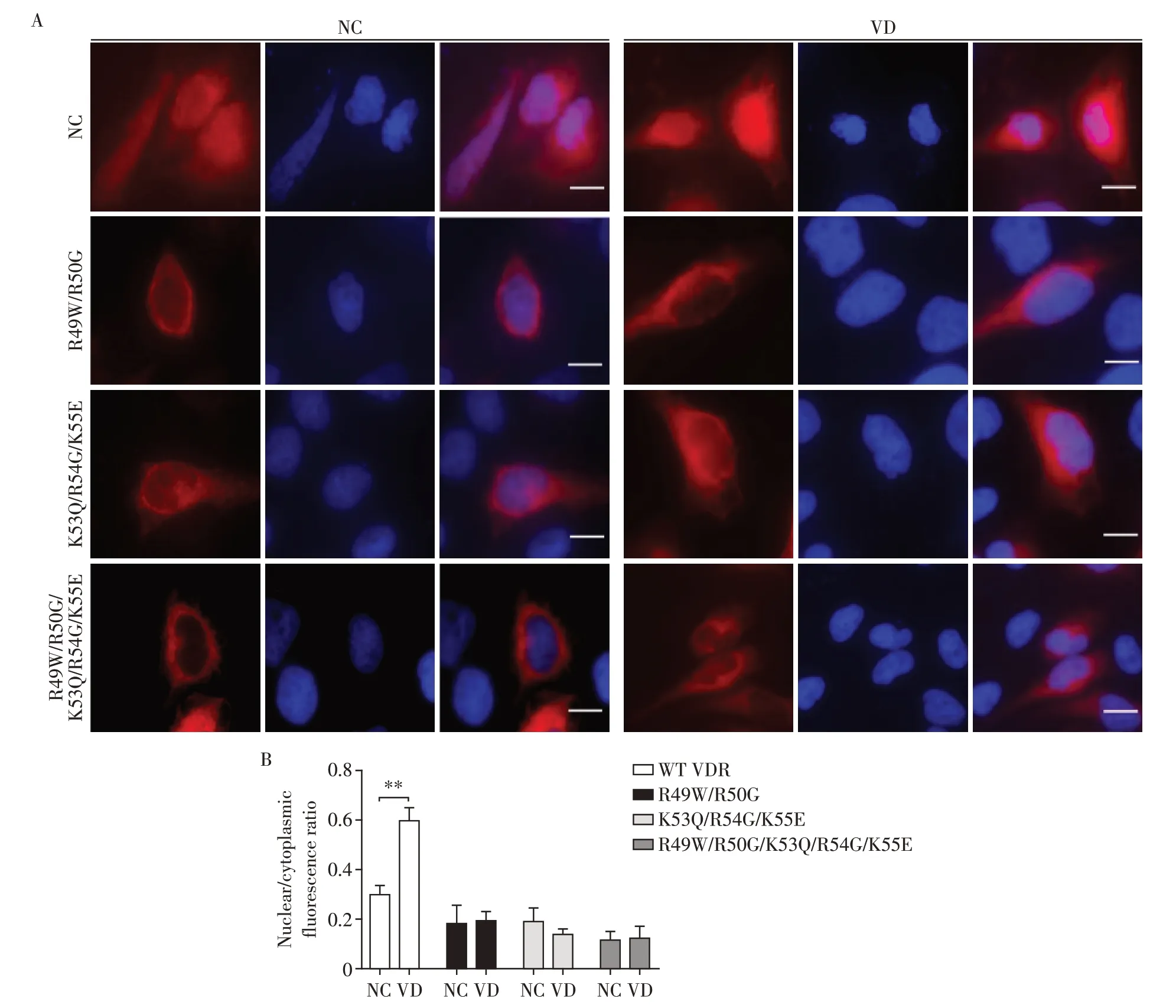
图4 VDR点突变影响VDR在细胞内的分布Figure 4 VDR point mutations affect the spatial distribution of VDR in cells
2.4 VDR点突变减弱了对下游基因表达的调控
VD 的生物学功能主要由VDR 下游基因实现。Cyp24a1、Atp2b1 是VDR 调控的下游基因[13-14],而Cyp27A 不受VDR 调控作为阴性对照。在HEK 293T 细胞里瞬时表达HA⁃VDR 及点突变体,采用100 nmol/L VD 处理,收集细胞样品进行qPCR 检测。如图5所示,在VDR 表达的细胞里,VD 可以有效诱导Cyp24a1 mRNA、Atp2b1 mRNA 水平上调;而在VDR 点突变表达的细胞中,VD 诱导Cyp24a1 mRNA、Atp2b1 mRNA 表达的能力显著降低,说明VDR 的点突变能削弱了VD 的生物学功能,不能有效响应VD信号启动下游基因的转录。

图5 VDR的点突变影响了VDR对下游基因的转录Figure 5 VDR point mutations affect the transcription of downstream genes by VDR
3 讨论
VDR的活性受VD调控,在一些疾病如癌症、神经系统疾病、免疫性疾病的研究中已成为预防、诊断和治疗的重要靶点分子[15-19]。VD 与VDR 结合能激活VDR入核发挥转录因子功能,确定其NLS有助于进一步了解VDR在细胞核和细胞质中的不同功能,为研究相关疾病提供参考依据。
根据在线网站预测分析VDR 的核定位信号位置,提示VDR的NLS为49RRSMKRKALFLT61,并且通过序列比对显示在不同种属VDR 序列里该NLS 具有很好的保守性。根据NLS保守性分析,针对49/50位、53/54/55位、49/50/53/54/55位的保守氨基酸进行突变,通过Western blot 和免疫荧光等方法进行检测,结果显示:当VD 刺激后,野生型VDR 能快速入核;而VDR 的NLS 突变都能有效抑制VDR 入核,证明了这些氨基酸位点参与调控VDR 的入核。据文献报道,VD 与VDR 结合能启动生物反应,启动下游基因如CYP24A1、ATP2B1 等的转录。通过qPCR检测这些下游基因,结果表明突变体VDR明显抑制了CYP24A1、ATP2B1 的mRNA 表达,确定了这5 个位点是VDR 入核并发挥转录调节作用的关键位点。基于这些VDR点突变体不能入核的性质,提示这些点突变体可作为研究胞质VDR功能的新工具,应用于VDR的相关研究[20]。
通常,精氨酸(R)可以被甲基化修饰,赖氨酸(K)可以被泛素化修饰,而这些蛋白质的后加工修饰形式也可以调控蛋白质的核定位行为,例如:Laims 蛋白能发生泛素化调节其核定位[21],PRMT1甲基化酶能使p14ARF蛋白发生甲基化修饰调节该蛋白的核定位[22]。因此,对于VDR点突变体不能入核的现象,推测还存在另一个可能:当精氨酸和赖氨酸位点进行点突变后,可能抑制了VDR的泛素化或甲基化的后加工形式,从而影响VDR的入核行为。是否VDR的这些位点会发生后加工修饰参与VDR核定位的调节呢?这也是一个值得探究的问题。
总之,本研究通过预测分析,点突变体的构建,结合亚细胞定位分析和qPCR 等方法,确定了VDR的核定位信号为49RRSMKRKALFLT61,并且证明了这5 个位点(49/50/53/54/55)的突变能够影VD/VDR信号的生物学活性,这一发现为探索VDR 在细胞质和细胞核中的作用提供研究平台,为探讨VD/VDR 相关疾病的预防、诊断和治疗提供了一定的理论基础。
