上尿路尿路上皮癌组织中脂肪因子表达与临床病理特征及预后的相关性
2022-08-09杜依青宋宇轩
戴 翔,王 飞,杜依青,宋宇轩,徐 涛
(北京大学人民医院泌尿外科, 北京 10044)
根据2019年最新发布的欧美癌症流行病学调查,尿路上皮癌的发病率在世界恶性肿瘤中排名前十,其中膀胱尿路上皮癌占绝大多数[1]。在欧美人群中,上尿路尿路上皮癌(upper tract urothelial carcinoma, UTUC)仅占尿路上皮癌总数的5%~10%,但这一比例在亚洲人群中明显升高,约为9.3%~29.9%,平均为17.9%[2]。
UTUC包括肾盂癌和输尿管癌,前者的发病率约为后者的两倍,同时在约17%的病例中存在并发膀胱癌[3]。亚洲人群与其他地区人群相比,UTUC具有侵袭性强、输尿管肿瘤比例高、预后差的特点,因此在亚洲人群中UTUC可能有与其他地区人群所不同的发病机制[2]。针对UTUC预后危险因素的研究一直是领域内的热点,总体来说,肿瘤分期、分级、淋巴结转移、淋巴血管受侵及组织学变异等病理特征是UTUC预后的主要决定因素,年龄、性别、种族、肥胖等临床因素,手术方式、远端输尿管处理方法等手术因素是否与预后存在相关性仍存在一定争议。近年来,也有越来越多的研究者针对各种血液和组织中分子标志物的表达和检测进行了探究,但目前仍然缺少公认的可用于评估患者预后风险和统筹治疗方案相关的术前预测因素。因此,一项可基于术前检查确定的预测因素对于指导临床治疗具有非常重要的意义。
近年来,脂肪因子与恶性肿瘤间的关联逐渐得到证实。在外周循环中,低血清脂联素(adiponectin,AdipoQ)水平和高瘦素(leptin,LEP)水平与部分类型恶性肿瘤的病灶数量、大小、侵袭性和分期存在相关性[4-7],这种联系在消化系统肿瘤、血液系统肿瘤及激素相关性肿瘤中尤为显著。近期的研究表明,AdipoQ、LEP及其受体在尿路上皮肿瘤组织中的表达水平明显高于正常尿路上皮细胞,且AdipoQ低表达是非肌层浸润性膀胱癌复发的独立危险因子,LEP高表达是肌层浸润性膀胱癌进展的独立危险因子[8]。同时,慢性炎症状态作为肥胖的标志性特征之一,可以为肿瘤细胞的侵袭和迁移提供良好的微环境。白细胞介素(interleukin,IL)-6和IL-10是炎症诱导促癌作用的驱动者和核心参与者,并介导共同的下游信号通路。有研究表明,肥胖可增强IL-6介导的促癌信号通路[9],预示着肥胖、炎症和肿瘤间的密切关联。一项纳入了11 583例患者的荟萃分析表明,血清及肿瘤细胞内IL-6、IL-10高表达水平与多种恶性肿瘤的生存预后显著相关[10-11],并且在91%的患者中表现出高肿瘤分期和高转移的风险[12]。
目前,针对脂肪因子与UTUC的相关性研究极少,也缺乏足够的关于尿路上皮癌细胞中脂肪因子促癌作用的分子水平证据,仅有一项基于亚洲人群的研究表明UTUC组织中LEP受体呈高表达,并且与较差的生存预后相关[13]。本研究拟通过免疫组织化学染色测定上述各脂肪因子在UTUC组织中的表达水平,以探究其与UTUC患者临床病理特征及预后的相关性,同时在基因表达数据库(Gene Expression Omnibus database,GEO)中进一步验证,以期为UTUC的诊疗提供理论依据。
1 资料与方法
1.1 研究对象
本研究中使用的组织石蜡切片取自2014年1月至2021年4月在北京大学人民医院就诊并接受手术治疗的63例UTUC患者,来源于北京大学人民医院病理科。采用免疫组织化学染色方法测定AdipoQ、LEP、IL-6、IL-10及受体AdipoR1、AdipoR2、IL-6R、IL-10RA的定量表达。本研究已获得北京大学人民医院医学伦理委员会批准。同时,选择美国纪念斯隆-凯特琳癌症中心(Memorial Sloan-Kettering Cancer Center)基于GPL20301平台发布的GSE134292队列进行分析,最终纳入其57例UTUC患者。
纳入标准:①UTUC患者;②18岁以上的成人患者;③接受根治性肾输尿管切除术或输尿管节段切除术;④住院资料齐全,包括临床体征、影像学检查(CT或MRI)、实验室检查、手术相关资料及病理报告等;⑤随访资料完整;⑥石蜡组织切片完整。排除标准:①18岁以下未成年患者;②术后诊断为非肿瘤或其他类型肿瘤的患者;③未接受根治性手术治疗,仅接受内镜下治疗或化疗的患者;④住院资料缺失;⑤随访资料不完整;⑥石蜡组织切片中肿瘤组织不完整或免疫组织化学染色不均匀。
两队列中纳入本研究的患者共同特征包括年龄、性别、肿瘤分期、肿瘤分级,另外,根据既往研究、我院患者资料以及GSE134292所提供的数据,将肿瘤直径、肿瘤多灶性纳入免疫组织化学队列分析,将肿瘤位置纳入GSE134292队列分析。
1.2 手术过程
所有肾盂肿瘤患者及部分输尿管肿瘤患者接受根治性肾输尿管切除术,分为腹腔镜手术和开放手术两类,一般采取经腹膜后入路,手术范围包括肾、全段输尿管及输尿管开口周围的部分膀胱。部分输尿管非浸润性肿瘤患者接受输尿管节段切除术,均为开放手术,手术术式包括输尿管节段切除再吻合或输尿管末段切除膀胱再植。当临床考虑UTUC呈侵袭性、术前影像学发现可疑淋巴结转移或术中发现淋巴结肿大时,在根治性肾输尿管切除术的基础上行淋巴结清扫术(lymph node dissection,LND),常规不进行淋巴结清扫。所有患者术前常规进行血尿常规、血生化、凝血功能、胸部X线片和心电图等检查,排除手术禁忌证后方可进行手术。
1.3 观察指标
根治手术后第3个月进行第一次随访,术后两年内每半年随访一次,两年后每年随访一次,随访方式包括住院、门诊和电话随访。根治手术后前两年每半年进行一次膀胱镜复查,两年后每年进行一次膀胱镜复查,同时进行血液和尿液化验及CT或MRI检查。对于怀疑有肿瘤远处转移的患者,可进行骨扫描及正电子发射计算机断层显像(positron emission tomography-computed tomography,PET-CT)等全身检查。主要观察终点包括总生存期(overall survival,OS)、无进展生存期(disease-free survival,DFS)及膀胱无复发生存期(intravesical recurrence-free survival,IVRFS),OS定义为手术之日起到任何原因导致死亡的时间间隔,DFS定义为手术之日起到出现肿瘤复发或远处转移的时间间隔,IVRFS定义为手术之日起到第一次发现膀胱内肿瘤复发的时间间隔。
GSE134292数据集的评估标准:本研究中“转录组测序技术”所得基因表达数据标准化以TPM(transcripts per kilobase per million mapped reads)表示,在比较非肌层浸润性肿瘤组和肌层浸润性肿瘤组间基因表达的差异和生存分析中,以log2(TPM+1)作为基因表达量进行比较。
免疫组织化学结果的评估标准:采用H-Score对结果进行评估,其原理为利用ImageJ图像处理软件(version 2.0.0,Rawak Software,Germany)分割单个肿瘤细胞图像,采用4分制评估单个肿瘤细胞的染色强度,分别为:0分(细胞不着色)、1分(细胞着浅黄色)、2分(细胞着棕黄色)、3分(细胞着棕黑色),并计算各类阳性细胞数量所占百分比。使用公式计算H-Score=(染色强度1分细胞数量百分比×1)+(染色强度2分细胞数量百分比×2)+(染色强度3分细胞数量百分比×3),以H-Score作为基因表达量比较免疫组织化学队列中非肌层浸润性肿瘤组和肌层浸润性肿瘤组间基因表达的差异,取值范围为0~300(图1)。
1.4 统计学方法
2 结果
2.1 患者基本资料
共纳入免疫组织化学队列63例UTUC患者,GSE134292队列57例UTUC患者,患者的基线特征数据见表1。免疫组织化学队列中,患者的平均年龄为(68.25±9.26)岁,男性38例(60.3%),女性25例(39.7%);非肌层浸润性UTUC(即肿瘤分期为pTa-Tis-T1期)患者35例(55.6%),肌层浸润性UTUC(即肿瘤分期为T2~T4期)患者28例(44.4%);低级别和高级别UTUC分别为15例(23.8%)和48例(76.2%)。
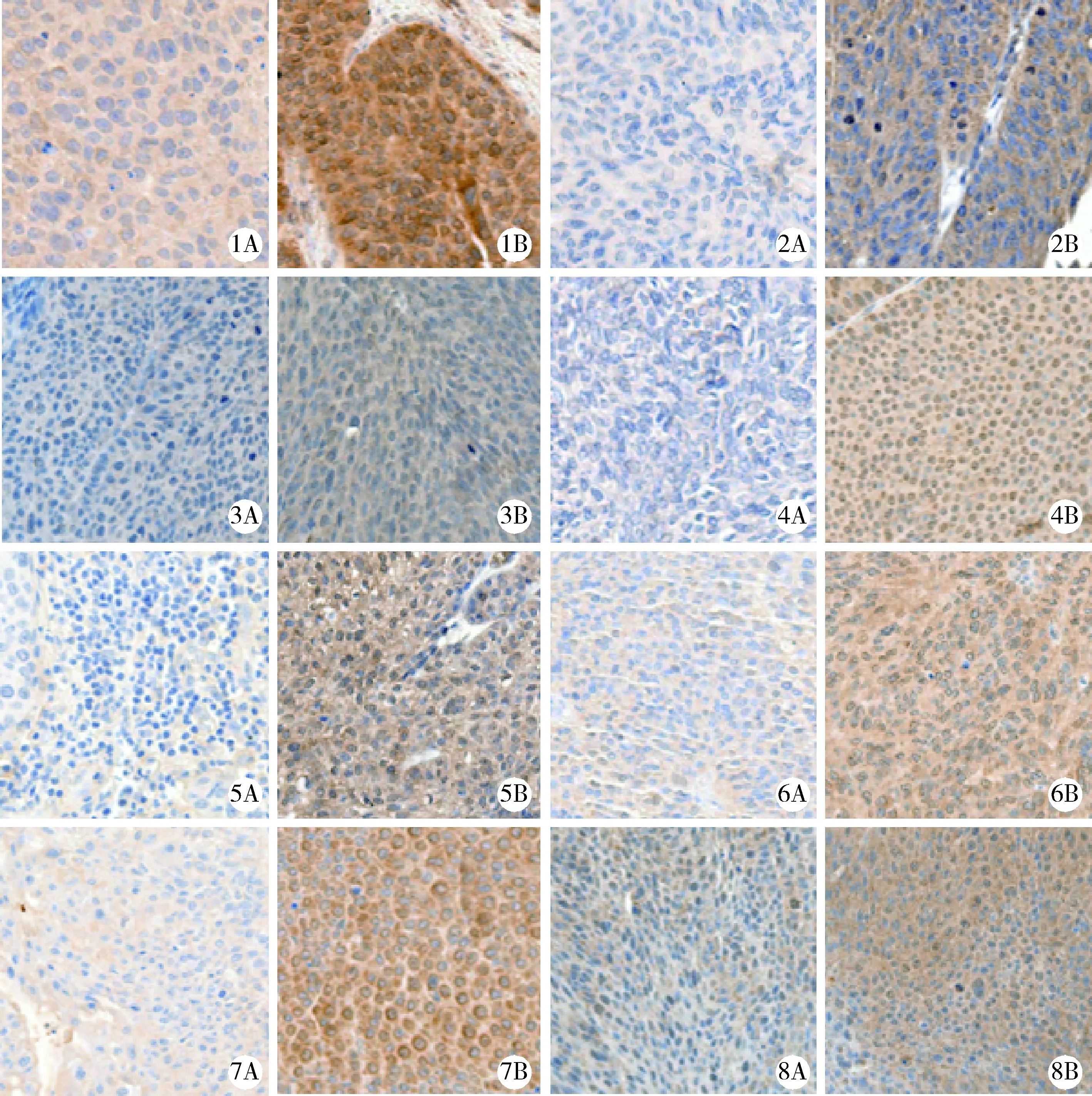
1, AdipoQ; 2, AdipoR1; 3, AdipoR2; 4, LEP; 5, IL-6; 6, IL-6R; 7, IL-10; 8, IL-10RA; A, low-expression; B, high-expression. AdipoQ, adiponectin; LEP, leptin; IL, interleukin; R, receptor.图1 免疫组织化学队列中脂肪因子及其受体染色结果(×400)Figure 1 Immunohistochemical staining result of adipokines and receptors in immunohistochemical cohort (×400)
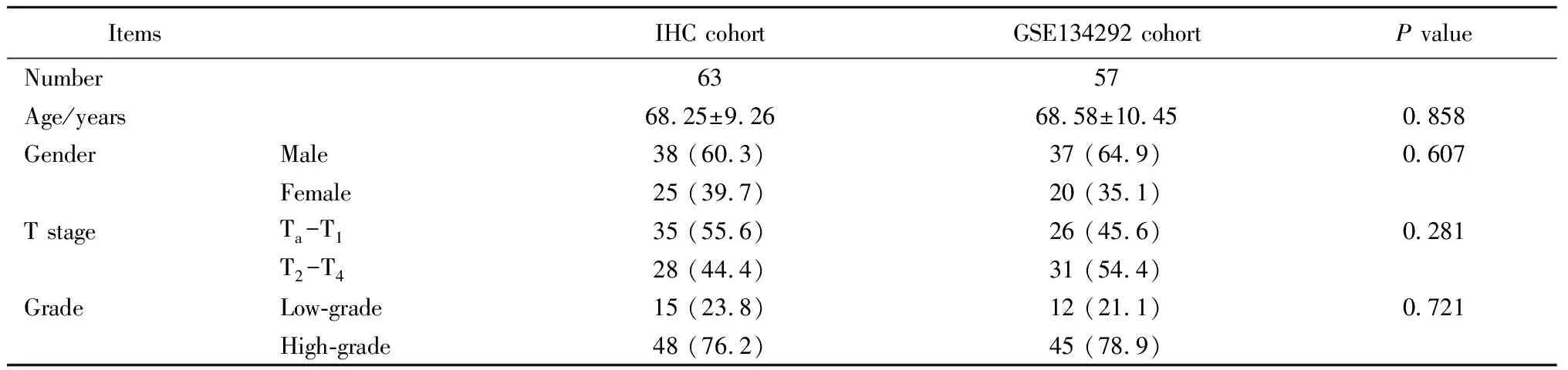
表1 两队列中UTUC患者的基线临床病理特征Table 1 Clinicopathological characteristics of UTUC patients in two cohorts
GSE134292队列中,患者的平均年龄为(68.58±10.45)岁,男性37例(64.9%),女性20例(35.1%);非肌层浸润性UTUC患者26例(45.6%),肌层浸润性UTUC患者31例(54.4%);低级别和高级别UTUC分别为12例(21.1%)和45例(78.9%)。
两组患者基线特征对比差异无统计学意义(P>0.05)。
2.2 不同肿瘤分期亚组中基因表达差异
根据我院患者临床信息及GSE134292队列中患者的相关临床信息,将患者分为T<2组(即非肌层浸润性肿瘤组)和T≥2组(即肌层浸润性肿瘤组),两组间各脂肪因子及受体的表达水平差异见图2~3。结果表明,免疫组织化学队列中,AdipoQ(P=0.003 6)、AdipoR1(P=0.006 5)、LEP(P=0.007 7)、IL-10(P=0.006 9)、IL-10RA(P=0.008 9)在T≥2组(n=28)中的表达水平高于T<2组(n=35);GSE134292队列中,AdipoR1(P=0.000 4)、AdipoR2(P=0.000 4)、IL-6(P=0.005 0)、IL-10(P=0.001 7)、IL-10RA(P=0.008 1)在T≥2组(n=31)中的表达水平高于T<2组(n=26)。
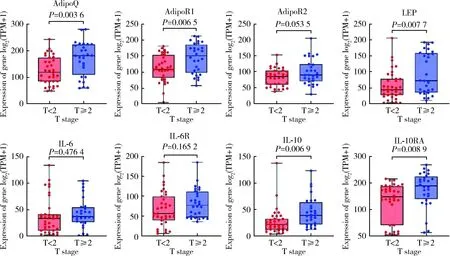
TPM, transcripts per kilobase per million mapped reads; AdipoQ, adiponectin; LEP, leptin; IL, interleukin; R, receptor.图2 免疫组织化学队列中不同分期肿瘤中目的基因表达的差异Figure 2 Gene expression in different tumor stages in immunohistochemical cohort
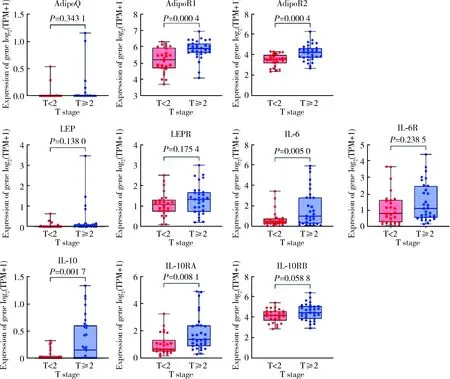
Abbreviations as in Figure 2.图3 GSE134292队列中不同分期肿瘤中目的基因表达的差异Figure 3 Gene expression in different tumor stages in GSE134292 cohort
2.3 生存分析
免疫组织化学队列中各基因表达水平以H-Score表示,GSE134292队列中各基因表达定量以log2(TPM+1)计算,均为连续变量。利用X-tile软件计算各目的基因对应不同预后指标的cut-off值,根据cut-off值将患者分为低表达和高表达组,进行后续生存分析。
单因素及多因素Cox回归分析结果见表2~3。免疫组织化学队列中63例患者的中位随访时间21.4个月(1.6~65.6个月),GSE134292队列中57例患者的中位随访时间30.3个月(0.1~143.7个月)。
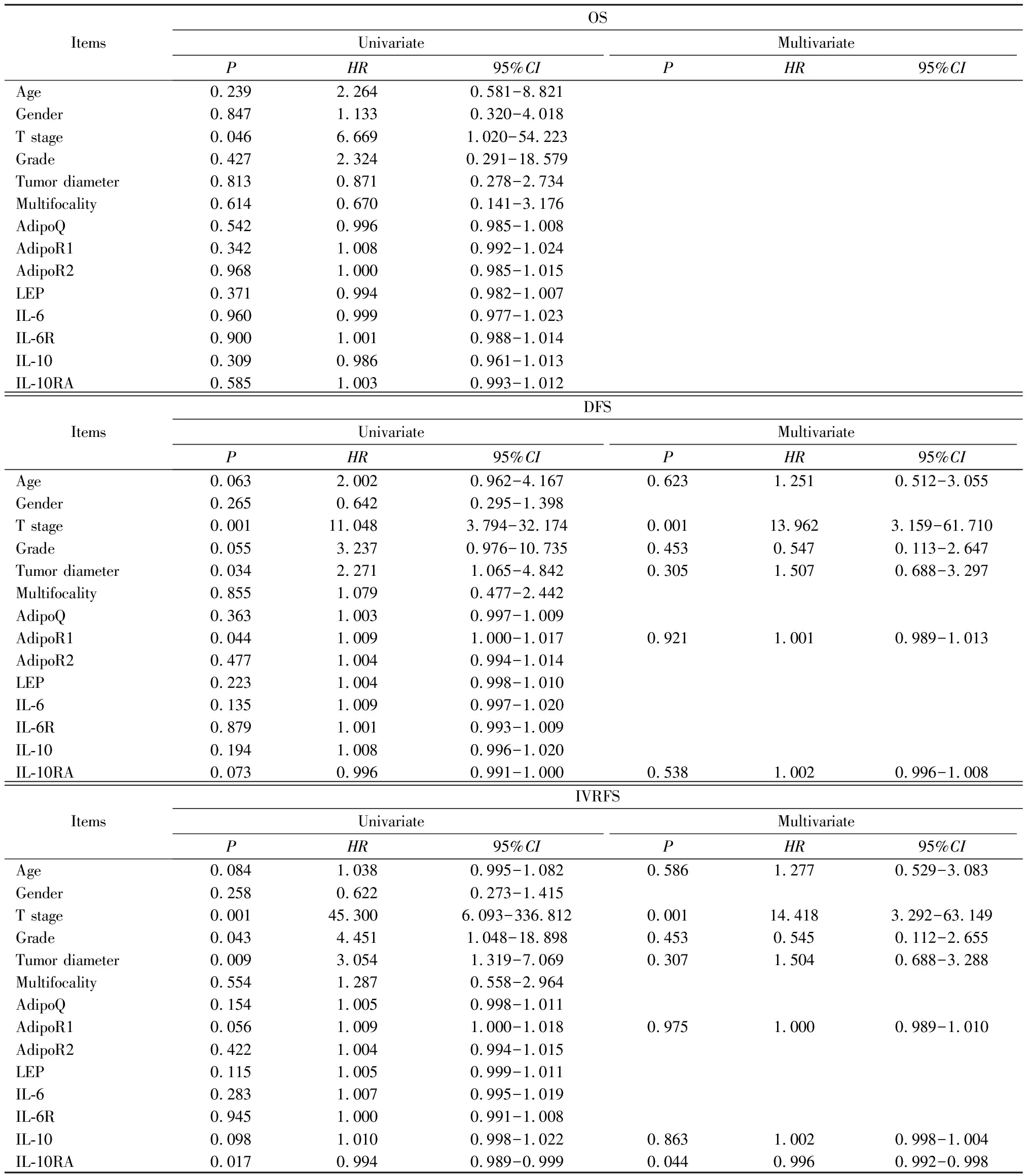
表2 免疫组织化学队列中单因素和多因素Cox分析Table 2 Univariate and multivariate Cox regression analysis in immunohistochemical cohort
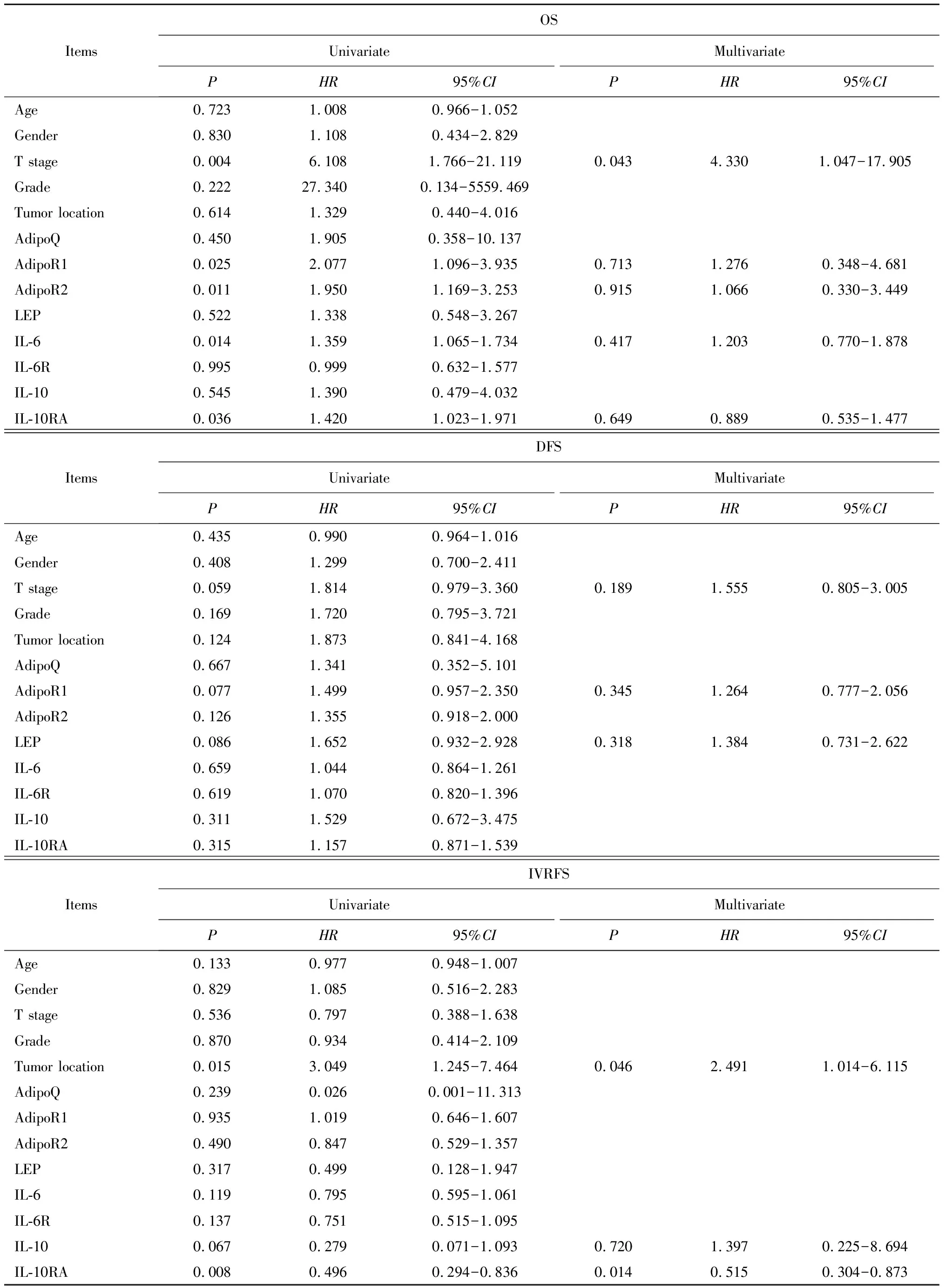
表3 GSE134292队列中单因素和多因素Cox分析Table 3 Univariate and multivariate Cox regression analysis in GSE134292 cohort
OS:随访期间,免疫组织化学队列中共有12例(19.0%)患者死亡,中位生存时间为20.3个月(IQR:12.4~41.0)。单因素Cox回归分析显示,分期(P=0.046,HR=6.669,95%CI:1.020~54.223)是OS的预测因素。GSE134292队列中共有19例(33.3%)患者死亡,中位生存时间为30.7个月(IQR:12.1~50.5)。多因素Cox回归分析显示,分期(P=0.043,HR=4.330,95%CI:1.047~17.905)是OS的独立预测因素。
DFS:随访期间,免疫组织化学队列共有32例(50.8%)患者出现疾病进展,中位生存时间7.4个月(IQR:4.9~12.6)。多因素Cox回归分析显示,分期(P=0.001,HR=13.962,95%CI:3.159~61.710)是DFS的独立预测因素。GSE134292队列中共有43例(75.4%)患者出现疾病进展,中位生存时间7.0个月(IQR:3.8~10.3)。多因素Cox回归分析显示,各基线特征与基因表达水平均不是DFS的独立预测因素。
IVRFS:随访期间,免疫组织化学队列共有29例(46.0%)患者出现膀胱内复发,中位生存时间6.8个月(IQR:4.9~10.6)。Kaplan-Meier生存曲线表明,IL-10RA低表达具有更差的IVRFS(log-rankP<0.05,图4)。多因素Cox回归分析显示,肿瘤分期(P=0.001,HR=14.418,95%CI:3.292~63.149)和IL-10RA(P=0.044,HR=0.996,95%CI:0.992~0.998)是IVRFS的独立预测因素。GSE134292队列中共有30例(52.6%)患者出现膀胱内复发,中位生存时间7.5个月(IQR:4.2~10.3)。Kaplan-Meier生存曲线表明,IL-10RA低表达具有更差的IVRFS(log-rankP<0.05,图4)。多因素Cox回归分析显示,肿瘤位置(P=0.046,HR=2.491,95%CI:1.014~6.115)和IL-10RA(P=0.014,HR=0.515,95%CI:0.304~0.873)是IVRFS的独立预测因素。
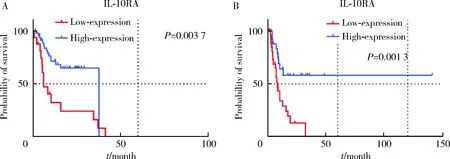
IL, interleukin; R, receptor; IVRFS, intravesical recurrence-free survival.图4 免疫组织化学队列(A)与GSE134292队列(B)中IL-10RA的IVRFS生存曲线Figure 4 Kaplan-Meier survival curve of IL-10RA for IVRFS in immunohistochemical cohort (A) and GSE134292 cohort (B)
3 讨论
既往研究表明,与欧美人群相比,亚洲人群具有高分级肿瘤和输尿管肿瘤比例高的特点,本研究中两组患者的基线特征数据无显著差异,可能与样本量较小有关。免疫组织化学队列中,AdipoR1、IL-10及IL-10RA在高分期肿瘤中的表达水平高于低分期肿瘤,这一发现在GSE134292队列中得到验证,表明AdipoQ和IL-10及其受体可能参与肿瘤进展过程。此外,免疫组织化学结果表明,AdipoQ和LEP在高分期肿瘤组中呈高表达,但在GSE134292队列中未得出类似结果,可能与GSE134292队列中上述脂肪因子转录水平数据部分缺失,仅有13例(22.8%)AdipoQ数据及30例(52.6%)LEP数据相关。在Kaplan-Meier生存曲线及多因素Cox分析中,两队列结果均表明IL-10RA高表达是UTUC患者术后IVRFS的保护性因素,表明IL-10及其受体在UTUC复发过程中发挥重要作用。
GSE134282转录组测序数据及免疫组织化学染色均证明UTUC组织中表达AdipoR1,并在肌层浸润性肿瘤中的表达水平高于非肌层浸润性肿瘤。多项研究结果显示,肿瘤组织中表达AdipoR1,如Kashiwagi等[8]发现,AdipoR1在膀胱癌组织中的表达水平与正常尿路上皮相比显著升高,但与临床病理特征无显著相关性。AdipoQ与AdipoR1结合后主要激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)信号通路,进而抑制磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/蛋白激酶B(protein kinase B, PKB/AKT)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、Janus kinase (JAK)/信号传导及转录激活蛋白(signal transducer and activator of transcription, STAT)等促癌通路。近年来也有证据表明,AdipoQ通过非AMPK通路调节AdipoR1相关的神经酰胺酶活性[14],神经酰胺酶产物S1P可促进细胞增殖和存活、血管生成和细胞迁移。在体外实验中,AdipoQ与T-钙黏蛋白和AdipoR1/R2结合后都表现出促进内皮细胞迁移和增殖的作用[15]。AdipoR1表达的调节机制尚不明确,有研究表明,长链非编码RNA-ANRIL可抑制AdipoR1的表达及后续AMPK的磷酸化水平[16]。AdipoQ/AdipoR1/AdipoR2的表达水平与肿瘤预后的关系目前尚不明确,Chou等[17]发现,约80%肾细胞癌和膀胱癌组织表达AdipoR1,但在癌及癌旁组织对比中,AdipoR1/2及其mRNA表达均无显著差异,与肿瘤预后也未发现显著相关,AdipoQ及其受体的预测价值仍需进一步探究。
目前研究认为IL-10在肿瘤进展中发挥双重性作用,IL-10与IL-10RA/IL-10RB结合后形成受体复合物,激活JAK/酪氨酸激酶2(tyrosine kinase 2, TyK2)并介导STAT1、STAT3和STAT5的磷酸化和激活,进而促使STAT3核易位及后续多种促癌基因和抗凋亡基因表达[10]。在IL-10激活IL-10RA及后续JAK通路的过程中,需要募集磷酸化Src蛋白以启动JAK通路的激活,有研究发现这一过程增强Src介导的表皮生长因子受体(epidermal growth factor receptor,EGFR)的表达,进而促进肿瘤形成[18]。Qian等[19]发现,IL-10在肝细胞癌中的表达高于癌旁组织,是肝细胞癌患者生存的危险因素,且IL-10高表达可抑制PD-L1表达。Hsu等[18]也同样发现IL-10在肺癌肿瘤细胞及血清中高表达,并与较差的生存预后相关。Satyam等[20]的研究发现,包括IL-10在内的Th2细胞因子浓度在膀胱癌患者血清中显著升高,由于尿路上皮癌位置的特殊性,也针对尿液中的IL-10水平进行了探究。Agrawal等[21]通过酶联免疫吸附试验定量检测尿液中IL-10浓度,结果表明IL-10高水平与肿瘤分期、分级及复发风险相关。Cai等[22]研究了65例膀胱癌经尿道膀胱肿瘤切除术患者术前及术后的尿液IL-6/IL-10比值水平,发现尿液IL-6/IL-10比值是膀胱癌复发的独立预测因素。
也有大量证据表明,IL-10直接作用于自然杀伤(natural killer,NK)细胞和细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)介导的抑癌作用,或作为抗炎因子通过抑制抗原呈递细胞中主要组织相容性复合体(major histocompatibility complex, MHC)Ⅱ、共刺激分子及促炎细胞分子的表达实现对炎症反应的抑制[10]。Mannino等[10]认为在恶性肿瘤细胞形成早期,IL-10主要介导NK细胞和CTL细胞发挥细胞杀伤作用,而当癌细胞发育成熟自身表达出IL-10R时,肿瘤微环境中的IL-10则转变为发挥促癌作用。除肿瘤浸润性巨噬细胞和淋巴细胞可释放大量的IL-10外,肿瘤细胞也可通过自分泌方式促进自身增殖。有研究表明,部分肿瘤细胞所表达的IL-10R水平显著高于周围基质,且与不良的生存预后相关[23]。结合上述研究及本研究结果,我们猜测IL-10可通过介导细胞杀伤作用对早期肿瘤细胞增殖进行抑制,对于膀胱内复发是保护性因素。IL-10所发挥的双重性作用可能受微环境中免疫细胞及其他细胞因子的调节,具体机制仍需进一步探究。目前仍缺少证明IL-10R在肿瘤细胞中表达的足够证据,本研究结果显示UTUC组织表达IL-10较少,可表达IL-10RA,需要进一步与癌旁组织表达水平的对比以探究其相关性。值得注意的是,有研究表明AdipoQ/AdipoR1可介导人调节性T细胞(Tregs)分泌IL-10,这可能意味着AdipoQ也参与Th2免疫反应过程[24]。
本研究存在局限性,研究受限于临床资料的回顾性收集、较小的样本量及结局事件数,可能存在Ⅱ类误差;缺乏肿瘤组织与癌旁组织基因表达水平的对比。同时,血清及尿液中AdipoQ和IL-10的浓度测定可为进一步探究脂肪因子的作用机制提供依据,进一步扩大样本量、前瞻性入组患者将作为我们未来工作的主要内容。
