双歧杆菌四联活菌片联合氨基水杨酸治疗溃疡性结肠炎的系统评价及Meta分析
2022-08-09罗烨赵国桢马秋晓李高见刘欣妍朱泠霏李博北京市中医药研究所北京100010首都医科大学附属北京中医医院北京100010北京中医药大学北京100029中国中医科学院西苑医院北京100091
罗烨,赵国桢,马秋晓,李高见,刘欣妍,朱泠霏,李博*(1.北京市中医药研究所,北京 100010;2.首都医科大学附属北京中医医院,北京 100010;.北京中医药大学,北京 100029;.中国中医科学院西苑医院,北京 100091)
溃疡性结肠炎(UC)是一种炎症性肠病(IBD),临床表现包括黏液脓血便、腹痛、里急后重等,分为活动期和缓解期,活动期包括轻、中、重度,重度可危及生命[1]。一般认为UC 病因与遗传易感性、肠道菌群失衡、肠黏膜免疫紊乱等有关[2-3]。我国发病率为0.41/10 万~2.05/10万[4-7],年入院率在过去30年中显著增加[8],这可能与城市化带来的抗菌药物使用增加、早期微生物暴露、污染、饮食西式化等变化有关,肠道微生物多样性降低而UC 易感性增高[9]。
轻中度UC 的治疗以抗炎与免疫调节为主,氨基水杨酸(ASAs)为一线用药,但在部分患者中存在引发胰腺炎、肝毒性等不良反应及依从性差等问题[10]。肠道菌群失调与UC 密切相关[3],益生菌逐渐广泛应用于临床。双歧杆菌四联活菌片(TVB)是由婴儿双歧杆菌、嗜酸乳杆菌、粪肠球菌、蜡样芽孢杆菌组成的新型微生态制剂,已有较多随机对照试验显示了TVB 对UC 的治疗作用[11-24],但至今尚无针对TVB 联合ASAs 治疗UC 的系统评价发表。因此,本研究拟采用Meta分析评价TVB 联合ASAs 治疗轻中度活动期UC的有效性和安全性。
1 资料与方法
1.1 纳入标准
研究类型:随机对照试验(RCT);研究对象:符合轻或中度活动期UC 诊断标准[25];干预措施:对照组单独口服ASAs;试验组在此基础上加用TVB,两组疗程一致。主要结局指标:Mayo 评分。次要结局指标:① 临床总有效率[25];② 炎症因子水平:肿瘤坏死因子-α(TNF-α)、白介素-8(IL-8)、超敏C 反应蛋白(hsCRP);③ 外周T淋巴细胞亚群:CD4+、CD4+/CD8+;④ 脂质过氧化损伤水平:氧化低密度脂蛋白(ox-LDL)、过氧化脂质(LPO);⑤ 不良反应发生率。
1.2 排除标准
① 诊断或纳入、排除标准不明;② 干预措施中使用其他微生态制剂治疗者;③ 数据错误或缺失;④ 重复发表的文献。
1.3 文献检索
计算机检索PubMed、EMbase、Cochrane Library、SinoMed、CNKI、VIP、WanFang、Clinicaltrials 数据库及谷歌学术搜寻,检索时间均为建库至2021年9月22日。中文检索词:双歧杆菌四联活菌片、思连康、溃疡性结肠炎、溃结;英文检索词:tetragenous viable Bifidobacterium tablets、tetralogy of viable tablets、Bifidobacterium Tetrad combined、Bifidobacterium quadruple live bacteria、Idiopathic Proctocolitis、Ulcerative Colitis、Colitis Gravis 等,英文检索策略:((tetralogy Viable Bifidobacterium)OR(tetralogy of viable tablets)OR(Bifidobacterium Tetrad combined)OR(Bifidobacterium quadruple live bacteria)OR(Bifidobacterium,Lactobacillus,Enterococcus and Bacilus)OR(viable bifidobacterium quadruple))and((Idiopathic Proctocolitis)or(Ulcerative Colitis)or(Colitis Gravis)or(Inflammatory Bowel Disease,Ulcerative Colitis Type)or(Colitis,Ulcerative))。
1.4 文献筛选与资料提取
由两名研究员按纳排标准独立使用EndNote 20筛选文献、提取资料,交叉核对。如有分歧,由第三位研究者裁决。提取内容:第一作者、发表时间、试验样本量、平均年龄、性别、干预措施、疗程、结局指标、不良反应、其他偏倚情况。对于文献中未提及的内容,尝试以邮件询问第一作者。
1.5 文献质量评价
由两名研究员采用Cochrane Handbook 5.1.0中的偏倚风险评价工具独立评估质量,如有分歧,咨询第三方。评估包含内容:随机序列生成和分配隐藏的方法、对研究者、受试者和结局评估者盲法的实施、结局数据的完整性、有无选择性报告结果、有无其他偏倚。
1.6 统计分析
采用RevMan 5.3 软件进行Meta 分析。计数资料以相对危险度(risk ratio,RR)表示,计量资料采用均数差(MD)或标准化均数差(SMD)表示,置信区间值为95%。I2检验评价异质性,I2≤50%或P>0.1,表明同质性较好,采用固定效应模型;反之采用随机效应模型。采用“逐篇剔除文献”的方式进行敏感性分析,必要时行亚组分析,寻找异质性来源。对含10 项以上研究的结局指标行发表偏倚分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 文献检索流程
初检索获得文献446 篇,中文文献391 篇,英文文献55 篇,经逐层筛选,纳入14 篇文献[11-24],均为期刊论文。文献筛选过程见图1。
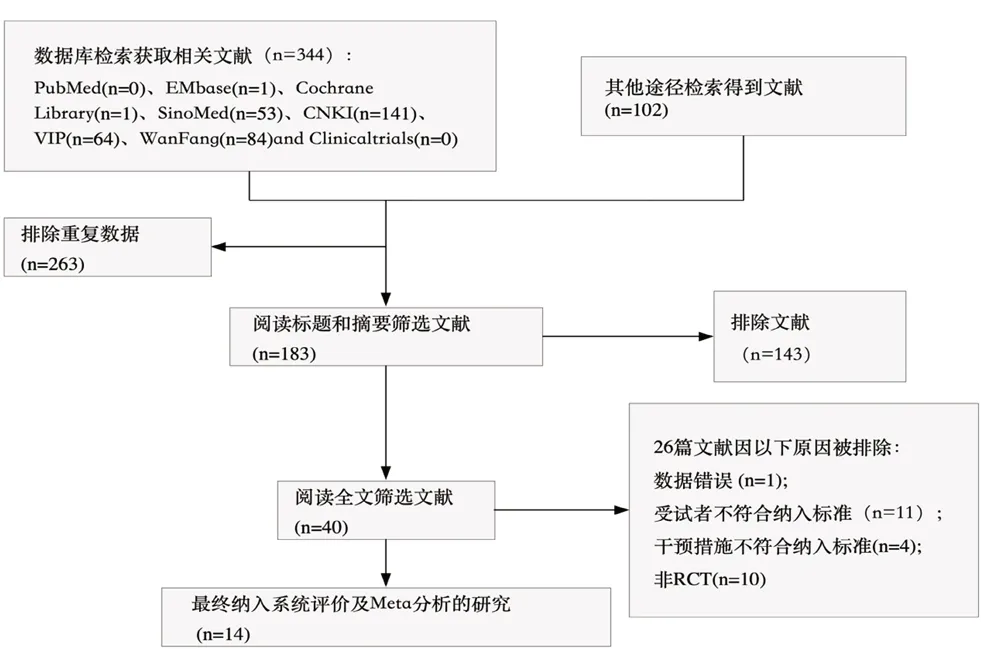
图1 文献筛选流程图Fig 1 Screening of literature
2.2 纳入文献基本特征及偏倚风险评价
14 篇文献发表于2011年至2021年,总病例1123 例,试验组564 例,对照组559 例,两组基线具可比性,见表1。偏倚风险评价结果见图2。研究均提及随机,3 项[11-13]未提及随机方法,评价为不清楚;其余使用随机数字法,为低风险。均未提及分配隐藏。均未对TVB 进行模拟,无法施盲,实施偏倚为高风险。3 项[13,20-21]结局指标为客观指标,测量偏倚为低风险,其余均涉及含主观因素评价,为不清楚。1 项[14]提及病例脱落,试验组4 例,对照组2 例,未报告脱落原因,失访偏倚为不清楚,其余未报道,为低风险。研究方法所列结局与结果报告一致,报告偏倚为低风险。5 项[15,18,20,23-24]受省部级及以上课题资金资助,其他偏倚为低风险,其余为不清楚。
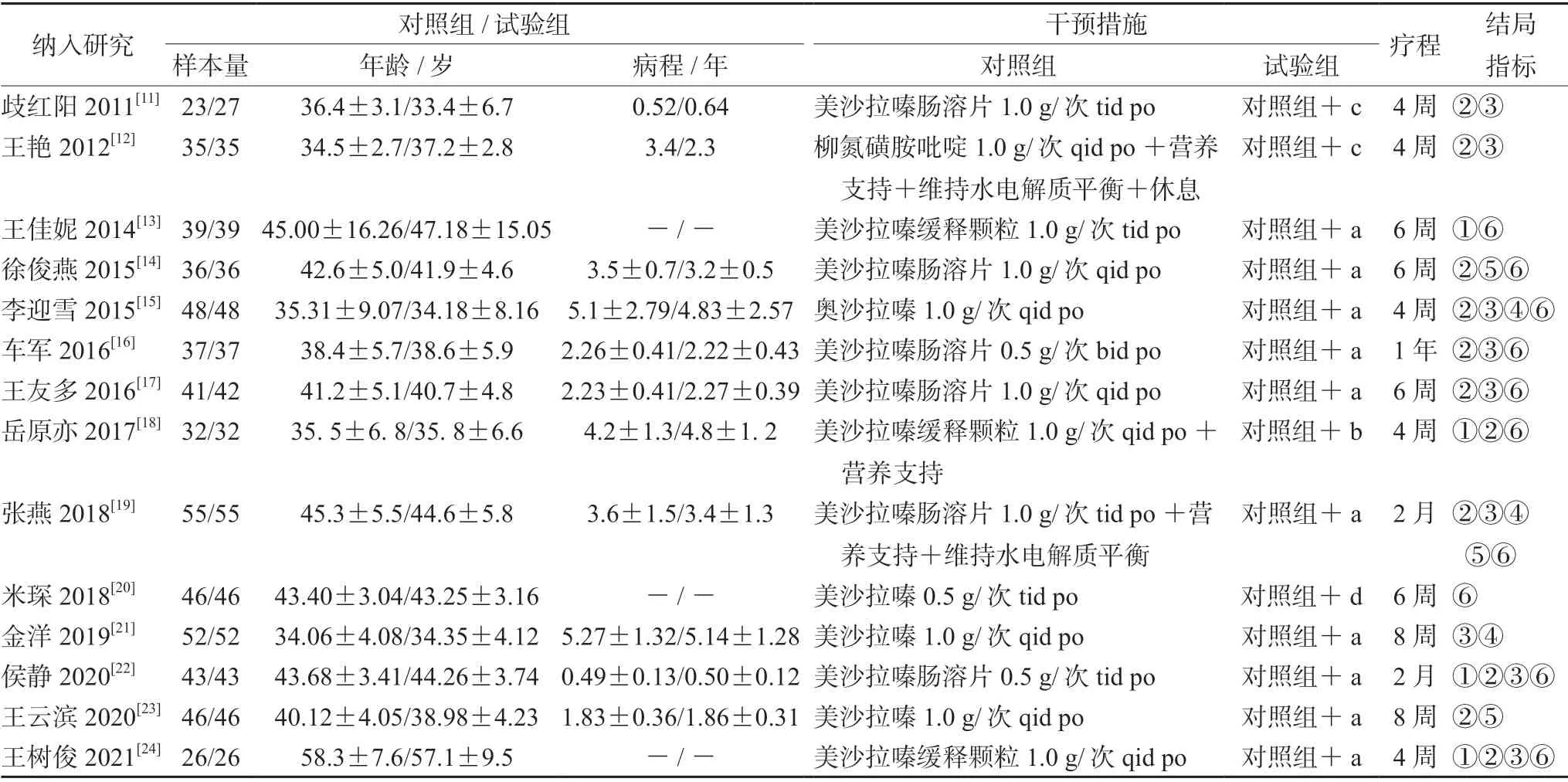
表1 纳入文献的基本特征Tab 1 Basic characteristics of the included literatures
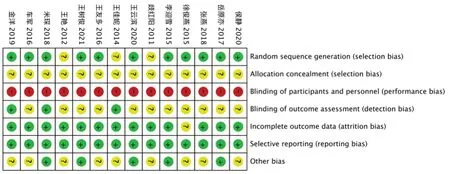
图2 纳入文献的偏倚风险评估Fig 2 Risk-of-bias of included literatures
2.3 Meta 分析结果
2.3.1 Mayo 评分 纳入4 项研究[13,18,22,24],异质性I2=95%,P<0.000 01,采用随机效应模型,Mayo 评分试验组显著低于对照组[RR=-1.47,95%CI=(-2.60,-0.34),P=0.01],见图3。行敏感性分析,排除文献[13,24]后I2=0%,P=0.62,患者年龄为主要差异,可能为异质性来源,分为年龄<45 岁亚组与年龄≥45 岁组,前者RR值明显降低。
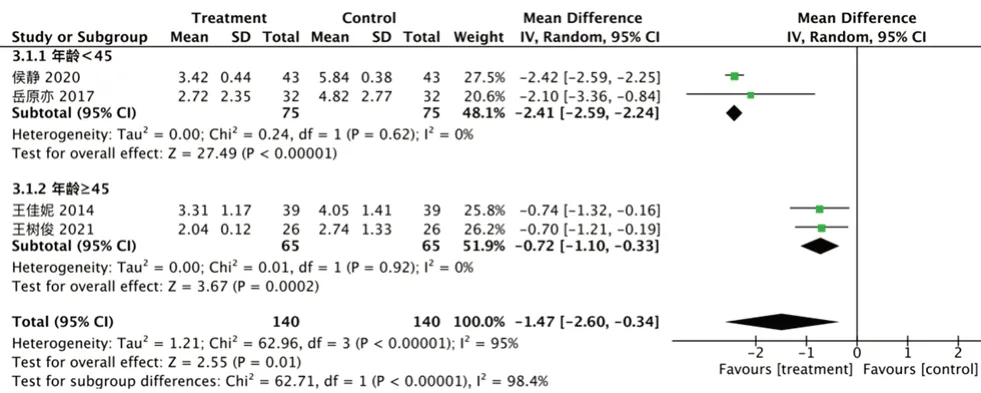
图3 Mayo 评分的森林图Fig 3 Forest plot of Mayo scores
2.3.2 临床总有效率 11 项研究[11-12,14-19,22-24]报告了临床总有效率,无明显异质性(I2=29%,P=0.17),采用固定效应模型。试验组临床总有效率优于对照组[RR=1.21,95%CI=(1.14,1.27),P<0.000 01],见图4。
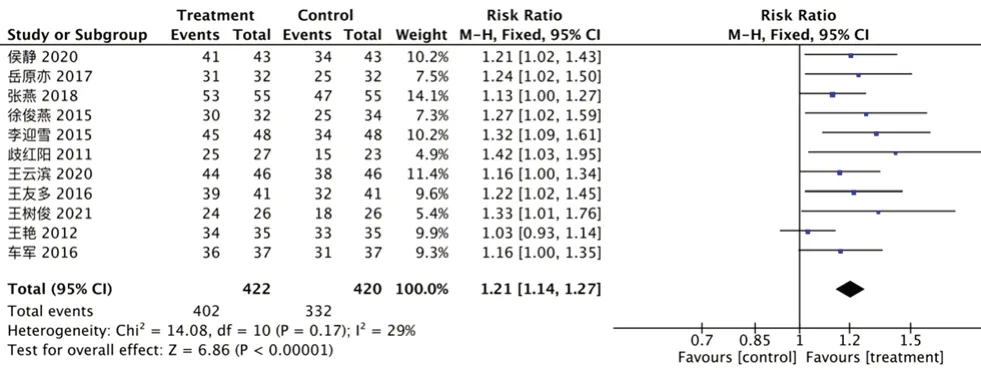
图4 临床总有效率的森林图Fig 4 Forest plot of total clinical effective rate
2.3.3 炎症因子水平
①hs-CRP:纳入3 项研究[16-17,19],无明显异质性I2=0%,P=0.38,采用固定效应模型。试验组hs-CRP 降低[RR=-1.69,95%CI=(-1.97, -1.41),P<0.000 01],见图5。
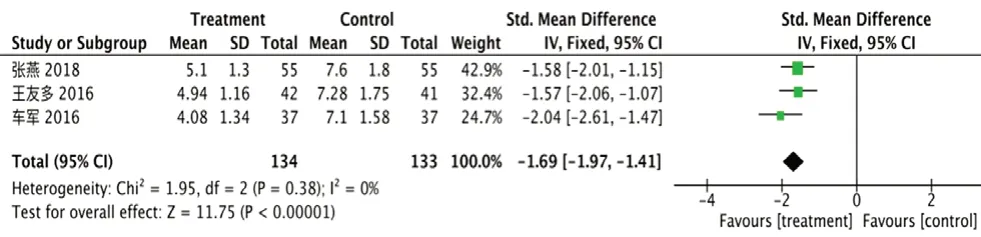
图5 hs-CRP 的森林图Fig 5 Forest plot of hs-CRP
②IL-8:纳入8 项研究[11-12,15-17,19,21-22],异质性I2=84%,P<0.000 01,采用随机效应模型。与对照组相比,试验组IL-8 下降[RR=-1.44,95%CI=(-1.88,-1.01),P<0.000 01],见图6。行敏感性分析,排除文献[11-12]后I2=0%,P=0.59,给药剂量存在明显差异,文献[11-12]为TVB 1.0 g/次 tid,其余为TVB 1.5 g/次 tid。按给药剂量分为两个亚组,TVB 1.5 g/次 tid 亚组同质性较好(I2=0%,P=0.59),差异具有统计学意义[RR=-1.75,95%CI=(-1.95, -1.55),P<0.000 01]。TVB 1.0 g/次tid 亚组示I2=75%,P=0.04,异质性较大,考虑存在其他因素。文献[12]病程明显较文献[11]长,病程也可能为异质性来源。

图6 IL-8 的森林图Fig 6 Forest plot of IL-8
③TNF-α:纳入6 项研究[12,15-16,19,21,24],异质性I2=90%,P<0.00001,逐一排查文献异质性无明显改变,采用随机效应模型,试验组TNF-α降低[RR=-2.27,95%CI=(-3.09,-1.18),P<0.000 01],见图7。
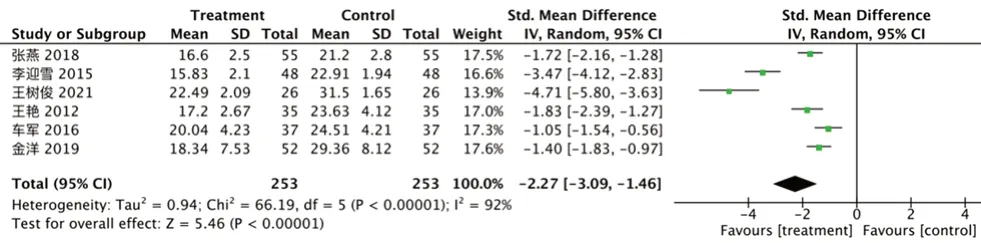
图7 TNF-α 的森林图Fig 7 Forest plot of TNF-α
2.3.4 外周T 淋巴细胞亚群水平
①CD4+:纳入3 项研究[15,19,21],异质性I2=59%,P=0.09,剔除金洋[21]后I2=0%,P=0.78,对比发现文献[21]病程较长,异质性来源可能与病程有关。采用随机效应模型,试验组CD4+升高[RR=3.34,95%CI=(2.15,4.54),P<0.000 01],见图8。
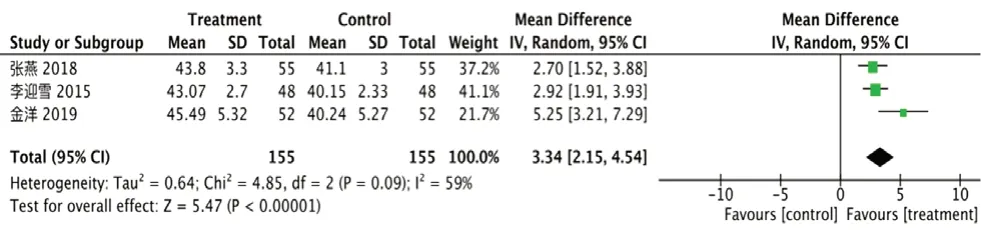
图8 CD4+的森林图Fig 8 Forest plot of CD4+
②CD4+/CD8+:纳入3 项研究[15,19,21],异质性I2=80%,P=0.007,剔除文献[21]后I2=0%,P=0.39,结合CD4+结果,考虑病程可能为异质性来源。采用随机效应模型,试验组CD4+/CD8+升高[RR=0.25,95%CI=(0.14,0.35),P<0.000 01],见图9。
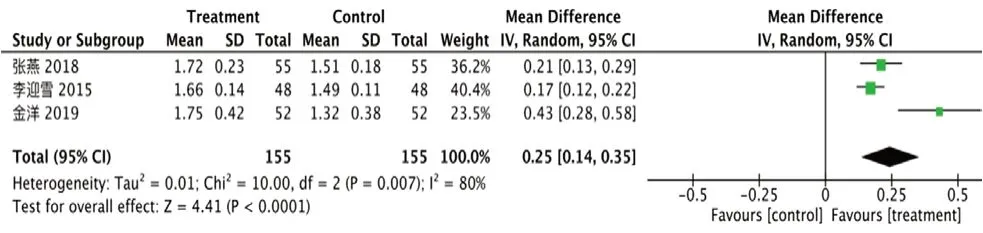
图9 CD4+/CD8+的森林图Fig 9 Forest plot of CD4+/CD8+
2.3.5 脂质过氧化损伤水平
①ox-LDL:纳入3 项研究[14,19,23],异质性I2=0%,P=0.59,试验组ox-LDL明显降低[RR=-14.49,95%CI=(-17.21, -11.77),P<0.000 01],见图10。
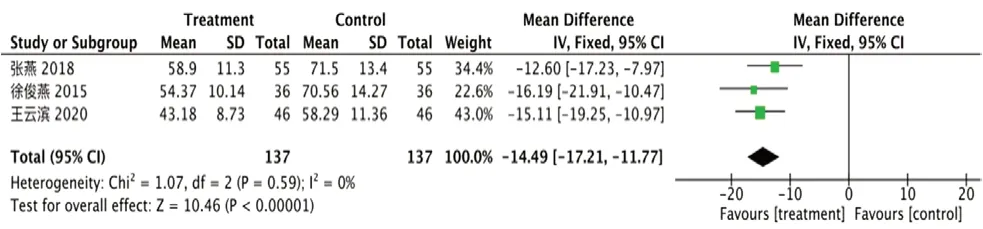
图10 ox-LDL 的森林图Fig 10 Forest plot of oxLDL
②LPO:纳入3 项研究[14,19,23],异质性I2=0%,P=0.71,试验组LPO 明显降低[RR=-6.67,95%CI=(-7.59,-5.75),P<0.00001],见图11。

图11 LPO 的森林图Fig 11 Forest plot of LPO
2.3.6 不良反应发生率 10 项研究[13-20,22,24]报告了不良反应,3 项[13,15,20]无明显不良反应,7项[14,16-19,22,24]报告了具体发生率(I2=11%,P=0.35)。试验组不良反应发生率趋向更低,但无统计学差异[RR=0.58,95%CI=(0.33,1.04),P=0.07],见图12。
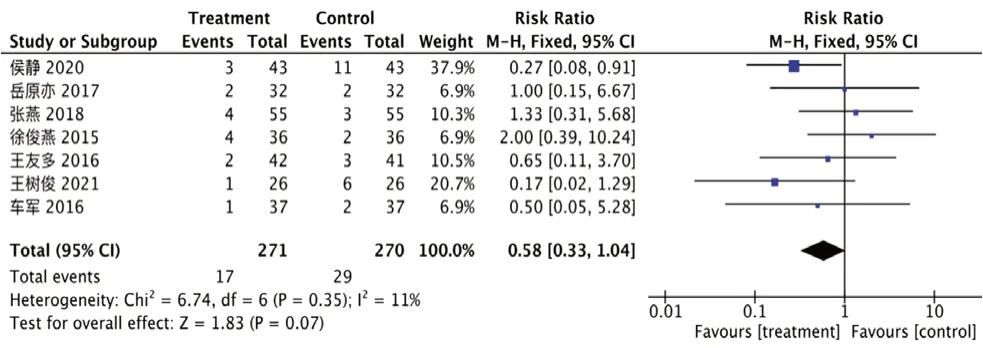
图12 不良反应发生率的森林图Fig 12 Forest plot of incidence of adverse effect
2.3.7 发表偏倚 临床总有效率漏斗图左右不完全对称,Egger’s 回归分析提示t=3.91,P=0.011 <0.05,具有潜在发表偏倚。进一步行剪补法,固定效应模型计算合并效应量OR点和可信区间在剪补前后分别为-5.154(-5.185,-5.123),-5.411(-5.439,-5.382),结论稳健。见图13。
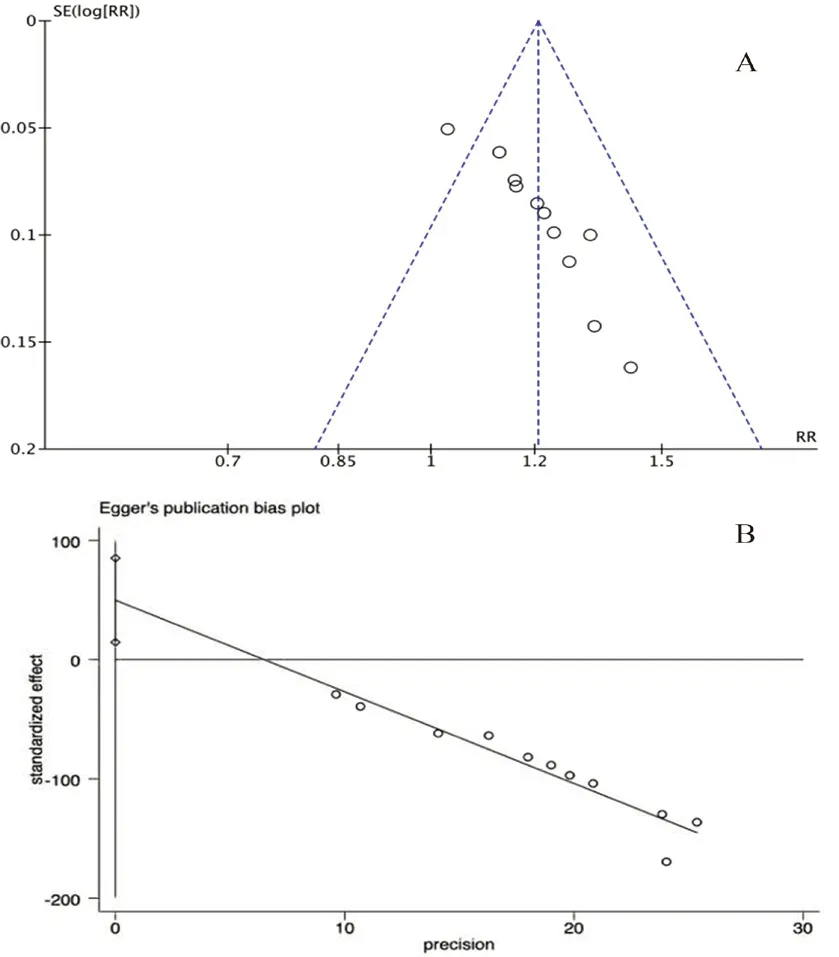
图13 临床总有效率的漏斗图(A)和Egger’s 回归图(B)Fig 13 Funnel diagram(A)and Egger’s regression(B)of total clinical effective rate
3 讨论
3.1 本研究的主要发现
结果显示,TVB 联合ASAs 治疗UC 的有效性可能优于单独使用ASAs,能有效改善患者Mayo 评分及临床总有效率,降低炎性因子水平,平衡外周T 淋巴细胞亚群,减轻脂质过氧化,从而改善临床表现,提高生活质量,且不良反应发生率有降低趋势,具有良好的安全性。给药剂量为1.5 g/次 tid po 可能疗效更佳,对于年龄年龄<45 岁及病程较长的患者改善力度更大。
这一结果与既往研究大致相符。益生菌联合ASAs 可提高临床有效率,减少复发率,降低炎症因子水平[26-29]。益生菌单独用药也有一定疗效。一项Meta 分析发现益生菌和ASAs 的维持效果无明显差异[30],两项Meta 分析对比了益生菌和安慰剂,显示益生菌对UC 具有缓解效果[31-32],另一项纳入22 项RCTs 的Meta 分析认为一般益生菌可能无法明显诱导UC 缓解,但仍指出,复合益生菌制剂VSL#8 可能缓解症状[33]。与新型制剂TVB 相比,由长双歧杆菌、保加利亚乳酸杆菌、嗜热链球菌组成的双歧杆菌三联活菌片是目前更通用的益生菌制剂,研究显示,TVB 可更好地恢复UC 肠道生物屏障[34]。
Mayo 评分为国际公认的UC 疾病活动度量化指标,故本研究选取Mayo 评分为主要观察指标,结果发现与单独使用ASAs 相比,TVB 联合ASAs 可有效降低Mayo 评分,且年龄<45 岁的患者可能降低更明显。hs-CRP、IL-8、TNF-α等炎症因子水平与病灶炎性反应程度成正相关,结果显示,TVB 联合ASAs 治疗UC 具有更好的抗炎作用,IL-8 指标提示给药剂量以TVB 1.5 g/次tid po可能疗效更佳。此外,TVB 联合ASAs 在调节T淋巴细胞亚群方面具有良好作用。UC 中浸润肠黏膜的吞噬细胞催化形成过量活性氧簇(ROS)[35],氧化不饱和脂肪酸而产生ox-LDL、LPO 等过氧化物[36],破坏肠黏膜。结果示TVB 联合ASAs 可降低脂质过氧化水平,减轻损伤。本研究也关注了患者生活质量改善情况,临床总有效率是评价患者便次、血便、腹痛、里急后重及肠镜表现的有效指标,结果示联用TVB 与ASAs 有助于缓解UC 临床症状及肠镜表现,提高生活质量。
TVB 治疗UC 的机制可能与直接调节肠道菌群、调控免疫应答、抑制炎症与脂质过氧化有关。肠道菌群参与免疫系统的构建和调节、阻止病原入侵,维持肠道内稳态[37-38]。UC 患者通常存在菌群失调,多样性及稳定性降低,可能是免疫紊乱的启动因素之一。致病菌及代谢物过度激活免疫应答,产生IL-6、IL-8、TNF-α等促炎因子,广泛调控炎症细胞,破坏黏膜屏障[39-40]。部分致病菌如大肠埃希菌、链球菌间接激活NF-κB 通路,引发持久的局部炎症[41]。异常升高的炎症介质同时可导致T 淋巴细胞应答紊乱,CD4+/CD8+亚群失调,从而导致异常免疫反应[42];也可触发ROS过量生成[43],影响细胞膜通透性。TVB 可纠正肠道菌群失调,增加益生菌产生乙酸、乳酸等,改善屏障稳定性[10],降低通透性[44],并拮抗致病菌;蜡样芽孢杆菌抑制需氧菌生长,减轻其对黏膜上皮的侵袭,下调促炎因子,并调节T 细胞应答及脂质过氧化,从而缓解炎症、减轻损伤。
3.2 研究的局限性
本研究首次对TVB 联合ASAs 治疗UC 进行系统评价,患者总量较大,且针对不同年龄、不同给药剂量进行亚组分析,严谨分析异质性,使结果更可靠。与既往系统评价相比,结局指标纳入T 淋巴细胞亚群及脂质过氧化相关数据,为益生菌对其影响提供参考。同时存在以下不足:
① 本研究虽进行了对灰色和英文文献的检索,但筛查后无符合纳排条件的文献,可能导致潜在的发表偏倚。② 本研究纳入的对照组干预措施给药剂型及剂量存在差异,可能对结果产生影响。③ 在结局指标的选择上,仅4 篇文献[13,18,22,24]选择国际公认的结局Mayo 评分,其余文献多采用临床总有效率为结局指标,虽指出总有效率评判以共识[25]为标准,但仍存在主观影响,可能产生测量偏倚。临床总有效率也显示出潜在发表偏倚,这可能与该指标的主观影响有关。
3.3 结论
临床治疗UC 可选择ASAs 联用TVB,TVB使用剂量为1.5 g/次tid po 可能取得更好的疗效,针对年龄<45 岁或病程时间较长的患者改善效果可能更明显。建议今后开展大样本RCT,注意分配方案的隐藏,对试验者及受试者设盲,采用国际公认结局指标验证上述结论。
