子宫内膜样腺癌中PLAGL1和ERβ的表达及临床意义
2022-08-08沈玉婷罗文武赵荣荣吴正升
沈玉婷,罗文武,赵荣荣,吴正升,2
子宫内膜癌(uterine corpus endometrial carcinoma, UCEC)是女性生殖系统常见的恶性肿瘤[1],而子宫内膜样腺癌(uterine endometrioid adenocarcinoma, UTEA)是其最常见的病理类型[2]。目前,早期UCEC首选手术治疗[3],而对于有生育要求、手术禁忌或失去手术机会的患者,寻找理想的分子标志物具有重要意义。多形性腺瘤基因L1(pleomorphic adenoma gene like-1, PLAGL1)可通过多种途径阻滞细胞周期、介导细胞凋亡,与细胞的多种生理功能及病理状态密切相关[4-5]。ESR2编码雌激素受体β蛋白(estrogen receptor β, ERβ),在UCEC中通过拮抗雌激素发挥肿瘤抑制作用[6]。目前,尚未有PLAGL1与UTEA的文献报道。因此,本文着重探讨PLAGL1和ERβ在UTEA中的表达、相关性及两者与临床病理特征的关系,旨在为UTEA的早期诊断、个性化治疗及预后评估提供参考。
1 材料与方法
1.1 材料收集2017年10月~2021年3月安徽医科大学第一附属医院高新院区病理科存档的84例UTEA石蜡包埋组织,其中43例病变局限,取远离病灶>2 cm子宫内膜组织作为对照[7]。患者年龄29~73岁,中位年龄53岁,临床资料均完整,术前均未接受化疗、放疗或生物治疗等干预措施,无恶性肿瘤个人史及家族史。全子宫切除术后内膜病变切片均由两位病理专家共同阅片,根据WHO(2014)子宫肿瘤组织学分类[8]及2009年FIGO标准[9]进行病理诊断、肿瘤分级及临床分期。
1.2 方法
1.2.1肿瘤基因组图谱(the Cancer Genome Atlas, TCGA)数据库 使用TCGA(https://cancergenome.nih.gov/)数据库挖掘肿瘤基因信息,与正常组织比较,基因表达谱分析筛选UCEC中差异表达基因:在Projects项目中检索TCGA-UCEC,获得546例RNA原始测序数据完整样本;在Exploration项目中检索TCGA-UCEC,获得包含PTEN、PIK3CA、ARID1A、FAT4、PLAGL1、ATRX、CHD4等575个基因;获取数据后进行表达差异基因分析,筛选得到目标基因PLAGL1。进一步获取与PLAGL1基因共表达的基因数据,获得包含HYMAI、ATP8A2、ESR2、RAP2C、PKN2、PLAG1、SAT2等20 120个基因,依据Spearman等级相关分析结果得到目标基因ESR2。
1.2.2UALCAN数据库 使用UALCAN(http: //ualcan.path.uab.edu/index.html)数据库进一步分析TCGA中PLAGL1和ESR2的RNA原始测序数据,分析PLAGL1和ESR2 mRNA在正常子宫内膜及UCEC中的表达,使用表达量的中位数进行后续统计学分析。
1.2.3免疫组化 采用免疫组化MaxVision法染色,将手术切除的UTEA及癌旁正常子宫内膜石蜡包埋组织连续4 μm厚切片,脱蜡至水,经柠檬酸法高温修复、3%H2O2封闭和PBS缓冲液冲洗后分别加入PLAGL1小鼠单克隆抗体(ab181457,1 ∶100)及ESR2兔抗人多克隆抗体(14007-1-AP,1 ∶50)。4 ℃过夜,PBS冲洗后加入即用型免疫显色试剂(MaxVision-HRP鼠/兔),孵育后PBS冲洗,DAB显色,苏木精复染,梯度乙醇脱水,二甲苯透明,中性树脂封固,镜下观察。病理科存档的UTEA组p53染色切片,均由Roche公司全自动免疫组化仪(型号Benchmark U1t)检测。选用福州迈新公司的即用型一抗p53(Kit-0010),二抗及显色系统、复染液均为全自动免疫组化仪自带封闭套装。
1.3 结果判读PLAGL1蛋白表达主要定位于细胞核,ERβ蛋白表达定位于细胞质,呈淡黄色至棕黄色为阳性。由两位病理医师采用双盲法阅片。每张切片随机选取5个高倍镜视野(400×),根据半定量评分系统进行评分。(1)按阳性细胞染色强度计分:无着色为0分,淡黄色为1分,黄色为2分,棕黄色为3分;(2)按阳性细胞百分比计分:PLAGL1组<10%为0分,10%~30%为1分,31%~60%为2分,>60%为3分[10];ERβ组<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分[7]。将两项得分结果相加:≤3分为低表达,>3分为高表达[7,10]。p53判读标准:肿瘤细胞核着色即为阳性,p53阳性率>60%或<5%为p53错义突变(计为p53+),5%~60%为p53野生型(无p53突变,计为p53-)[2]。
1.4 统计学分析应用SPSS 22.0软件进行统计学分析,组间比较采用χ2检验,相关性分析使用Spearman等级相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 正常子宫内膜及UCEC组织中PLAGL1和ESR2 mRNA的表达UALCAN数据库显示:35例正常子宫内膜组织和546例UCEC中PLAGL1 mRNA相对表达量的中位数分别为11.97和3.95,UCEC中PLAGL1 mRNA表达显著低于正常子宫内膜组织(P<0.01,图1A);而正常子宫内膜组织和UCEC中ESR2 mRNA相对表达量的中位数分别为0.28和0.39,两者差异无统计学意义(P>0.05,图1B)。
2.2 UTEA及正常组织中PLAGL1和ERβ的表达采用免疫组化MaxVision法检测84例UTEA及43例正常组织中PLAGL1和ERβ的表达,结果显示:PLAGL1表达主要定位于细胞核,细胞质中少量表达;在正常子宫内膜腺体和间质细胞中广泛表达,且腺体中表达较高;PLAGL1在UTEA细胞中高表达率为34.5%,在正常组织中高表达率为74.4%,两者相比差异有显著性(P<0.01,表1,图2A、B)。ERβ表达定位于细胞质,在正常子宫内膜腺体和间质细胞、UTEA细胞中均有表达。ERβ在UTEA细胞中的高表达率为39.3%,在正常组织中的高表达率为34.9%,两组相比差异无显著性(P>0.05,表1,图2C、D)。血管内皮细胞中PLAGL1和ERβ均不表达。
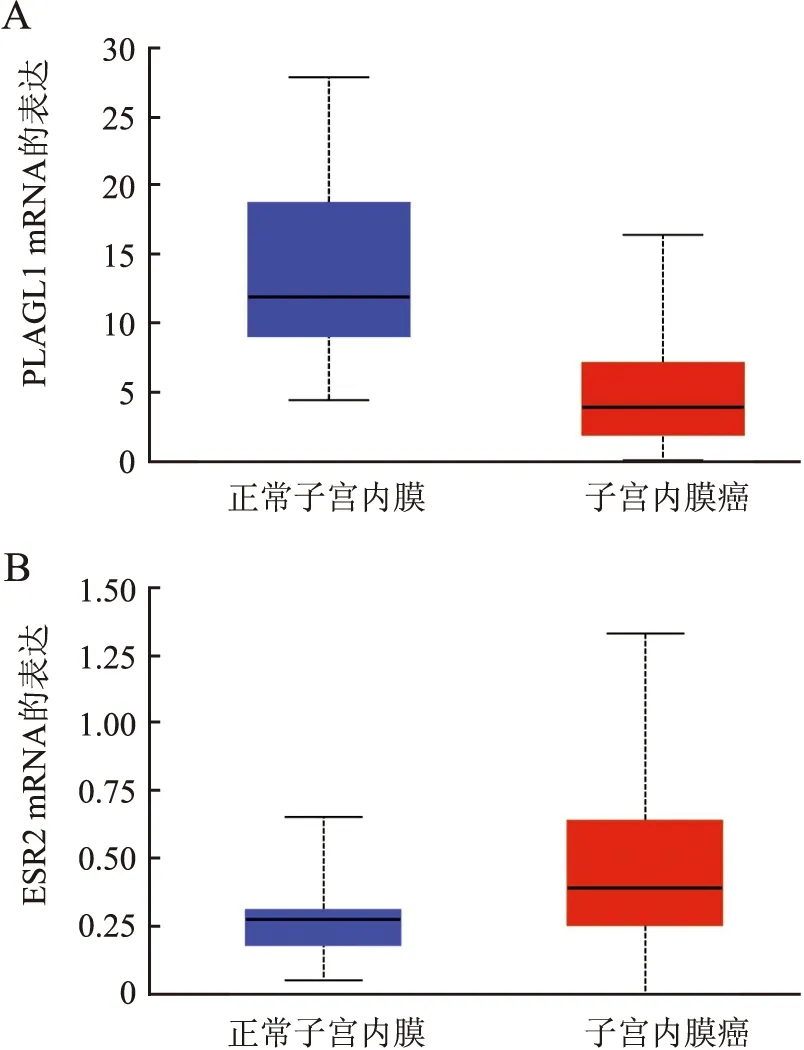
图1 正常子宫内膜及UCEC中PLAGL1和ESR2 mRNA的表达:A.正常子宫内膜及UCEC中PLAGL1 mRNA的表达B.正常子宫内膜及UCEC中ESR2 mRNA的表达

图2 UTEA及正常组织中PLAGL1和ERβ的表达:A.UTEA中PLAGL1的表达,MaxVision法;B.正常组织中PLAGL1的表达,MaxVision法;C.UTEA中ERβ的表达,MaxVision法;D.正常组织中ERβ的表达,MaxVision法
2.3 UTEA中PLAGL1和ERβ表达与临床病理特征的关系PLAGL1表达与UTEA肿瘤分级、临床分期、肿瘤累及子宫颈、肌层浸润深度、淋巴结转移和p53错义突变均显著相关(P均<0.05,表2)。其中高分化组PLAGL1高表达率为50.0%,显著高于低分化组(25.9%,P<0.05);Ⅰ期组PLAGL1高表达率为50.0%,显著高于Ⅱ+Ⅲ期组(6.7%,P<0.05)。肿瘤浸润子宫颈间质组和侵及>1/2子宫体肌层组PLAGL1的高表达率分别为9.5%和11.1%,显著低于未累及子宫颈和侵及≤1/2子宫体肌层组(42.9%、45.6%,P<0.05)。7例伴淋巴结转移组PLAGL1均呈低表达,而无淋巴结转移组中62.3%的PLAGL1呈低表达,两者差异有显著性(P<0.05)。PLAGL1在伴p53突变的UTEA组中高表达率为26.4%,显著低于无p53突变组(48.4%,P<0.05)。PLAGL1表达与患者年龄、绝经状态无关(P均>0.05,表2)。ERβ在高分化UTEA组中高表达率为46.7%,与低分化组相比(35.2%),差异无显著性(P>0.05);Ⅰ期组ERβ高表达率为37.0%,与Ⅱ+Ⅲ期组相比(43.3%),差异无显著性(P>0.05)。ERβ在伴p53突变的UTEA组中高表达率为41.5%,与无p53突变组相比(35.5%),差异无显著性(P>0.05)。ERβ表达与患者年龄、绝经状态、肿瘤分级、临床分期、肿瘤累及子宫颈、肌层浸润深度、淋巴结转移和p53突变均无关(P均>0.05,表2)。
2.4 UTEA中PLAGL1与ERβ表达的相关性采用Spearman等级相关分析UTEA中PLAGL1与ERβ的表达相关性,结果显示:UTEA中PLAGL1与ERβ的表达呈显著正相关(r=0.236,P<0.05,表3)。
3 讨论
PLAG家族成员包括PLAG1、PLAGL1和PLAGL2,以核蛋白转录调节因子的形式在调节细胞正常生理功能中发挥重要作用[4]。其中PLAGL1基因定位于6号染色体q24上,编码抗增殖转录因子,在正常组织中广泛表达,与生理代谢、遗传和多种病理状态相关[5]。PLAGL1在人正常肾小球、近曲小管、远曲小管和集合管中差异表达,提示PLAGL1可以通过作为转录因子和(或)核受体的转录辅助激活或阻遏因子来调节多种基因的表达,两种模式下PLAGL1基因的作用可以重叠,提示PLAGL1基因能够整合、调控多条信号通路[10]。

表1 UTEA及正常组织中PLAGL1和ERβ的表达[n(%)]
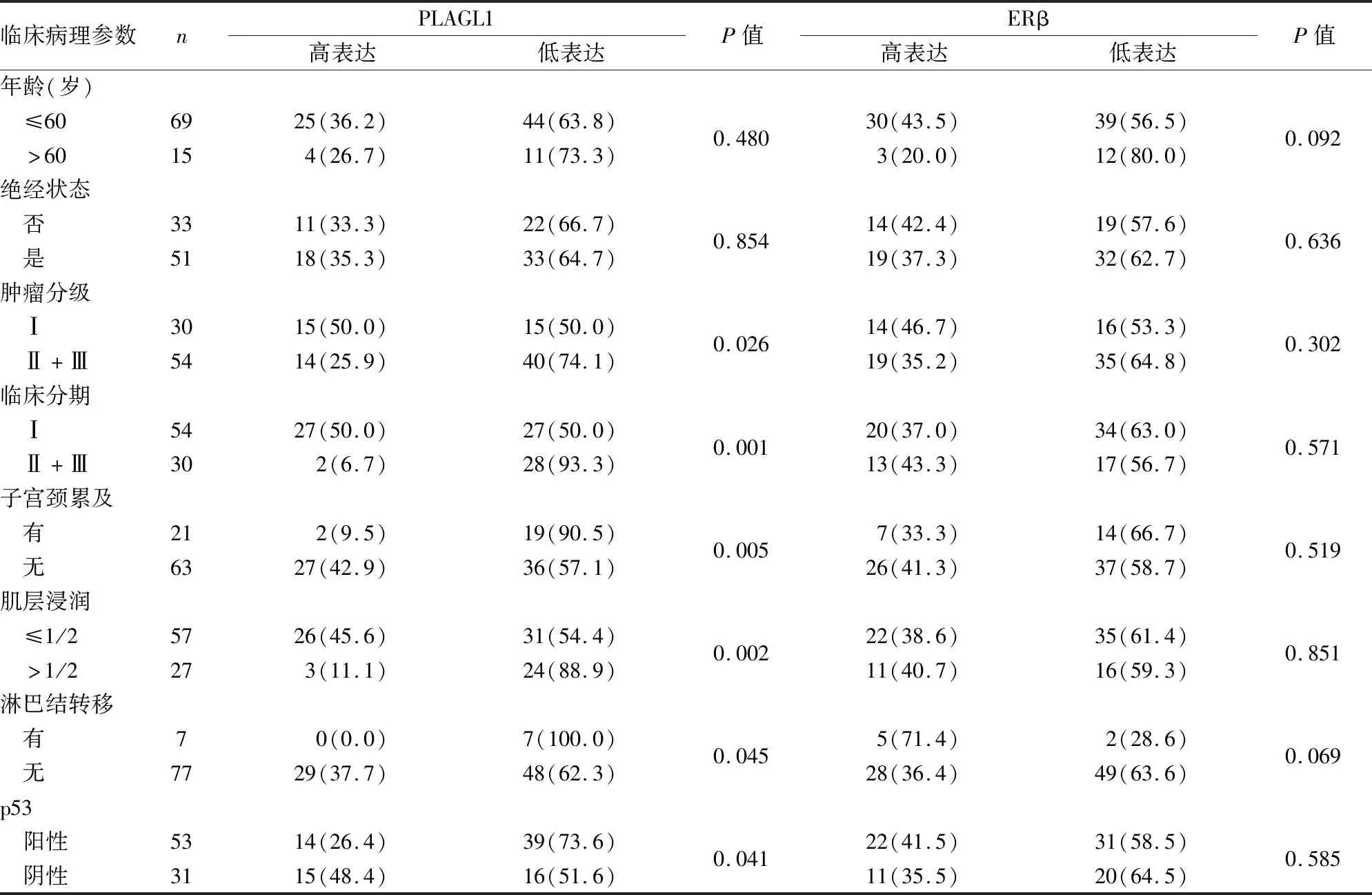
表2 UTEA中PLAGL1和ERβ表达与临床病理特征的关系[n(%)]
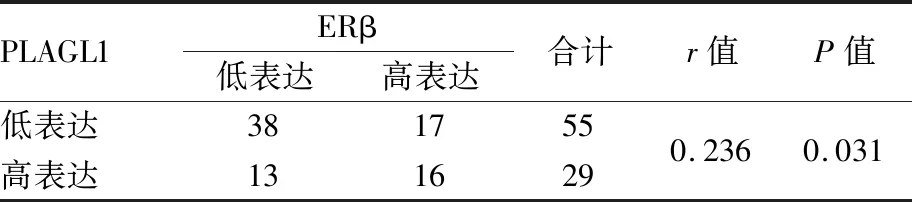
表3 UTEA中PLAGL1与ERβ表达的相关性
PLAGL1作为肿瘤抑制因子,通过促进细胞凋亡、阻滞细胞周期抑制肿瘤生长。本组证实UTEA中PLAGL1蛋白表达水平显著低于正常组织,与TCGA数据库分析结果一致,提示抑癌基因PLAGL1异常表达可能致UTEA的发生。本实验挖掘TCGA数据库肿瘤信息进行基因表达谱分析,结果显示:PLAGL1在不同类别的肿瘤中差异表达。文献报道[11],卵巢癌中6号染色体q24-q25区域的高甲基化抑制PLAGL1基因转录,是肿瘤发生的驱动事件。Jacobs等[12]报道PLAGL1基因表达缺失与前列腺良性病变向恶性肿瘤的转变相关,PLAGL1失活促进前列腺癌进展。结肠癌中PLAGL1 mRNA水平显著低于正常组织,PLAGL1表达失调可能参与结肠癌进展[5]。在肾透明细胞癌中PLAGL1表达水平显著升高,支持PLAGL1表达与肿瘤发生相关,有望成为预后标志物,但其分子机制仍不明确[13-14]。基因表达谱分析提示PLAGL1基因在乳腺癌中表达上调[15],但尚无基础实验证实。有研究[16-17]发现,肝细胞癌中PLAGL1基因的转录水平显著降低,提示在肝细胞癌发生过程中可能存在PLAGL1异常转录。
本实验进一步分析PLAGL1蛋白表达水平与UTEA临床病理特征的关系,结果显示:UTEA高分化组PLAGL1蛋白表达水平显著高于低分化组,提示PLAGL1参与肿瘤分化;临床Ⅰ期UTEA中的PLAGL1蛋白表达水平显著高于Ⅱ~Ⅲ期,提示PLAGL1失活可能增加肿瘤侵袭性,UTEA中PLAGL1蛋白表达下调可能提示肿瘤累及子宫颈、侵及>1/2子宫体肌层、淋巴结转移,在病理诊断为UTEA的子宫腔标本中检测PLAGL1蛋白可能为后续手术方式的选择、患者预后的评估提供参考。已有研究[16]证实,PLAGL1可与p53基因相互作用形成异源二聚体,诱导垂体腺苷酸环化酶激活肽受体(PACAP1-R)的表达,可诱导基因转录,抑制细胞增殖。在UCEC中诱导肿瘤抑制蛋白p53表达可激活细胞凋亡通路,提示上调p53可抑制肿瘤进展、改善患者预后[18]。本组结果显示:UTEA中p53错义突变者伴PLAGL1蛋白表达下调,提示p53基因可能与PLAGL1协同发挥肿瘤抑制作用,联合抑制p53、PLAGL1基因失活可能抑制UTEA进展。
ESR2是卵巢颗粒细胞中关键的转录调控因子,ESR2缺失的颗粒细胞表现出较强的迁移能力、侵袭性和较弱的黏附性[19],卵巢癌的发生与ESR2缺失相关,可能是由雌激素与其受体和辅助因子的局部作用失调所致[20]。研究[21]发现,ERβ在胃癌中较正常组织高表达,抑制ESR2在胃癌细胞的内源性表达可诱导细胞凋亡,从而阻滞胃癌细胞增殖、促进自噬,提示ESR2可能成为潜在治疗靶点。结肠癌中ESR2 mRNA显著降低,但ESR2下调与患者总生存期缩短无关,上调ESR2表达无法改善患者预后[22]。ESR2作为肿瘤抑制基因,在乳腺癌、肺癌、前列腺癌、肾透明细胞癌等恶性肿瘤中表达下调,而弥漫大B细胞淋巴瘤中ESR2 mRNA显著升高,提示ESR2表达异常是多基因、多通路相互作用的结果,检测ESR2表达水平可用于评估患者预后[7]。本实验证实,ERβ表达与UTEA患者年龄、绝经状态、肿瘤分级、临床分期、肿瘤累及子宫颈、肌层浸润深度、淋巴结转移和p53突变均无关;而PLAGL1与ERβ的表达呈正相关,提示抑癌基因ESR2可能依赖与PLAGL1基因相互作用、协同发挥肿瘤抑制作用。
综上所述,UTEA中PLAGL1蛋白表达水平显著降低,可以作为UTEA病理诊断及分子分型的生物学标志物,为临床个体化治疗及预后风险评估提供参考。PLAGL1和ERβ异常表达可能联合参与UTEA的发生、发展,关于PLAGL1和ESR2在UTEA中的协同作用机制仍需进一步验证。
