CT影像组学预测结直肠癌肝转移术后患者1年内无进展生存期
2022-08-07谷小磊朱海涛李晓婷孙应实
邢 倩,谷小磊,朱海涛,李晓婷,崔 湧,孙应实
(北京大学肿瘤医院暨北京市肿瘤防治研究所医学影像科 恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142)
结直肠癌已成为世界范围内发病率第三的恶性肿瘤[1],肝脏是其血行转移的最主要器官[2]。目前手术切除仍是治疗结直肠癌肝转移(colorectal liver metastases, CRLM)以获得长期生存的最佳方法[3],但术后复发率较高,且与患者总生存期相关[4]。准确识别高复发风险患者对于术后及时调整治疗策略具有指导意义,但在术前新辅助治疗的大背景下,现有评估系统尚未获得较满意外部验证[5]。有学者[6-7]探索以影像学特征预测CRLM术后复发的价值,发现相比传统形态学及实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST),影像组学更具优势[8]。本研究基于CRLM患者术前末次CT图像构建预测术后1年内无进展生存期(progression free survival, PFS)的影像组学模型,并评价其应用价值。
1 资料与方法
1.1 研究对象 回顾性分析2009年9月—2018年3月147例于北京大学肿瘤医院确诊的CRLM患者,男91例、女56例,年龄24~83岁、平均(56.1±10.7)岁;包括98例结肠癌及49例直肠癌患者;肝转移癌1~12个,中位数2.0个,7例存在未根治的肝外转移灶;139例接受手术治疗,包括49例解剖性肝切除、90例非解剖性肝切除,8例接受非解剖性肝切除术联合射频消融治疗。纳入标准:①经根治性手术切除原发灶及肝转移灶,术后病理证实CRLM;②术前末次(1个月内)上腹部增强CT资料完整,图像质量佳。排除标准:①肝转移灶直径<1.0 cm;②经局部治疗肝转移灶;③围手术期因非肿瘤因素死亡。按2∶1比例将患者分为训练集(n=100)及验证集(n=47)。记录患者临床信息、肿瘤分期、治疗方案及实验室检查等结果。随访至2020年11月,记录PFS,即自手术之日至影像学检查发现疾病复发、转移、肝外转移灶进展或死亡的时间;对未能手术切除肝外转移病灶者,以复查显示肝外转移灶增大、超过基线20%为疾病进展。根据PFS将患者分为预后良好(PFS≥12个月)及预后不佳(PFS<12个月)[9]。
1.2 仪器与方法 采用GE LightSpeed VCT/Discovery 750 HD/Philips Brilliance iCT多排螺旋CT扫描仪。嘱患者仰卧,使用高压注射器经肘正中静脉以3.0 ml/s流率注射80~100 ml碘海醇对比剂(300 mgI/ml),采集上腹部轴位增强CT图像,参数:管电压120 kV,自动管电流,球管转速0.8~1.0 rot/s,准直64×0.625 mm,层厚、层间距均为5 mm;分别于开始对比剂注射后25~30 s及60~80 s采集动脉期及门静脉期图像。
1.3 图像分析及特征提取 由1名具有5年腹部影像学诊断经验的医师采用3D Slicer 4.10软件(https://www.slicer.org)沿病灶边缘逐层勾画CT门脉期图像中肝转移灶ROI,由另1名具备20年工作经验的医师确认,共有369个可识别病灶。以PyRadiomics函数包对以不同CT设备采集的图像进行标准化处理。对多发病灶患者仅提取体积最大病灶的CT特征。见图1、2。
1.4 模型构建 以预后良好、预后不佳作为二分类标签用于训练模型和验证。对训练集数据均于最佳超参数值下进行训练,以t检验及相关检验筛选影像组学特征,将剩余特征输入极端梯度提升(eXtreme gradient boosting, XGBoost)模型以实现二分类,通过计算每个特征的增益在所有特征中的比重得到其重要性,并据以构建决策树,特征越重要,越接近决策树根部;各决策树输出值相加,得到每例患者的影像组学分值作为其影像组标签,计算影像组学评分(图3)。以单因素logistic回归筛选临床因素,以向前逐步logistic回归法构建临床模型及临床、影像组学联合模型。
1.5 统计学分析 采用SPSS 25.0统计分析软件。以频数表示计数资料,行Pearsonχ2或连续校正χ2检验;以±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示非正态分布的计量资料,行Mann-WhitneyU检验。采用多因素logistic回归构建临床模型及临床、影像组学联合模型。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,计算曲线下面积(area under the curve, AUC),评价各模型预测CRLM患者术后PFS的效能,并以MedCalc 19.6.4软件(https://www.medcalc.org)进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料 训练集与验证集患者年龄及N分期差异均有统计学意义(P均<0.05);训练集内,预后良好及预后不佳患者原发灶N分期、有无基因突变及有无术后化疗情况差异均有统计学意义(P均<0.05);验证集内二者基本资料差异均无统计学意义(P均>0.05),见表1。

表1 147例CRLM患者基本资料
2.2 模型构建 决策树数目为2,最大深度为4;共选出7个特征用于构建影像组学模型,见表2。logistic回归分析显示,临床模型中,原发灶N分期、有无基因突变及有无术后化疗是预测CRLM患者术后PFS的独立因素;联合模型中,在此基础上还包括影像组学评分,见表3。

表2 用于预测CRLM患者术后PFS的CT影像组学特征
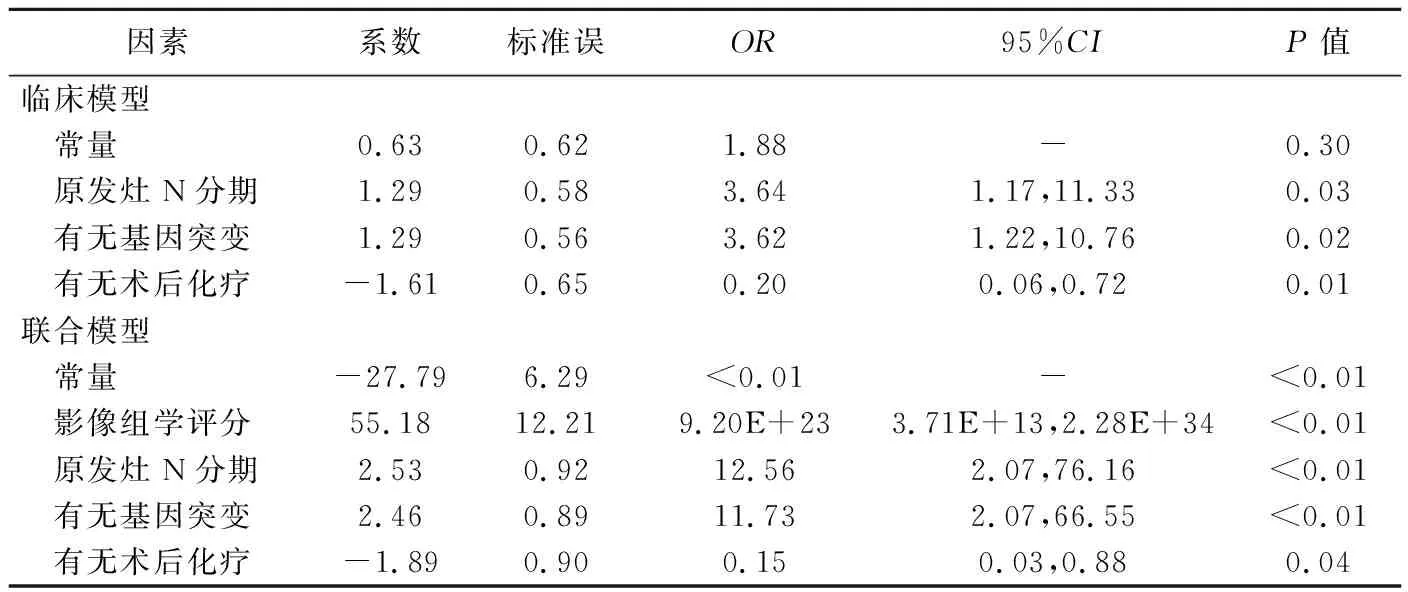
表3 临床模型及联合模型预测CRLM患者术后PFS的logistic回归分析结果
2.3 模型效能 影像组学模型及联合模型预测训练集CRLM患者术后PFS的效能差异无统计学意义(P=0.104),二者均优于临床模型(P=0.001、P<0.001)。验证集中,联合模型优于临床模型(P=0.003),其余两两比较差异均无统计学意义(P均>0.05),见表4及图4。

表4 不同模型预测CRLM患者术后PFS效能
3 讨论
本研究以术前末次CT所示CRLM为基础,构建影像组学模型、临床模型及联合模型,发现影像组学模型及联合模型预测患者术后1年PFS的稳定性较好,可辅助临床早期发现复发高危患者。纳入影像组学模型的7个特征中,f1、f2及f4体现图像的不均匀性,直接反映病灶门脉期强化的不均匀程度,间接反映病灶内残存肿瘤细胞的百分比,其数值大小与预后呈负相关[10-11],与形态学标准相符合。f3数值越小,代表图像中灰度共生矩阵对角线方差越大,表现为纹理变化较慢、图像纹理较为粗糙;f5数值越大,代表图像强化程度越高,提示病灶血供丰富,即恶性程度相对更高。相比肉眼所见形态学特点,影像组学可更为深入地挖掘病变边缘、强化特点及强化均匀度等方面肉眼无法评估的指标,提供更为准确的定量指标用于评估图像特征。
本研究结果显示,在无法获得治疗前全部影像学资料的情况下,针对术前末次CT资料进行分析,亦可较为准确地预测1年内PFS,且更为便捷、高效,可指导临床决策,辅助拟定随访策略;将临床因素纳入分析后,联合模型在训练集及验证集的AUC均较临床模型有明显提升,进一步证实了影像组学标签的应用价值。但本研究样本量较小,可能造成结果偏倚,且缺乏外部验证,其临床实用性有待进一步观察。
综上,影像组学模型及联合模型预测CRLM患者1年内PFS的效能均较好,可辅助临床对术后患者分层及识别不良预后高风险因素。
