CT及MR血管造影图像融合评估原发性三叉神经痛患者三叉神经入脑干区血管、神经及骨性结构的关系
2022-08-07季达峰吕广明
徐 嘉,季达峰,吕广明*
(1.南通大学医学院,江苏 南通 226001;2.无锡市第二人民医院神经外科,江苏 无锡 214000)
原发性三叉神经痛(primary trigeminal neuralgia, PTN)发病率约5/100 000,患者多为中老年人,一般单侧(右侧居多)发病,主要累及眼睑下至口角(上颌支)或口角至颈上部(下颌支)[1-2];目前认为其发病机制主要为神经微血管压迫(neuro-vascular compression, NVC)导致三叉神经脱髓鞘。常规MR于患侧与对侧三叉神经根入脑干区(root entry zone, REZ)检出NVC的比值比为16.7,在REZ之外则无显著差异[1]。本研究观察CT及MRA双模态图像融合评估PTN患者REZ区血管、神经及骨性结构的关系的价值。
1 资料与方法
1.1 一般资料 收集2020年10月—2021年10月于无锡市第二人民医院就诊的10例接受头部CT及MR扫描的PTN患者,男3例,女7例,年龄49~75岁,中位年龄61岁;均为单侧发病,6例右侧、4例左侧;轻触上、下唇及鼻翼等部位可激发疼痛,且MRA诊断三叉神经根受压。
1.2 仪器与方法
1.2.1 CT 以Toshiba Aquilion ONE 320排CT机采集头部图像,管电压120 kV,管电流100 mAs,层厚4 mm,层间距1 mm,分辨率0.468 0 mm×0.468 0 mm×4 mm。
1.2.2 MR 以Siemens MAGNETOM Skyra 3.0T MR仪行头部MRA,采用三维时间飞跃序列行轴位扫描,TR 21 ms,TE 3.43 ms,飞跃角18°,层厚0.7 mm,层间距1 mm,分辨率0.390 6 mm×0.390 6 mm×0.7 mm。
1.3 图像预处理 将原始数据导入3D Slicer软件(Version 4.11.20210226, http://www.slicer.org),基于Raycasting Rendering对CT及MRA数据进行渲染,调整渲染阈值(-720),以显示皮肤结构,并行断层重采样。
1.4 图像融合
1.4.1 选取解剖特征点及融合标记点 根据CT及MRA图像中皮肤渲染及断层重采样结果,按以下原则选取体表及颅内均可明确定位的解剖特征点作为体表配准标记及内部配准标记,即解剖标记点:①CT及MRA图中均可明确定位,且定位范围<4 mm2;②避开耳廓、枕部皮肤、面颊等易变形区域;③具有对称性或中轴性且不可共面。共选出左耳轮起始后缘、右耳轮起始后缘、左内眦、右内眦、枕内隆凸与小脑幕起始处交界点、菱形窝背盖部顶、左侧脑室前角、右侧脑室前角及蝶鞍背顶端9个解剖标记点,依次标记为F1~F9。见图1。
计算各解剖标记点配准后的欧氏距离,据以筛选并每例保留融合标记点;以融合标记点的配准误差(fiducial registration error, FRE)评估图像整体FRE,即图像融合精度。以奇异值分解(singular value decomposition, SVD)算法(公式1~6)得出图像融合的变换矩阵,以公式7计算FRE。将融合标记点筛选标准设定为Ei(即i个解剖标记点配准后的欧氏距离)<5 mm,图像融合标准为FRE<5 mm。
dCT=FCT-FCTcdMRI=FMRA-FMRAc
(1)
(2)
[U,S,V]=svd(H)
(3)
R=U*VT
(4)
T=FCT-R*FMRA
(5)
Ei=FCT-FMRAt(i=1,2,…,9)
(6)
(7)
其中,d为标记点与几何中心的距离向量,FCT是CT标记点坐标,FCTc是FCT的几何中心坐标,FMIA指MRA标记点坐标,FMRAc是FMRA的几何中心坐标,H为2个标记点集的线性积分,R是旋转矩阵,T为位移矩阵,FMRAt指MRA转换后标记点的坐标。
1.4.2 可视化图像融合 采用以融合标记点获得的旋转/位移矩阵对CT及MRA图像进行融合,以CT为固定图像、MRA为移动图像,图像叠加透明值为0.5,重建矢状位及冠状位融合图像,见图2。
1.5 重建血管及神经 融合图像后,基于移动后的MRA手动分割并重建三叉神经根、下颌神经及大脑底部血管,获得神经及动脉模型。于矢状位图像中定位并手动描绘下颌神经;于大脑底部REZ进行血管分割与重建,向上扩展至双侧侧脑室前角水平、向下扩展至椎动脉入脑部。之后定位并观察小脑上动脉在REZ中的走行,对血管分割结果进行适当调整,完整重建小脑上动脉。
1.6 叠加显示重建结构与CT图像可视化 将位移后的MRA、神经和动脉模型及CT图像导入3D Slicer软件,对CT图像再次进行渲染,得到颅骨渲染效果。将重建的动脉模型、三叉神经根及下颌神经与颅骨叠加,根据下颌神经与卵圆孔的位置对融合位移量进行微调,以下颌神经进入卵圆孔为准。
1.7 测量距离 将神经及动脉投影显示于CT与MRA断层图像中,观察REZ处血管与三叉神经根的空间关系,判断PTN责任血管。见图3。
完成图像融合后,定位三叉神经根与责任血管最接近处,于局部左、右侧相应血管下缘放置标尺起点、于三叉神经根上缘放置标尺终点,软件自动计算二者之间的距离(图4A)。渲染CT数据后,分别于左、右侧相应血管下缘与三叉神经压迹上缘及卵圆孔放置标尺,测量其距离(图4B)。
1.8 统计学分析 采用Matlab(2016Ra)统计分析软件。以Jarque-Bear检验对计量资料进行正态性分析,符合者以±s表示。以配对t检验比较患侧与对侧相应血管相关参数。P<0.01为差异有统计学意义。
2 结果
2.1 图像融合精度 10例图像融合所用融合标记点有所不同,而图像融合精度均良好,FRE为1.862~3.156 mm,见表1及图5。
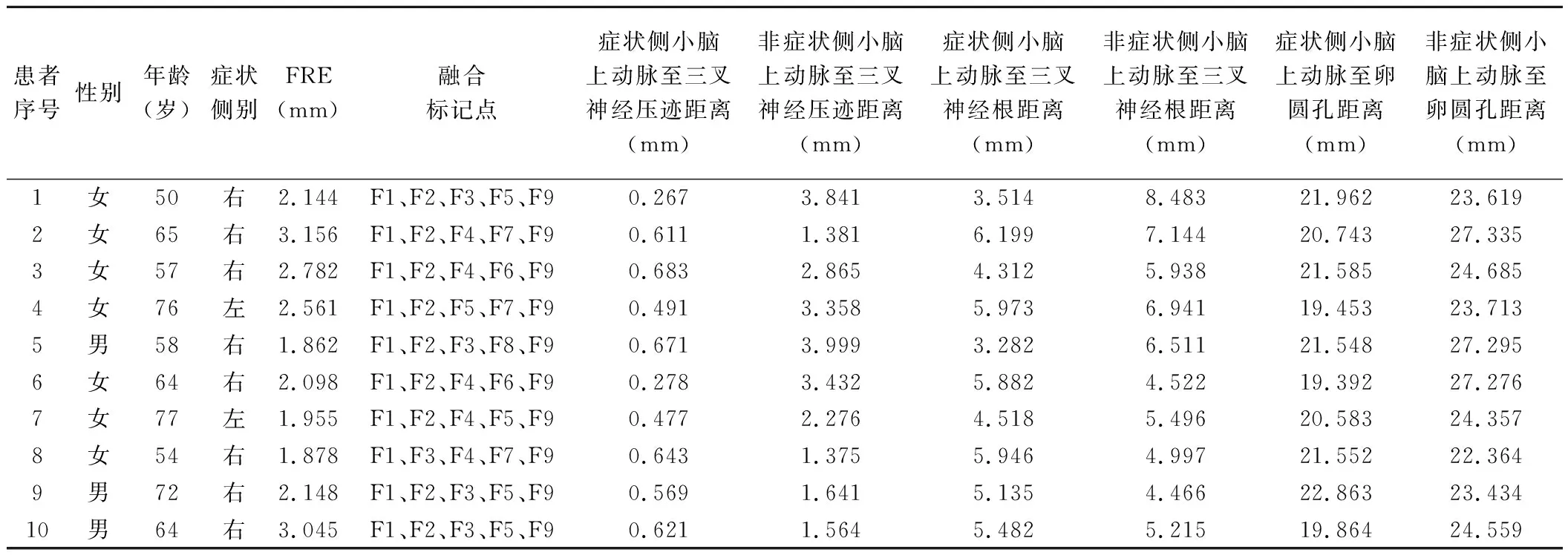
表1 10例PTN一般资料及头部(REZ)CT/MRA融合图像相关数据
2.2 责任血管与对侧相应血管相关参数比较 10例PTN责任血管均为小脑上动脉。患侧小脑上动脉与三叉神经压迹[(0.531±0.153)mm]及卵圆孔距离[(20.955±1.147)mm]均小于对侧[(2.573±1.050)mm、(24.864±1.807)mm,P均<0.001],而与三叉神经根的距离[(5.024±1.063)mm]与对侧差异无统计学意义[(5.971±1.292)mm,P=0.081]。
3 讨论
MRA是诊断PTN、术前定位及术后评估的重要手段[3-5]。PTN责任血管以小脑上动脉居多,占比达48.5%,其外还有小脑上动脉+岩静脉、岩静脉等[3]。三维时间飞跃序列对判断PTN责任血管具有重要意义[4,6]。MRA用于脑神经成像具有独特优势[7-8],利用弥散张量成像的表观弥散系数可进一步评估脑神经走行及受压情况[9]。导航微创手术高度依赖CT数据,明确三叉神经根、下颌神经与卵圆孔的关系是射频消融治疗PTN术前规划的重要依据[10]。通过融合CT与MRA图像可为评估相关结构提供更多信息。
融合常规CT与MRA对显示头部骨性结构及软组织具有重要价值[11]。基于互信息[12]算法是融合医学图像的常用手段,但要求2种图像中组织结构初始位置较为接近。基于点配准图像融合更为快捷便利,精度可控性也较高[13]。影像学检查PTN时,扫描范围多限于颅顶至鼻中部,可用解剖特征点有限。本研究利用解剖标记点[13]配准融合CT与MRA图像,以SVD法计算解剖标记点配准后的欧氏距离筛选融合标记点,通过计算融合标记点的FRE评估图像融合精度,所获融合图像视觉效果良好,个体FRE为1.862~3.156 mm,表明融合误差较小,可精确重现责任血管与骨性结构的关系。
既往将 PTN责任血管压迫神经分为3类:①分离,三叉神经根与血管之间存在一定距离,不直接接触;②接触,三叉神经根与血管相贴,但无压迫痕迹;③压迫,血管压迫三叉神经根使之变形。本研究重建神经、动脉模型并将其投影显示于CT与MRA断层图像中,以观察REZ血管与三叉神经根的空间关系,进而判定PTN责任血管,结果显示10例PTN责任血管均为小脑上动脉;通过比较患侧与对侧责任血管与三叉神经根的距离,推测患侧是否存在压迫现象,在不能完全重建神经时,可量化评价责任血管压迫程度,弥补既往分类的不足。
三叉神经压迹所在岩部是MVD术前评估的重要结构[14]。本研究提出了一个新的测量方法,用于量化责任血管与三叉神经压迹之间的距离。卵圆孔位于三叉神经根前方。本研究结果显示,PTN患侧小脑上动脉与三叉神经压迹及卵圆孔的距离均小于对侧,即责任血管在一定程度上发生了向前屈曲和变形。本研究中,小脑上动脉与三叉神经根的距离在患侧与对侧差异无统计学意义,原因可能在于样本量较少,且MRA采集层厚较厚,导致显示神经根不全及测量误差,有待优化MRA数据、收集更多病例后进一步分析。
综上,CT及MRA图像融合有助于定量评估PTN患者REZ处血管、骨性结构及三叉神经根的毗邻关系。
