非洲猪瘟病毒污染运输车辆模拟消毒试验
2022-08-06杨作丰张皓淳陈扬扬吴晓傲王宏燕庞学敏刘金玲
刘 俊,杨作丰,张皓淳,魏 澍,陈扬扬,吴晓傲,王宏燕,庞学敏,董 娜,刘金玲
(1.辽宁省农业发展服务中心,辽宁沈阳 110015;2.康平新望农牧有限公司,辽宁沈阳 110500;3.沈阳农业大学,辽宁沈阳 110161;4.沈阳市农业综合行政执法队,辽宁沈阳 110031)
自2018 年非洲猪瘟(ASF)在我国首次暴发以来,大量生猪染疫死亡或被扑杀,造成了巨大经济损失。ASF 目前尚无可用疫苗,防控难度大[1]。非洲猪瘟病毒(ASFV)是一种双链DNA 病毒,粒子直径大小为260 nm,具有双层脂质囊膜结构,基因组大小为170~190 kb,pH 耐受范围为3.9~11.5,在低温冷冻环境下可以存活数年,但经56 ℃处理70 min、60 ℃处理20 min 或80 ℃处理3 min 可被灭活[2]。猪伪狂犬病毒(PRV)也是一种双链DNA 病毒,粒子直径大小为180 nm,具有脂质单层囊膜结构,基因组大小为150 kb,pH 耐受范围为4~12,55~60 ℃处理30~50 min 或80 ℃处理3 min 可被灭活。可见ASFV 和PRV 在生物学特性和理化特性方面均具有极高的相似度。由于对ASFV 的研究需要在国家授权的相应级别生物安全实验室中才能进行,因此将PRV 作为ASFV临床研究标识物成为研究者们的普遍选择[3]。
精准清洗消毒是控制ASF 传染源、切断传播途径和保护易感动物的关键措施[4]。对运输车辆进行消毒是疫情应急处置及日常防控工作的重要环节[5],而碾压消毒垫和驶过消毒池是运输车辆较常用的两种消毒方式。为验证以上两种消毒方式对ASFV 的杀灭效果,本研究采用PRV 疫苗稀释液作为ASFV 替代标识物,喷洒车轮模拟ASFV 污染,在车辆碾压消毒垫和驶过消毒池后不同时间点进行车轮采样检测。本试验对运输车辆碾压消毒垫和驶过消毒池两种方式的消毒效果进行了评价,以期为优化ASF 疫情应急处置方案和日常消毒防控措施提供数据支撑。
1 材料和方法
1.1 试验材料
杜邦卫可(主要成分为过硫酸氢钾三盐复合物,稀释度1:200),购自杜邦卫可动物保健公司;火碱(化学成分为氢氧化钠,质量分数为2%),购自内蒙古君正化工有限责任公司;“喜可净”PRV活疫苗(主要成分为PRV Bartha K-61 株,稀释度为1:100),购自西班牙海博莱生物大药厂。
试验用车、消毒垫(麻袋)、消毒池(长15 m、宽4 m、深30 cm)、喷雾设备,由康平新望农牧有限公司提供或建造;ATP 清洗消毒效果检测仪、采样棉拭子、一次性培养皿、一次性涂抹棒、采样管、PBS 样品缓冲液、塑料薄膜,由辽宁省农业发展服务中心提供。
ChamQ Universal SYBR qPCR Master Mix、2×TaqPlus Master Mix,购自南京诺唯赞生物科技有限公司;无菌除酶水,购自索莱宝公司;pBM16A Toposmart 克隆试剂盒,购自博迈德生物公司;DH5α 感受态,购自全式金生物公司;麦康凯琼脂培养基,购自广东环凯微生物公司。
1.2 试验方法
1.2.1 消毒垫消毒试验 试验车辆经过充分清洗,经ATP 生物荧光检测仪检测RUL 值小于50,表示达到试验可接受水平;试验车辆车头前铺设20 m长的洁净厚塑料薄膜,在薄膜上沿车轮碾压路线铺设15 m长麻袋,喷洒1:200稀释的杜邦卫可消毒剂,直至充分浸润。在车辆一侧每个车轮的底部均匀选择6 个5 cm×5 cm 的采样点并用着色剂标记,用1:100 稀释的PRV 活疫苗均匀喷洒整个车轮;开动车辆缓慢碾压浸润杜邦卫可消毒液的麻袋,并在碾压后0、1、2、3、4、5 min 对每个车轮的标记位点进行采样,同一车轮的样品混样装入同一采样管(含10 mL PBS)内,4 ℃送至实验室进行检测。
1.2.2 消毒池消毒试验 试验车辆和消毒池经过充分清洗,经ATP 生物荧光检测仪检测RUL 值小于50,表示达到试验可接受水平;车辆一侧每个车轮的侧面均选择6 个5 cm×5 cm 的采样点并用着色剂标记,用1:100 稀释的PRV 活疫苗均匀喷洒4 个车轮;开动车辆缓慢驶过注满2%火碱消毒液的消毒池,并在驶过消毒池后0、2、5、10 min对每个车轮的标记位点进行采样,同一车轮的样品混样装入同一采样管(含10 mL PBS)内,4 ℃送至实验室进行检测。
1.3 样本检测
1.3.1 反应体系及反应条件 以PRV Bartha K-61 株gB基因为靶序列设计1对引物,优化建立了1 套SYBR Green 染料荧光定量PCR检测方法。上游引物F:5'-GTCTGTGAAGCGGTTCGTGAT-3';下游引物R:5'-ACAAGTTCAAGGCCCACATCTAC-3'。反应体系:ChamQ Universal SYBR qPCR Master Mix 5.0 μL,无菌除酶水3.6 μL,模板1.0 μL,上下游引物(10 pmol/μL)各0.2 μL。反应条件:95 ℃预变性30 s;95 ℃变性10 s,60 ℃退火延伸30 s,共40 个循环。
1.3.2 阳性标准品制备 以PRV Bartha K-61 株gB基因为靶序列另外设计1 对引物。上游引物F:5'-CTGGCCTCGGACGTCTT-3';下游引物R:5'-GCGGTCACCTTGTGGTTG-3'。目标扩增片段包含荧光定量PCR 检测方法的扩增片段。反应体系:2×TaqPlus Master Mix 50 μL,无菌除酶水32 μL,模板10 μL,上下游引物(10 pmol/μL)各4 μL。反应条件:95 ℃ 3 min;95 ℃ 15 s,58℃ 20 s,72℃ 1 min,共30 个循环;72℃ 10 min。以PRV Bartha K-61 株DNA 为模板进行PCR 扩增,反应结束后回收目的片段连接到pMD18-T 载体上,转化DH5α 感受态。挑选鉴定正确的阳性质粒作为标准品,将标准品进行10 倍倍比稀释,采用建立的SYBR Green 染料荧光定量PCR 方法进行扩增,每种梯度标准品做3 个重复,以拷贝数的次方值为横坐标,Ct 值为纵坐标,绘制标准曲线。
1.3.3 PRV 核酸检测 对样本拭子进行涡旋震荡洗脱,各取同一采样时间点(消毒垫模式0、1、2、3、4、5 min;消毒池模式0、2、5、10 min)4个车轮的洗脱液50 μL 混合成200 μL 的混合洗脱液,提取样本DNA,采用建立的荧光定量PCR 方法进行检测,以灭菌水为阴性对照,“喜可净”PRV活疫苗为阳性对照,每个样本做3 个重复。
1.3.4 细菌培养计数 对样本拭子进行涡旋震荡洗脱,各取同一采样时间点(消毒垫模式0、1、2、3、4、5 min;消毒池模式0、2、5、10 min)4 个车轮的洗脱液100 μL 混合成400 μL 的混合洗脱液;分别取100 μL 混合洗脱液均匀涂布于麦康凯琼脂培养皿上,以灭菌水为阴性对照,车轮驶过消毒垫和消毒池前4 个车轮棉拭子样本PBS 洗脱液为阳性对照,37 ℃倒置培养48 h 后采用平板菌落计数法进行菌落计数,每个样本做3 个重复。
2 结果
2.1 阳性标准品制备与检测方法建立
经测定,标准品的拷贝数为3.968×106copies/μL,通过10 倍倍比稀释至3.968×102copies/μL,采用建立的SYBR Green染料荧光定量PCR方法进行扩增,得到标准曲线线性回归方程为y=-3.299 9x+36.965,R2=0.993,R2>0.99 表示所建方法和线性回归方程有效(表1 和图1)。

表1 10 倍梯度稀释标准品荧光定量PCR 检测结果
2.2 碾压消毒垫消毒效果
试验条件下车辆碾压驶过消毒垫后0、1、2、3、4、5 min,车轮PRV 检测的Ct 值随时间增加而增加,将Ct 值分别带入线性回归方程y=-3.299 9x+36.965,得到样本中病毒拷贝数的次方值(表2);车辆碾压驶过消毒垫后0、1、2、3、4、5 min,车轮可被检测的菌落数呈下降趋势(表3)。结果说明,车辆碾压消毒垫(含卫可)对PRV 和细菌均有杀灭作用,杀灭效果随时间增加而增强,但消毒垫模式消毒后5 min 仍无法杀灭所有PRV,细菌杀灭率为92.5%。鉴于PRV 与ASFV 在生物学特性和理化特性上具有高度相似性,因此推定在相同试验条件下杜邦卫可消毒液对ASFV 具有相似的杀灭效果。

表2 消毒垫方式PRV 杀灭效果

表3 消毒垫方式细菌计数结果
2.3 驶过消毒池消毒效果
试验条件下车辆驶过消毒池后0、2、5、10 min,车轮PRV 检测的Ct 值随时间增加而增大,可被检测的PRV 含量呈逐渐下降趋势,驶过消毒池后10 min 未检测到PRV 核酸,将Ct 值带入线性回归方程y=-3.299 9x+36.965,得到样本中病毒拷贝数的次方值(表4);车辆驶过消毒池后0、2、5、10 min,车轮可被检测的菌落数呈下降趋势,5 min 后杀菌率为94.6%,10 min 后杀菌率达到98.3%(表5)。结果说明,车辆驶过消毒池(含火碱)对PRV 和细菌均有杀灭作用,杀灭效果随时间增加而增强,驶过消毒池后10 min 即可有效杀灭所有PRV。鉴于PRV 与ASFV 在生物学特性和理化特性上具有高度相似性,因此推定在相同试验条件下火碱对ASFV 具有相似的杀灭效果。
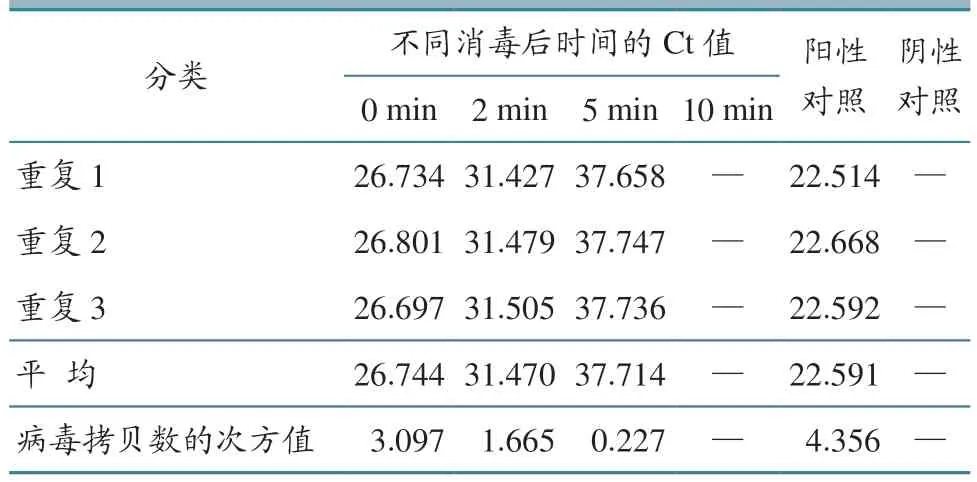
表4 消毒池方式PRV 杀灭效果
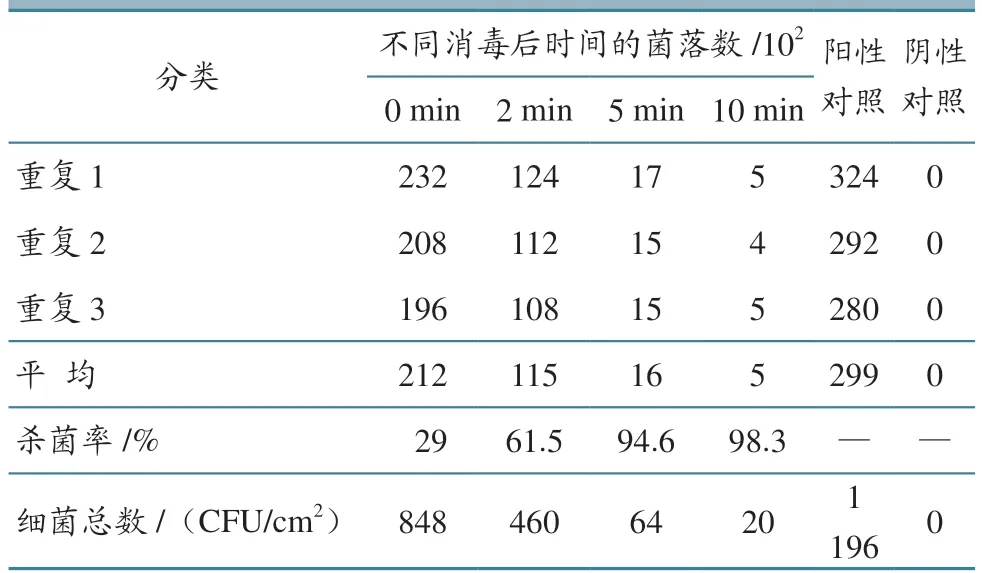
表5 消毒池方式细菌计数结果
3 讨论
本研究经过试验确定了两种消毒方法对ASFV和细菌均能起到有效杀灭作用,但杀灭效果受消毒时间长短影响较大。陈家锃[6]从消毒剂作用机理方面归纳了影响ASFV 消毒效果的七大因素,发现消毒时间不足是ASFV 消毒中最常见的误区之一,每种消毒剂在特定浓度下都有最短杀菌时间,消毒作用时间必须长于最短消菌时间才能起到消毒作用。本试验结果显示,碾压消毒垫方式在消毒后5 min 仍能检测到病毒核酸,也无法杀灭所有细菌,提示一次性无停留短时碾压消毒垫方式对车轮携带病毒和细菌的杀灭效果有限,与相关类似研究结果具有一致性。建议在使用消毒垫方式消毒时,在消毒剂有效使用期内延长车辆在消毒垫上的停留时间或使用多组消毒垫间隔组合等方式延长病毒和细菌与消毒剂的作用时间,确保消毒效果。本试验用消毒池长15 m,车轮在消毒池中的行进长度大于5个轮胎周长,因此轮胎携带的病毒和细菌与消毒液接触时间较长,但基层多数消毒池实际长度达不到此标准,建议通过往复行驶多次等方法延长车辆驶过消毒池的时间来增强消毒效果。
“杜邦卫可”溶解于水后会发生链式反应,持续产生小分子自由基、次氯酸、新生态氧和活性氧衍生物,通过氧化和氯化反应使病原体蛋白变性,产生的羟基自由基可作用于病原体DNA 磷酸二酯键,干扰其合成,从而破坏杀灭病原微生物[7-8]。余婷等[9]研究“杜邦卫可”对ASFV 的消毒杀灭效果发现,在1:800 的稀释比例下,卫可消毒剂对ASFV 仍然有效;南文龙等[10]也证实过硫酸氢钾类消毒剂对ASFV 荧光定量PCR 检测Ct 值影响显著。火碱属于强碱类,火碱溶液作用于病原体可以使其蛋白质和核酸发生变性和降解。综上可知,杜邦卫可和火碱均能对ASFV 核酸产生降解作用,而以被降解的核酸为模板会直接影响到荧光定量PCR 的Ct 值。因此,应用SYBR Green 荧光定量PCR 方法评价“杜邦卫可”和火碱的消毒效果是可行的[11]。如王巍等[12]发现,针对ASFV 消毒效果的评价,应该在确定ASFV 灭活方法的机理基础上,通过分析ASFV 基因组结构和序列特点,挖掘ASFV 的代谢脆弱区进行核酸检测。该论述为寻找更加科学的ASFV 消毒效果评价方法提供了新思路,对本研究方法改进提供了科学借鉴。
