甘蔗黑穗病的防治药剂筛选及产量评价
2022-08-06颜梅新张小秋王泽平雷敬超黄海荣黄伟华陈潇航覃兴云黄冬梅李秋芳宋修鹏
颜梅新,张小秋,王泽平,雷敬超,黄海荣,黄伟华,陈潇航,覃兴云,黄 海,黄冬梅,李秋芳,宋修鹏*
甘蔗黑穗病的防治药剂筛选及产量评价
颜梅新1,张小秋1,王泽平1,雷敬超1,黄海荣1,黄伟华2,陈潇航3,覃兴云4,黄 海4,黄冬梅1,李秋芳1,宋修鹏1*
1. 广西壮族自治区农业科学院甘蔗研究所/中国农业科学院甘蔗研究中心/农业农村部广西甘蔗生物技术与遗传改良重点实验室/广西甘蔗遗传改良重点实验室,广西南宁 530007;2. 广西壮族自治区农业科学院生物技术研究所,广西南宁 530003;3. 百色市农业科学研究所/广西壮族自治区农业科学院百色分院/国家糖料产业技术体系百色综合试验站,广西百色 533612;4. 来宾市金凤凰农业投资有限公司,广西来宾 546100
由甘蔗鞭黑粉菌引起的甘蔗黑穗病是我国甘蔗生产中危害最大的病害,给甘蔗产业造成严重的产量和经济损失。化学防治是作物病害综合防治的重要措施之一,开展甘蔗黑穗病高效、低毒、低残留防治药剂的筛选,进行田间防治试验,对甘蔗黑穗病的有效防治和提高甘蔗产量具有重要意义。为筛选适合大田防治甘蔗黑穗病的推荐化学药剂,通过测定11种杀菌剂对甘蔗鞭黑粉菌的抑菌试验,采用扫描电镜解析有效杀菌剂的抑菌机理,通过新植蔗和宿根蔗的甘蔗黑穗病大田防治试验,评价杀菌剂的防治效果和对产量、株高、茎径、公顷有效茎数、锤度、单茎重等甘蔗主要农艺性状的影响。结果表明,经室内生物活性测定,获得4种杀菌剂对甘蔗鞭黑粉菌单倍体生长、有性配合、冬孢子萌发有抑制作用,分别是42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油和325 g/L苯甲·嘧菌酯悬浮剂。扫描电镜显示,这4种杀菌剂均对甘蔗鞭黑粉菌冬孢子和单倍体孢子细胞组织造成不同程度的破坏,使甘蔗鞭黑粉菌失活。在大田新植蔗的甘蔗黑穗病防治试验中,42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油和325 g/L苯甲·嘧菌酯悬浮剂的防治效果分别为91.81%、82.84%、81.76%、70.92%,各药剂防治区产量分别比对照增产20.84%、17.13%、15.92%、13.35%。在宿根蔗的甘蔗黑穗病防治试验中,以上杀菌剂防治效果分别为89.35%、82.21%、81.51%、70.18%,其产量分别比对照增产30.15%、24.05%、20.33%、16.58%。新植蔗和宿根蔗药剂防治区的甘蔗其他农艺性状均优于对照区。这4种杀菌剂对甘蔗黑穗病均有良好的防治效果和增产作用,可作为大田防治甘蔗黑穗病的推荐杀菌剂。
甘蔗;黑穗病;杀菌剂;防治;产量评价
甘蔗黑穗病是世界重要的甘蔗病害之一,也是广西乃至全国甘蔗危害最严重的病害。由于广西甘蔗栽培品种比较单一,缺乏抗病品种,甘蔗连年种植,菌源长年积累,使甘蔗黑穗病的发生和危害日趋严重,给甘蔗产业造成了严重的经济损失[1-2]。甘蔗黑穗病病原为甘蔗鞭黑粉菌(),属担子菌亚门,两型真菌,具有特殊的生活史,即冬孢子萌发产生单倍体孢子,不同遗传交配型的单倍体细胞通过有性配合形成双核菌丝体,侵染寄主植物,形成冬孢子完成其生活史[3]。目前,化学防治仍然是作物病害综合防治的重要措施,因此,开展甘蔗黑穗病高效、低毒、低残留防治药剂的筛选,进行田间药剂防治试验,对甘蔗黑穗病的有效防治和提高甘蔗产量具有重要意义。
前人对甘蔗黑穗病的防治进行了相关研究,SINHA等[4]在甘蔗黑穗病发病植株上分离获得一株能抑制甘蔗鞭黑粉菌冬孢子萌发的镰刀菌菌株[] var.。廖咏梅等[5]从甘蔗组织和甘蔗根际土壤中分离获得对甘蔗鞭黑粉菌有拮抗作用的细菌菌株。JAYAKUMAR等[6]从甘蔗不同组织中分离筛选到能有效抑制甘蔗鞭黑粉菌菌丝生长的内生细菌,大田小区试验证实其中2株内生细菌具有一定的防治效果,并且具有促进甘蔗生长的作用。LIU等[7]从土壤中分离获得一株能够阻断甘蔗鞭黑粉菌有性配合的细菌菌株ST4,温室试验表明该菌株具有明显的生防作用。另外,已有研究证实海洋微生物如海黄瓜共附生细菌[8]、海绵共栖细菌[9]、放线菌[10]及表面活性剂鼠李糖脂[11]和化学物质霉酚酸(mycophenolic acid)[12]等也对甘蔗鞭黑粉菌有抑制作用。以上生防菌具有开发成为生物农药的潜力,但离大田应用还有一定距离。而筛选出对甘蔗鞭黑粉菌具有抑制作用的高效、低毒、低残留化学药剂也是一种快捷的途径。吴伟怀等[13]测定了不同杀菌剂对甘蔗鞭黑粉菌的室内生物活性,结果表明,三唑酮和五氯硝基苯化学药剂均可抑制冬孢子的萌发;朱桂宁等[14-15]通过测定不同杀菌剂对甘蔗鞭黑粉菌的室内生物活性,获得8种高效、低毒低残留化学农药,其中5种化学农药在小区试验中均有良好的防治效果。
本研究通过室内生物活性测定,筛选出高效、低毒低残留化学药剂对甘蔗黑穗病进行防治试验,解析其作用机理,评价其对甘蔗株高、茎径、蔗糖分、产量等农艺性状的影响,为甘蔗黑穗病的化学防治技术在大田的推广应用提供依据。
1 材料与方法
1.1 材料
1.1.1 供试药剂 250 g/L嘧菌酯悬浮剂(英国先正达有限公司),250 g/L苯醚甲环唑乳油(瑞士先正达作物保护有限公司),325 g/L苯甲·嘧菌酯(200 g/L嘧菌酯+125 g/L苯醚甲环唑)(瑞士先正达作物保护有限公司),250 g/L丙环唑乳油(以色列马克西姆化学公司),75%肟菌·戊唑醇(肟菌酯10%+戊唑醇20%)水分散粒剂[拜耳作物科学(中国)有限公司],450 g/L咪鲜胺水乳剂(山东汤普乐作物科学有限公司),42.4%唑醚·氟酰胺(吡唑醚菌酯21.2%+氟唑菌酰胺21.2%)悬浮剂[巴斯夫植物保护(江苏)有限公司],62.5 g/L精甲·咯菌腈(咯菌腈25 g/L+精甲霜灵37.5 g/L)悬浮种衣剂(先正达南通作物保护有限公司),43%氟菌·肟菌酯(氟吡菌酰胺21.5%+肟菌酯21.5%)悬浮剂(青岛奥迪斯生物科技有限公司),60%唑醚·代森联(吡唑醚菌酯5%+代森联55%)水分散粒剂[拜耳作物科学(中国)有限公司],19%啶氧·丙环唑(丙环唑12%+啶氧菌酯7%)悬浮剂(美国杜邦公司)。
1.1.2 供试甘蔗品种 供试甘蔗品种新植为‘柳城05-136’,宿根为‘GT57’,由广西来宾国家科技园区提供品种和试验地。
1.1.3 供试菌株 采用已报道的甘蔗鞭黑粉菌菌株Ss17和Ss18及其冬孢子[1],菌株Ss17和Ss18分离自广东省湛江市甘蔗种植区甘蔗品种‘ROC22’的黑穗病样本的冬孢子,由广西农业科学院甘蔗研究所实验室保存并提供。
1.2 方法
1.2.1 杀菌剂室内筛选 (1)杀菌剂对甘蔗鞭黑粉菌单倍体孢子生长的抑制作用。参考朱桂宁等[14]的方法,稍作修改。以甘蔗鞭黑粉菌单倍体菌株Ss17[1]作为研究对象,挑取甘蔗鞭黑粉菌单倍体菌体于2 mL YePS液体培养基中,28℃,200 r/min下培养2 d作为母液,将Ss17的单倍体孢子悬浮液600调至0.20,将600=0.20的Ss17单倍体孢子悬浮液均匀分装于50 mL离心管中,每管5 mL孢子悬浮液,分别加入不同系列浓度的药剂,置于28℃、200 r/min摇床中培养,每隔3 h取出测定甘蔗鞭黑粉菌的值,至36 h止,绘制Ss17的生长曲线。各药剂的每个浓度处理3个重复,以不加药剂的YePS液体培养基(含Ss17的单倍体孢子)为对照。统计甘蔗鞭黑粉菌不同药剂浓度处理下600的净增长量,计算抑制率和50等。
(2)杀菌剂对甘蔗鞭黑粉菌有性配合的抑制作用。参考ZHONG等[12]的方法,适当修改。以甘蔗鞭黑粉菌不同性系单倍体菌株Ss17和Ss18作为研究对象,分别挑取甘蔗鞭黑粉菌单倍体菌体于2 mL YePS液体培养基中,28℃,200 r/min下培养2 d作为母液,按1∶100的比例用YePS液体培养基配成新的孢子悬浮液,于28℃,200 r/min下培养2 d。将Ss17和Ss18孢子悬浮液等体积混合,吸取1 μL混合菌液(Ss17+Ss18)点板至含不同药剂浓度的YePSA固体培养基上,置于恒温培养箱28℃培养,2 d后观察是否有白色菌丝出现,观察时间可延长至5 d。各药剂每个浓度处理设3个重复,以不加药剂的YePSA固体培养基为对照。
(3)杀菌剂对甘蔗鞭黑粉菌冬孢子萌发的生物活性测定。参考ZHONG等[12]的方法,适当修改。将甘蔗鞭黑粉菌冬孢子[1]用ddH2O制成冬孢子悬浮液(约5×104个冬孢子/mL)。取200 μL冬孢子悬浮液涂板于含有系列药剂浓度的琼脂平板上,置于28℃恒温培养箱中培养,各药剂的每个浓度处理设3个重复,以不加药剂的琼脂平板为对照。8 h后采用灭菌手术刀切取边长为1 cm大小的琼脂方块至载玻片上,盖上盖玻片,于显微镜下镜检各药剂处理的冬孢子萌发情况,统计100个冬孢子的萌发数,计算抑制率和EC50等。
1.2.2 有效抑制药剂对甘蔗鞭黑粉菌的作用机理 以甘蔗鞭黑粉菌单倍体菌株Ss17和冬孢子作为测试对象,挑取甘蔗鞭黑粉菌单倍体菌体于2 mL YePS液体培养基中,28℃,200 r/min下培养2 d作为母液,按1∶100的比例用YePS液体培养基配成新的孢子悬浮液,于28℃,200 r/min下培养2 d。5000 r/min常温离心,弃上清,加入等体积ddH2O重悬浮,加入有效中浓度对甘蔗鞭黑粉菌有抑制作用的药剂,以不加药为对照,28℃,200 r/min下处理30 min;5000 r/min常温离心,弃上清,加入等体积电镜固定液FAA(formaldehyde∶glacial acetic acid∶ethanol 70%=5∶5∶90)重悬浮。冬孢子用ddH2O制成悬浮液(约5×104个冬孢子/mL)加入有效中浓度对甘蔗鞭黑粉菌有抑制作用的药剂,以不加药为对照,28℃,200 r/min下处理30 min;5000 r/min常温离心,弃上清,加入等体积电镜固定液FAA(formaldehyde∶glacial acetic acid∶ethanol 70%=5∶5∶90)重悬浮。对处理过的甘蔗鞭黑粉菌单倍体菌体和冬孢子进行扫描电镜测试,扫描电镜方法参考MARQUES等[16]的文献。
1.2.3 大田防治试验 (1)新植蔗甘蔗黑穗病化学防治试验。新植蔗防治试验在来宾市国家示范园区甘蔗种植区进行,甘蔗品种‘柳城05-136’(高感黑穗病)蔗种由农投集团种茎加工厂提供,机械切割成单芽段。种植前甘蔗种茎浸泡药剂30 min(按药剂说明书的推荐浓度施用),设浸泡自来水不加药处理为对照。将浸泡药液和自来水的种茎分别种植于机械犁好的地块,行距1.2 m,试验地四周设置保护行。每个处理3个重复,每个重复200 m2,每个重复采取随机区组排列。于2020年4月16日种植,分别于7月16日(植后120 d)和10月16日(植后240 d)各调查1次甘蔗黑穗病发病情况,每个小区调查50丛,统计发病丛数和防治效率。于12月16日测量各处理的株高、茎径、锤度、产量等指标。参考朱桂宁等[15]的统计方法,依据统计数据对各试验药剂进行综合评价。
发病率=发病丛数/调查丛数×100%
防治效果=(对照发病率-药剂处理发病率)/对照发病率×100%
(2)宿根蔗甘蔗黑穗病化学防治试验。宿根蔗防治试验在来宾市国家示范园区甘蔗种植区进行,甘蔗品种‘GT57号’(感黑穗病)为第1年宿根,地块行距为1.2 m。2020年4月16日宿根蔗于出苗后高度约为20 cm时进行药剂喷淋处理。各试验药剂处理设3个重复,每个重复200 m2,设自来水不加药处理为对照,试验重复采取随机区组排列。各试验药剂处理均只施药1次,施药时着重喷淋甘蔗苗及周围土壤,每个处理用水量为450 L/hm2。病情、株高、茎径、锤度、产量等调查和统计方法与新植试验相同。
1.3 数据处理
采用SPSS 19.0软件对试验数据进行统计分析,通过Duncan’s新复极差法检验差异显著性。以各药剂浓度的对数和抑制率的几率值分别为横坐标()和纵坐标(),求出各药剂的生物活性回归方程和相关系数(2)及50。
2 结果与分析
2.1 室内杀菌剂生物活性测定
2.1.1 11种杀菌剂对甘蔗鞭黑粉菌单倍体孢子生长的抑制作用 根据甘蔗鞭黑粉菌单倍体菌株Ss17不同时间的600值绘制的生长曲线,确定病菌在36 h后进入生长静止期,因此将菌株Ss17培养24 h时的600值作为各药剂对病菌单倍体孢子抑制作用的最终值。
生物活性测定结果表明,对甘蔗鞭黑粉菌单倍体生长抑制作用最佳的药剂是75%肟菌·戊唑醇水分散粒剂、42.4%唑醚·氟酰胺悬浮剂、325 g/L苯甲·嘧菌酯悬浮剂和250 g/L吡唑醚菌酯乳油,EC50分别为0.0378、0.0314、0.0177、0.0790 μg/mL。其次是60%唑醚·代森联水分散粒剂、450 g/L咪鲜胺水乳剂、19%啶氧·丙环唑悬浮剂、250 g/L丙环唑乳油和250 g/L苯醚甲环唑乳油,EC50分别为2.9054、3.7488、1.8020、1.1158、2.3315 μg/mL。对甘蔗鞭黑粉菌单倍体生长抑制效果最差的药剂是62.5%精甲·咯菌腈悬浮剂和43%氟菌·肟菌酯悬浮剂,EC50分别为1049.8000 μg/mL和968.4800 μg/mL(表1)。
2.1.2 11种杀菌剂对甘蔗鞭黑粉菌有性配合的抑制作用 测试结果表明(图1),对照中甘蔗鞭黑粉菌进行有性配合产生白色绒毛状菌落(图1A)。与对照相比,11种杀菌剂中除了60%唑醚·代森联水分散粒剂(图1E)和43%氟菌·肟菌酯悬浮剂(图1D)对甘蔗鞭黑粉菌有性配合抑制效果稍差外(这2种杀菌剂分别在稀释倍数为105和104时,甘蔗鞭黑粉菌有进行有性配合产生白色菌落),其他杀菌剂对甘蔗鞭黑粉菌的有性配合抑制效果均表现较好(表2)。
2.1.3 11种杀菌剂对甘蔗鞭黑粉菌冬孢子萌发的抑制作用 生物活性测定结果表明,对甘蔗鞭黑粉菌冬孢子萌发抑制效果最佳的杀菌剂是75%肟菌·戊唑醇水分散粒剂、42.4%唑醚·氟酰胺悬浮剂、325 g/L苯甲·嘧菌酯悬浮剂、250 g/L吡唑醚菌酯乳油、43%氟菌·肟菌酯悬浮剂和19%啶氧·丙环唑悬浮剂,EC50分别为0.0224、0.0259、0.0199、0.0298、0.0318、0.0417 μg/mL。其次是60%唑醚·代森联水分散粒剂、450 g/L咪鲜胺水乳剂和62.5%精甲·咯菌腈悬浮剂,50分别为4.0769、34.9240、63.4090 μg/mL。对甘蔗鞭黑粉菌冬孢子萌发抑制效果最差的药剂是250 g/L苯醚甲环唑乳油和250 g/L丙环唑乳油,50分别为124.3700 μg/mL和235.6600 μg/mL(表3)。
表1 11种杀菌剂对甘蔗鞭黑粉菌单倍体孢子生长的抑制效果

Tab.1 Inhibition effect of 11 fungicides on the growth of haploid spores of S. scitamineum
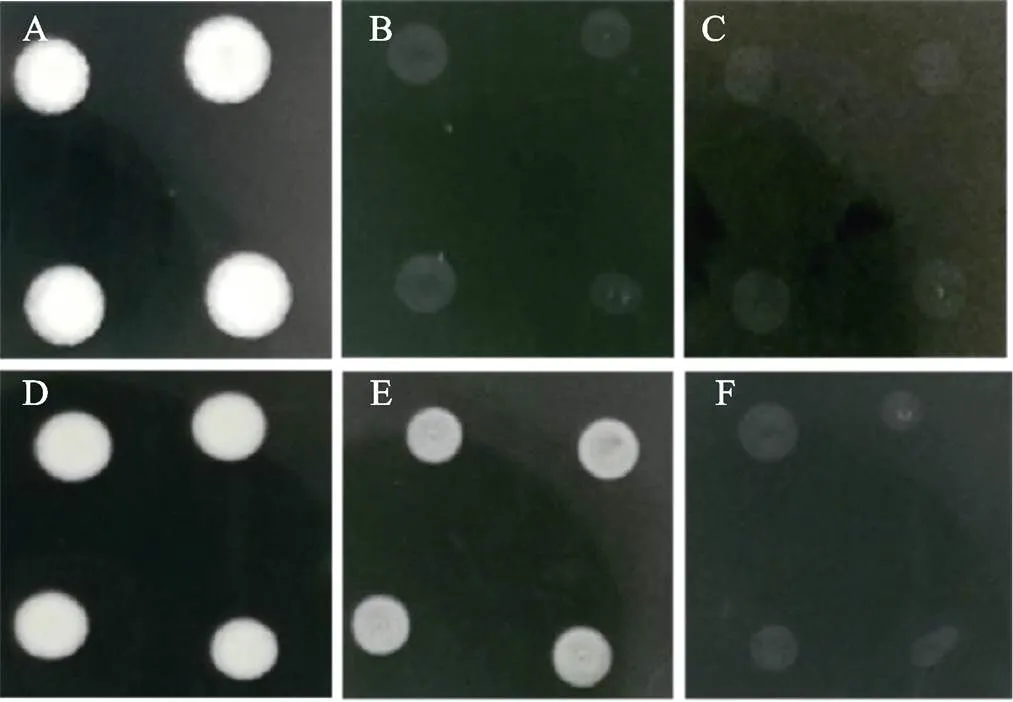
A:CK;B:75%肟菌·戊唑醇水分散粒剂;C:42.4%唑醚·氟酰胺悬浮剂;D:43%氟菌·肟菌酯悬浮剂;E:60%唑醚·代森联水分散粒剂;F:325 g/L苯甲·嘧菌酯悬浮剂。
综合分析,供试的11种杀菌剂中对甘蔗鞭黑粉菌单倍体生长、有性配合、冬孢子萌发均有抑制作用的药剂是75%肟菌·戊唑醇水分散粒剂、42.4%唑醚·氟酰胺悬浮剂、325 g/L苯甲·嘧菌酯悬浮剂和250 g/L吡唑醚菌酯乳油。因此,以这4种杀菌剂作为研究杀菌剂对甘蔗鞭黑粉菌作用机理的供试药剂。
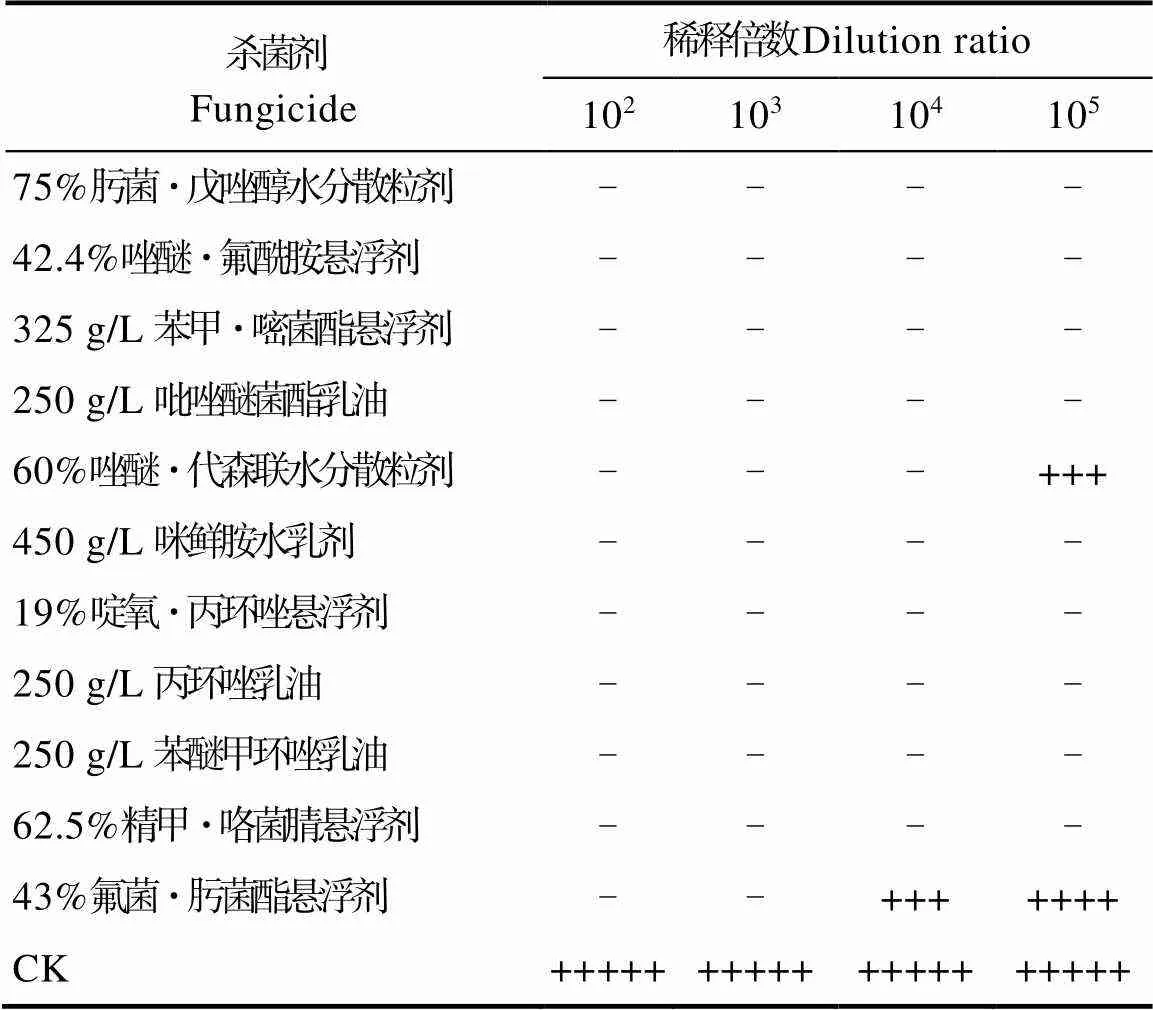
表2 11种杀菌剂对甘蔗鞭黑粉菌有性配合的抑制效果
注:-表示不能进行有性配合,+表示有性配合,分为5等级。
Note: - means sexual mating cannot be carried out, and + means sexual mating, which is divided into five levels.
2.2 药剂对甘蔗鞭黑粉菌作用的电镜扫描分析
为了分析以上4种杀菌剂对甘蔗鞭黑粉菌的作用机理,本研究选择稀释1000倍液的杀菌剂分别处理甘蔗鞭黑粉菌的单倍体菌体和冬孢子,浸泡30 min后转接入电镜固定液FAA,然后进行电镜扫描。结果表明,对照中的甘蔗鞭黑粉菌单倍体孢子呈短棍棒型或者雪茄型,表面比较光滑(图2A)。甘蔗鞭黑粉菌单倍体菌体经杀菌剂75%肟菌·戊唑醇水分散粒剂处理后,孢子组织硬化,易碎,孢子内含物暴露(图2B)。经杀菌剂42.4%唑醚·氟酰胺悬浮剂处理后,甘蔗鞭黑粉菌单倍体孢子表面形成孔洞凹陷,部分单倍体孢子变得干瘪(图2C)。甘蔗鞭黑粉菌单倍体菌体经325 g/L苯甲·嘧菌酯悬浮剂处理后,孢子组织呈腐烂状(图2D)。而甘蔗鞭黑粉菌单倍体菌体经250 g/L吡唑醚菌酯乳油处理后,孢子畸形,表面组织呈硬化状(图2E)。

表3 11种杀菌剂对甘蔗鞭黑粉菌冬孢子萌发的抑制效果

A:CK;B:75%肟菌·戊唑醇水分散粒剂;C:42.4%唑醚·氟酰胺悬浮剂;D:325 g/L苯甲·嘧菌酯悬浮剂;E:250 g/L吡唑醚菌酯乳油。
对照中冬孢子呈球体形状,表面有乳钉状突起(图3A)。甘蔗鞭黑粉菌冬孢子分别经杀菌剂75%肟菌·戊唑醇水分散粒剂、42.4%唑醚·氟酰胺悬浮剂和250 g/L吡唑醚菌酯乳油处理后,冬孢子均呈碎裂、内含物暴露状态(图3B、图3C、图3E)。而甘蔗鞭黑粉菌冬孢子经325 g/L苯甲·嘧菌酯悬浮剂处理后,冬孢子碎裂,部分冬孢子呈严重凹陷状态(图3D)。

A:CK;B:75%肟菌·戊唑醇水分散粒剂;C:42.4%唑醚·氟酰胺悬浮剂;D:325 g/L苯甲·嘧菌酯悬浮剂;E:250 g/L吡唑醚菌酯乳油。
2.3 杀菌剂大田防治效果
2.3.1 新植蔗黑穗病防治 新植甘蔗杀菌剂防治试验结果表明,各杀菌剂对甘蔗黑穗病有很好的防治效果,甘蔗浸泡杀菌剂播种120 d后,甘蔗黑穗病平均发病率在2.44%以下,而对照区的平均发病率为7.79%,供试杀菌剂的防治效果依次为42.4%唑醚·氟酰胺悬浮剂(92.87%)>75%肟菌·戊唑醇水分散粒剂(83.45%)>250 g/L吡唑醚菌酯乳油(83.35%)>325 g/L苯甲·嘧菌酯悬浮剂(71.68%)。甘蔗播种240 d后,杀菌剂处理区的甘蔗黑穗病平均发病率在3.75%以下,而对照区的平均发病率为11.46%,42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油、325 g/L苯甲·嘧菌酯悬浮剂防治效果分别为91.81%、82.84%、81.76%、70.92%,防效最好的杀菌剂为42.4%唑醚·氟酰胺悬浮剂,与325 g/L苯甲·嘧菌酯悬浮剂相比,达到显著差异(<0.05)(表4)。
通过研究杀菌剂防治甘蔗黑穗病对新植甘蔗农艺性状的影响,结果表明,杀菌剂处理区甘蔗的株高、茎径、锤度、每公顷有效茎数、单茎重、产量等农艺形状方面均比对照优,杀菌剂42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油、325 g/L苯甲·嘧菌酯悬浮剂处理的产量分别为100.35、97.35、96.30、94.20 t/hm2,而对照的产量为83.10 t/hm2,与对照相比,各处理均达差异显著,产量分别增加20.84%、17.13%、15.92%、13.35%。表现最好的是42.4%唑醚·氟酰胺悬浮剂,该杀菌剂处理后的甘蔗株高、茎径、每公顷有效茎数、单茎重等农艺性状与对照比均达差异显著,其次是75%肟菌·戊唑醇水分散粒剂和250 g/L吡唑醚菌酯乳油,处理后的甘蔗产量、株高、公顷有效茎数等农艺性状与对照之间均达差异显著(表5)。

表4 不同杀菌剂对新植蔗黑穗病的防治效果
注:同列不同小写字母表示差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference (<0.05).

表5 不同药剂防治甘蔗黑穗病对新植蔗农艺性状的影响
注:同列不同小写字母表示差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference (<0.05).
2.3.2 宿根蔗黑穗病防治 宿根蔗防效试验表明,甘蔗出苗120 d后,不施药对照区的甘蔗黑穗病平均发病率为11.04%,杀菌剂325 g/L苯甲·嘧菌酯悬浮剂处理的甘蔗黑穗病平均发病率最高(3.25%),防治效果为70.74%;而42.4%唑醚·氟酰胺悬浮剂处理的发病率最低,平均发病率仅为0.91%,防治效果达91.75%。甘蔗出苗240 d后,各杀菌剂对甘蔗黑穗病仍保持很好的防治效果,对照区的平均发病率为17.83%,各杀菌剂处理的平均发病率在4.38%以下,42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油、325 g/L苯甲·嘧菌酯悬浮剂的防治效果分别为89.35%、82.21%、81.51%、70.18%,其中,42.4%唑醚·氟酰胺悬浮剂对甘蔗黑穗病的防治效果最佳,与325 g/L苯甲·嘧菌酯悬浮剂相比,达到显著水平(表6)。
通过研究杀菌剂防治甘蔗黑穗病对宿根甘蔗农艺性状的影响,结果表明,各杀菌剂处理的甘蔗主要农艺形状均优于对照,42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油、325 g/L苯甲·嘧菌酯悬浮剂处理的宿根蔗产量分别为75.90、72.30、70.05、67.95 t/hm2,而对照仅58.20 t/hm2,产量分别增加30.15%,24.05%、20.33%、16.58%。42.4%唑醚·氟酰胺悬浮剂处理的表现最好,其产量与其他处理之间达差异显著,每公顷有效茎数与250 g/L吡唑醚菌酯乳油、325 g/L苯甲·嘧菌酯悬浮剂处理之间达差异显著,茎径和单茎重与对照比达差异显著;其次是75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油和325 g/L苯甲·嘧菌酯悬浮剂,这3个处理的每公顷有效茎数与对照相比,均达差异显著(表7)。

表6 不同杀菌剂对宿根蔗黑穗病的防治效果
注:同列不同小写字母表示差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference (<0.05).
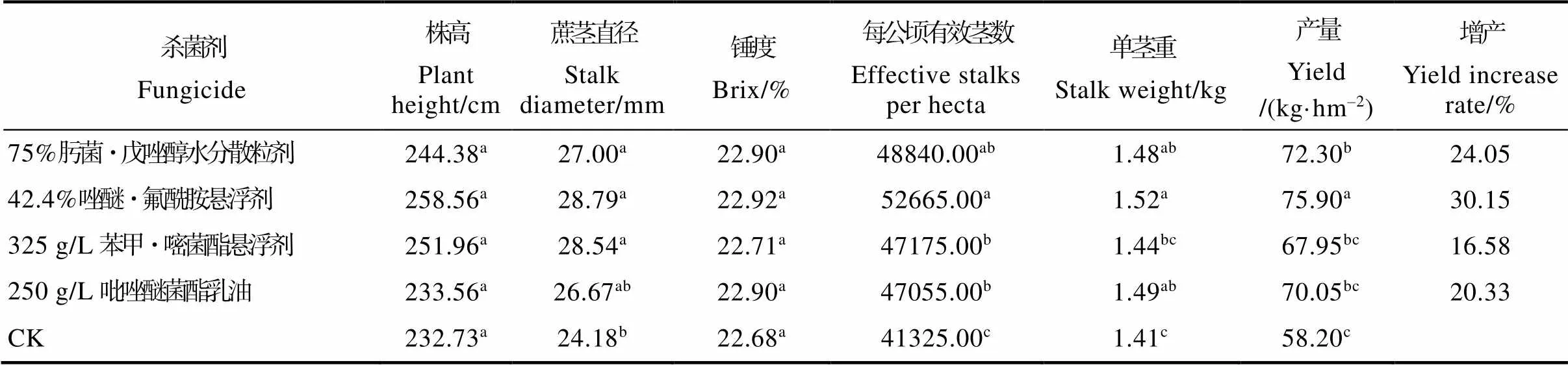
表7 不同药剂防治甘蔗黑穗病对宿根蔗农艺性状的影响
注:同列不同小写字母表示差异显著(<0.05)。
Note: Different lowercase letters in the same column indicate significant difference (<0.05).
2.4 各药剂对甘蔗的安全性
在大田试验期间,各药剂处理对甘蔗苗、植株和叶片的生长无影响,未发现药害现象,说明各药剂在推荐使用剂量下对甘蔗安全。
3 讨论
甘蔗鞭黑粉菌具有其他黑粉菌相似的生活史,即冬孢子萌发产生不同性系的单倍体孢子,单倍体菌体酵母状,不具侵染力;不同性系的单倍体孢子通过有性配合形成具有致病力的双核菌丝体,菌丝体可以在人工培养基上培养,菌落白色,但不能进一步发展;菌丝体侵染甘蔗,形成由冬孢子构成的黑穗鞭状物完成其生活史[3]。甘蔗鞭黑粉菌生活史中存在的3个靶向,即3个阶段:单倍体孢子的生长、“+”“-”单倍体孢子的有性配合、冬孢子的萌发,有学者建议针对甘蔗鞭黑粉菌的3个靶向进行生防菌、杀菌剂、化学物质等的筛选[2, 14]。JAYAKUMAR等[6]、李菲等[9]、江蕾等[8]、李小群等[10]分别从甘蔗组织和海洋微生物中筛选出抑制甘蔗鞭黑粉菌菌丝生长的生防菌。生物表面活性剂鼠李糖脂可抑制甘蔗鞭黑粉菌的冬孢子萌发和单倍体孢子的生长[11];而霉酚酸(mycophenolic acid)可同时抑制甘蔗鞭黑粉菌的3个靶向,小区试验也取得一定的防治效果[12]。吴伟怀等[13]针对甘蔗鞭黑粉菌的冬孢子萌发进行化学药剂筛选。而朱桂宁等[14]则针对甘蔗鞭黑粉菌生活史中的3个靶向进行室内生物活性测定获得8种高效、低毒低残留化学农药。本研究也是针对甘蔗鞭黑粉菌的3个靶向进行室内药剂筛选,获得4种对甘蔗鞭黑粉菌单倍体生长、有性配合、冬孢子萌发均有抑制作用的杀菌剂,其中杀菌剂250 g/L吡唑醚菌酯乳油和325 g/L苯甲·嘧菌酯悬浮剂对甘蔗鞭黑粉菌的抑制效果与朱桂宁等[14]的结果一致。
本研究通过室内生物活性测定获得了4种对甘蔗鞭黑粉菌具有有效抑制作用的杀菌剂,分别为42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油和325 g/L苯甲·嘧菌酯悬浮剂,大田防治甘蔗黑穗病取得了很好的防治效果。新植甘蔗播种240 d后,42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油、325 g/L苯甲·嘧菌酯悬浮剂的防治效果分别为91.81%、82.84%、81.76%、70.92%。甘蔗宿根防效试验表明,甘蔗出苗240 d后,42.4%唑醚·氟酰胺悬浮剂、75%肟菌·戊唑醇水分散粒剂、250 g/L吡唑醚菌酯乳油、325 g/L苯甲·嘧菌酯悬浮剂的防治效果分别为89.35%、82.21%、81.51%、70.18%,其中42.4%唑醚·氟酰胺悬浮剂的防治效果最佳。这4种杀菌剂均属于广谱杀菌剂,具有保护、渗透和治疗作用,目前已在水稻、玉米、果树、蔬菜等多种作物上广泛应用,对于炭疽病[15-19]、玉米大小斑病[20-21]、霜霉病[22]、灰霉病[23-24]、白粉病[25-26]、香蕉叶斑病[27]、稻瘟病[28]、纹枯病[29]等多种病害具有很好的防治效果。
另外,这4种杀菌剂对作物还有促进生长或增产的作用,据报道,42.4%唑醚·氟酰胺悬浮剂对马铃薯黑痣病防治效果好,该药剂处理后马铃薯株高优于对照,比对照增产33.54%[30]。75%肟菌·戊唑醇水分散粒剂对玉米大斑病和灰斑病具有较好的防治效果,千粒重和产量显著高于对照[21],该杀菌剂在水稻稻瘟病防治和增产方面也有很好的效果[28]。在西瓜生育期喷施250 g/L吡唑醚菌酯乳油,可提高西瓜的坐果率、产量和品质[31]。325 g/L苯甲·嘧菌酯悬浮剂对花生叶斑病具有较好的防治效果,药剂处理的花生荚果和籽仁产量均比对照显著提高[32]。本研究的4种杀菌剂对甘蔗有促生长的作用,进而提高甘蔗产量。在新植蔗中分别施用4种杀菌剂,各药剂处理与对照相比,甘蔗的株高、茎粗、每公顷有效茎数、单茎重和产量均有提高,其中42.4%唑醚·氟酰胺悬浮剂和75%肟菌·戊唑醇水分散粒剂的效果最好,与对照之间达差异显著,产量分别提高了20.84%和17.13%。另外2种杀菌剂处理的甘蔗株高、每公顷有效茎数和产量等均有所提高,与对照之间也达显著水平。宿根蔗试验中,4种杀菌剂处理的甘蔗茎粗、每公顷有效茎数、单茎重和产量等均高于对照,其中42.4%唑醚·氟酰胺悬浮剂和75%肟菌·戊唑醇水分散粒剂处理的表现最好,与对照达差异显著,产量分别提高了30.15%和24.05%。然而,从研究结果中发现,在新植蔗和宿根蔗中,4种杀菌剂的施用对甘蔗锤度的影响均差异不显著。
关于本研究所测试的4种杀菌剂对真菌的作用机理鲜有报道,为了解这4种杀菌剂对甘蔗鞭黑粉菌的作用方式,采用杀菌剂分别处理甘蔗鞭黑粉菌的单倍体菌体和冬孢子,然后进行电镜扫描。结果表明,这4种杀菌剂对甘蔗鞭黑粉菌的冬孢子和单倍体孢子组织造成不同程度的物理破坏。同时,还将经药剂处理后的甘蔗鞭黑粉菌的冬孢子和单倍体孢子接种至YePSA培养基上在28℃下培养,7 d后未见冬孢子萌发和单倍体菌落形成,推测杀菌剂通过破坏冬孢子和单倍体孢子细胞组织进而杀死病原菌,而不是仅抑制甘蔗鞭黑粉菌的生长或者冬孢子萌发。甘蔗鞭黑粉菌单倍体孢子失活,有性配合就无法进行,从而达到阻断该病害发生的目的。同一杀菌剂对不同真菌的作用机理可能因真菌种类而异,据报道,杀菌剂dodine对真菌和存在不同的作用机理,杀菌剂dodine通过破坏真菌质膜(PM)和线粒体,从而杀死。然而,杀菌剂dodine仅通过抑制的线粒体腺苷三磷酸(ATP)合成而杀死真菌[33]。本研究的4种药剂对甘蔗鞭黑粉菌的作用分子机理值得进一步研究,可为筛选和设计靶标更准确的防治药剂提供科学依据。
[1] YAN M X, ZHU G N, LIN S Y, XIAN X Y, CHANG C Q, XI P G, SHEN W K, HUANG W H, CAI E P, JIANG Z D, DENG Y Z, ZHANG L H. The mating-type locusof the sugarcane smutis essential for mating, filamentous growth and pathogenicity[J]. Fungal Genetics & Biology, 2015, 86: 1-8.
[2] 韦金菊, 宋修鹏, 魏春燕, 张小秋, 黄伟华, 颜梅新. 甘蔗黑穗病及其防治研究进展[J]. 广东农业科学, 2019, 46(4): 87-94.
WEI J J, SONG X P, WEI C Y, ZHANG X Q, HUANG W H, YAN M X. Research progress on sugarcane smut and its control[J]. Guangdong Agricultural Sciences, 2019, 46(4): 81-88. (in Chinese)
[3] YAN M X, CAI E P, ZHOU J N, CHANG C Q, XI P G, SHEN W K, LI L Y, JIANG Z D, DENG Y Z, ZHANG L H. A dual-color imaging system for sugarcane smut fungus[J]. Plant Disease, 2016, 100(12): 2357-2362.
[4] SINHA O K, SINGH K. Antagonistic activity ofvar.against sugarcane smut[J]. Indian Phytopathology, 1983, 36(1): 92-94.
[5] 廖咏梅, 张桂英, 黄定安, 覃蔓萍, 姚普远. 甘蔗黑穗病菌拮抗细菌的筛选及鉴定[J]. 广西农业生物科学, 2004, 23(3): 197-201.
LIAO Y M, ZHANG G Y, HUANG D A, QIN M P, YAO P Y. Screening and identification of antagonistic bacteria of[J]. Genomics and Applied Biology, 2004, 23(3): 197-201. (in Chinese)
[6] JAYAKUMAR V, SUNDAR A R, VISWANATHAN R. Biological suppression of sugarcane smut with endophytic bacteria[J]. Sugar Tech, 2019, 21(4): 653-660.
[7] LIU S Y, LIN N Q, CHEN Y M, LIANG Z B, LIAO L S, LV M F, CHEN Y F, TANG Y X, HE F, CHEN S H, ZHOU J N, ZHANG L H. Biocontrol of sugarcane smut disease by interference of fungal sexual mating and hyphal growth using a bacterial isolate[J]. Frontiers in Microbiology, 2017, 8: 778.
[8] 江 蕾, 李 菲, 李 智, 易湘茜, 邓家刚, 周 桂, 高程海. 海黄瓜共附生细菌多样性及其对甘蔗鞭黑粉菌的抑制作用[J]. 南方农业学报, 2018, 49(3): 488-494.
JIANG L, LI F, LI Z, YI X Q, DENG J G, ZHOU G, GAO C H. Diversity of symbiotic bacteria isolated fromand its antifungal activity against[J]. Journal of Southern Agriculture, 2018, 49(3): 488-494. (in Chinese)
[9] 李 菲, 黄庶识, 王 伟, 江 蕾, 米顺利, 余 炼. 海绵sp.共栖细菌多样性及其抑制甘蔗鞭黑粉菌活性研究[J]. 广西科学, 2018, 25(1): 87-93, 99.
LI F, HUANG S S, WANG W, JIANG L, MI S L, YU L. Diversity of sponge -derived bacteria isolated fromsp. against[J]. Guangxi Sciences, 2018, 25(1): 87-93, 99. (in Chinese)
[10] 李小群, 于清武, 易湘茜, 郝二伟, 马 亮, 颜栋美, 高程海. 广西北仑河口红树林底泥放线菌多样性及其抑制甘蔗鞭黑粉菌活性分析[J]. 南方农业学报, 2018, 9(4): 708-713.
LI X Q, YU Q W, YI X Q, HAO E W, MA L, YAN D M, GAO C H. Diversity of actinomycetes isolated from bottom mud of mangrove forest in Beilun Estuary of Guangxi and its antibacterial activity against[J]. Journal of Southern Agriculture, 2018, 9(4): 708-713. (in Chinese)
[11] 王 蕾, 毛玉玲, 许汉亮, 李继虎, 林明江, 胡玉伟, 毛永凯, 管楚雄. 生物表面活性剂鼠李糖脂对甘蔗黑穗病菌的体外抗菌活性[J]. 微生物学通报, 2019, 46(6): 1356-1363.
WANG L, MAO Y L, XU H L, LI J H, LIN M J, HU Y W, MAO Y K, GUAN C X.antifungal activity of biosurfactant rhamnolipids against sugarcane smut caused by[J]. Microbiology China, 2019, 46(6):1356-1363. (in Chinese)
[12] ZHONG Y, YAN M X, JIANG J Y, ZHANG Z H, HUANG J J, ZHANG L H, DENG Y Y,ZHOU X F, HE F. Mycophenolic acid as a promising fungal dimorphism inhibitor to control sugarcane disease caused by[J]. Journal of Agricultur and Food Chemistry, 2019, 67: 112-119.
[13] 吴伟怀, 谢祖健, 贺春萍, 郑肖兰, 李 锐, 郑服丛. 甘蔗黑穗病菌冬孢子生物学特性及杀菌剂对其萌发的影响[J]. 热带作物学报, 2009, 30(11): 1674-1678.
WU W H, XIE Z J, HE C P, ZHENG X L, LI R, ZHENG F C. Biological characteristics of teliospores ofand virulence of 2 fungicides against them indoor[J]. Chinese Journal of Tropical Crops, 30(11): 1674-1678. (in Chinese)
[14] 朱桂宁, 林珊宇, 贤小勇, 颜梅新, 黄福新, 秦碧霞. 8种杀菌剂对甘蔗黑穗病菌的室内毒力测定[J]. 南方农业学报, 2014, 45(6): 989-994.
ZHU G N, LIN S Y, XIAN X Y, YAN M X, HUANG F X, QIN B X. Bioactivities of eight fungicides against[J]. Journal of Southern Agriculture, 2014, 45(6): 989-994. (in Chinese)
[15] 朱桂宁, 林珊宇, 贤小勇, 颜梅新, 黄福新, 秦碧霞. 5种杀菌剂对甘蔗黑穗病的防控试验[J]. 南方农业学报, 2014, 45(8): 1393-1397.
ZHU G N, LIN S Y, XIAN X Y, YAN M X, HUANG F X, QIN B X. Field control test of 5 fungicides to sugarcane smut[J]. Journal of Southern Agriculture, 2014, 45(8): 1393-1397. (in Chinese)
[16] MARQUES J P R, HOY J W, APPEZZATO-DA-GLOIA B, VIVEROS A F G, VIEIRA M L C, BAISAKH N. Sugarcane cell wall-associated defense responses to infection by[J]. Frontiers in Plant Science, 2018, 9: 698.
[17] 谭荣荣, 周国珍, 毛迎新, 刘明炎, 李银姣. 250 g/L吡唑醚菌酯悬浮剂防治茶树炭疽病试验[J]. 湖北植保, 2015(2): 9-10.
TAN R R, ZHOU G Z, MAO Y X, LIU M Y, LI Y J. Control test of anthracnose disease in tea with 250 g/L pyraclostrobin EC[J]. Hubei Plant Protection, 2015(2): 9-10. (in Chinese)
[18] 李中华, 刘晓婷, 杨建宏, 刘 岩, 薛鸿宝, 张红杰. 75%肟菌·戊唑醇水分散粒剂防治黄瓜炭疽病药效试验[J]. 河北农业, 2016, 253(4): 36-38.
LI Z H, LIU X T, YANG J H, LIU Y, XUE H B, ZHANG H J. Control test of anthracnose disease in cucumber with 75% tebuconazole·trifloxystrobin WG[J]. Hebei Agriculture, 2016, 253(4): 36-38. (in Chinese)
[19] 沈小英, 刘暮莲, 苏兰少, 王 清. 32.5%苯醚甲环唑·嘧菌酯悬浮剂防治西瓜炭疽病田间药效试验初报[J]. 广西植保, 2019(3): 16-18.
SHEN X Y, LIU M L, SU L S, WANG Q. Preliminary report effect of 32.5% difenoconazole·azoxystrobin SC against anthracnose disease of watermelon in field[J]. Guangxi Plant Protection, 2019(3): 16-18. (in Chinese)
[20] 任传军. 防治玉米大斑病药剂筛选试验[J]. 现代化农业, 2015(4): 14-15.
REN C J. Screening of fungicides for controlling northern leaf blight of maize[J]. Modernizing Agriculture, 2015(4): 14-15. (in Chinese)
[21] 向礼波, 龚双军, 史文琦, 喻大昭, 刘传兵, 田祚旭. 75%肟菌·戊唑醇水分散粒剂对玉米大斑病和灰斑病的防治效果[J]. 植物保护, 2016(4): 248-252.
XIANG L B, GONG S J, SHI W Q, YU D Z, LIU C B, TIAN Z X. Control effect of 75% trifloxystrobin·tebuconazole WG against northern leaf blight and gray leaf spot of maize[J]. Plant Protection, 2016(4): 248-252. (in Chinese)
[22] 曲健禄, 范 昆, 付 丽, 陶吉寒. 11种杀菌剂防治葡萄霜霉病的田间药效评价[J]. 落叶果树, 2016, 48(6): 42-44.
QU J L, FAN K, FU L, TAO J H. Field effect evaluation of 11 fungicides against grape downy mildew[J]. Deciduous Fruits, 2016, 48(6): 42-44. (in Chinese)
[23] 周小军, 徐小芳, 朱丽燕, 何晓婵, 王 轶, 陈桂华. 7种药剂防治葡萄灰霉病的效果[J]. 浙江农业科学, 2018, 59(9): 1559-1560.
ZHOU X J, XU X F, ZHU L Y, HE X C, WANG Y, CHEN G H. Control effect of 7 fungicides on grape gray mold[J]. Journal of Zhejiang Agricultural Sciences, 2018, 59(9): 1559-1560. (in Chinese)
[24] 周晓肖, 江景勇, 邱莉萍, 杨肖芳, 李伟龙. 5种药剂防治草莓灰霉病试验[J]. 浙江农业科学, 2018, 59(10): 1865- 1867.
ZHOU X X, JIANG J Y, QIU L P, YANG X F, LI W L. Control effect of 5fungicides on strawberry gray mold[J]. Journal of Zhejiang Agricultural Sciences, 2018, 59(10): 1865-1867. (in Chinese)
[25] 吴燕君, 王政逸, 洪文英. 瓜白粉病重发期高效药剂的选择及控制技术探讨[J]. 浙江农业科学, 2016, 57(12): 2060-2063.
WU Y J, WANG Z Y, HONG W Y. Study on selection and control technology of high efficiency agents in the serious period of melon powdery mildew[J]. Journal of Zhejiang Agricultural Sciences, 2016, 57(12): 2060-2063. (in Chinese)
[26] 苏玉琴. 75%肟菌酯·戊唑醇水分散粒剂对黄瓜白粉病的田间防效[J]. 农业科技与信息, 2019(1): 23-27.
SU Y Q. Field control effect of 75% trifloxystrobin·tebuconazole WG against cucumber powdery mildew[J]. Agricultural Science-Technology and Information, 2019(1): 23-27. (in Chinese)
[27] 潘连富, 付 岗, 张 晋, 杨 迪,杜婵娟. 75%肟菌·戊唑醇水分散粒剂对香蕉叶斑病的防治效果[J]. 中国南方果树, 2018, 47(6): 52-54.
PAN L F, FU G, ZHANG J, YANG D, DU C J. Control effect of 75% trifloxystrobin·tebuconazole WG against banana leaf spot[J]. South China Fruits, 2018, 47(6): 52-54. (in Chinese)
[28] 张学江, 向礼波, 杨立军. 75%戊唑醇·肟菌酯水分散粒剂防治水稻稻瘟病效果[J]. 湖北植保, 2017(5): 5-6.
ZHANG X J, XIANG L B, YANG L J. Control effect of 75% trifloxystrobin·tebuconazole WG against rice blast[J]. Hubei plant protection, 2017(5): 5-6. (in Chinese)
[29] 沈国强, 黄东峰, 江 涛. 325 g/L苯甲·嘧菌酯悬浮剂防治水稻纹枯病田间试验效果初探[J]. 上海农业科技, 2015(6): 129, 122.
SHEN G Q, HUANG D F, JIANG T. Preliminary study on the effect of 325 g/L difenoconazole·azoxystrobin SC on controlling rice sheath blight[J]. Shanghai Agricultural Science and Technology, 2015(6): 129, 122. (in Chinese)
[30] 刘小娟, 安建华, 莫 娟, 孙兴明, 王文慧, 魏周全, 杨 扬. 5种杀菌剂对马铃薯黑痣病的田间防效试验[J]. 中国马铃薯, 2019, 33(3): 170-174.
LIU X J, AN J H, MO J, SUN X M, WANG W H, WEI Z Q, YANG Y. Control effect of five fungicides on potato black scurf[J]. Chinese Potato Journal, 2019, 33(3): 170-174. (in Chinese)
[31] 温仙明. 吡唑醚菌酯乳油调节西瓜生长研究[J]. 福建农业科技, 2009(3): 58-59.
WEN X M. Study on regulation of watermelon growth by pyraclostrobin EC[J]. Fujian Agricultural Science and Technology, 2009(3): 58-59. (in Chinese)
[32] 邓 丽, 殷君华, 李 阳, 谷建中, 任 丽, 张 博. 32.5%苯甲·嘧菌酯悬浮剂对花生叶斑病的防效[J]. 安徽农业科学, 2017, 45(17): 136-137, 147.
DENG L, YIN J H, LI Y, GU J Z, REN L, ZHANG B. Control effect of 32.5% benzoyl-azoxystrobin SC on peanut leaf spot disease[J]. Journal of Anhui Agricultural Sciences, 2017, 45(17): 136-137, 147. (in Chinese)
[33] SCHUSTER M, STEINBERG G. The fungicide dodine primarily inhibits mitochondrial respiration in, but also affects plasma membrane integrity and endocytosis, which is not found in[J]. Fungal Genetics and Biology, 2020, 142: 103414.
Screening of Fungicides for Sugarcane Smut and Yield Evaluation
YAN Meixin1, ZHANG Xiaoqiu1, WANG Zeping1, LEI Jingchao1, HUANG Hairong1, HUANG Weihua2, CHEN Xiaohang3, QIN Xingyun4, HUANG Hai4, HUANG Dongmei1, LI Qiufang1, SONG Xiupeng1*
1. Sugarcane Research Institute, Guangxi Academy of Agricultural Sciences / Sugarcane Research Center, Chinese Academy of Agricultural Sciences / Ministry of Agriculture and Rural Affairs, Guangxi Key Laboratory of Sugarcane Genetic Improvement / Key Laboratory of Sugarcane Biotechnology and Genetic Improvement (Guangxi), Nanning, Guangxi 530007, China; 2. Biotechnology Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530003, China; 3. Baise Agricultural Scientific Research Institute / Baise Branch of Guangxi Academy of Agricultural Sciences / Baise Comprehensive Experiment Stations of National Sugarcane Industry Technology System, Baise, Guangxi 533612; 4. Laibin Golden Phoenix Agricultural Investment Co., LTD, Laibin, Guangxi 546100, China
Sugarcane smut caused byis the most harmful disease during sugarcane growth period in China, which causes serious yield and economic losses to sugarcane industry. Chemical control is one of the important measures for the comprehensive control of the diseases. It is of great significance for the effective control of sugarcane smut and improving sugarcane yield by screening high-efficiency, low toxicity and low residue chemicals against sugarcane smut in the field. In order to recommend fungicides for the chemical control of sugarcane smut in the field, the inhibitory effect of 11 fungicides onwas tested by the bioactivities assay. The antifungal mechanism of effective fungicides was analyzed by scanning electron microscope. The control effect of fungicides to sugarcane smut and the effects on the main agronomic characters of sugarcane including yield per hecta, plant height, stalk diameter, brix, effective stalks per hecta and stalk weight were evaluated through chemical control tests of sugarcane smut for new plant cane and ratoon cane in the field. The results showed that four fungicides were obtained by bioactivities assay to inhibit the haploid growth, sexual mating and teliospores germination of, which were 42.4% pyraclostrobin·fluxapyroxad SC, 75% tebuconazole·trifloxystrobin WG, 250 g/L pyraclostrobin EC and 325 g/L difenoconazole·azoxystrobin SC. Scanning electron microscopy assay showed that the four effective fungicides destroyed cell tissues of teliospores and haploid conidia ofand caused inactivated sugarcane smut fungus. In the chemical control experiment of sugarcane smut for plant cane in the field, the control effects of fungicide 42.4% pyraclostrobin·fluxapyroxad SC, 75% tebuconazole·trifloxystrobin WG, 250 g/L pyraclostrobin EC and 325 g/L difenoconazole·azoxystrobin SC was 91.81%, 82.84%, 81.76% and 70.92%, respectively. The yield in chemical treatment area increased by 20.84%, 17.13%, 15.92% and 13.35%, respectively, compared with the control. In the experiment of chemical control of sugarcane smut for ratoon crop, the control effects of the above fungicides was 89.35%, 82.21%, 81.51% and 70.18%, respectively, and the yield in chemical treatment area increased by 30.15%, 24.05%, 20.33% and 16.58%, respectively, compared with the control. Other agronomic characters of sugarcane for new plant and ratoon cane in sugarcane smut chemical treatment area were better than those in the control area. The four tested fungicides had good control effect on sugarcane smut and increasing sugarcane yield. They can be used as recommended fungicides for chemical controlling sugarcane smut in the field.
sugarcane; smut; fungicides; control; yield evaluation
S435.661
A
10.3969/j.issn.1000-2561.2022.07.021
2021-12-13;
2022-02-28
国家重点研发计划项目(No. 2019YFD1000503);国家自然科学基金项目(No. 31960521);中国科学院科技服务网络计划(STS计划)(No. KFJ-STS-QYZD-199-2)。
颜梅新(1978—),男,博士,副研究员,研究方向:甘蔗病虫害防控、抗病育种及推广。*通信作者(Corresponding author):宋修鹏(SONG Xiupeng),E-mail:xiupengsong@163.com。
