外源NO对低温胁迫下‘胭脂茄’种子萌发及幼苗生理特性的影响
2022-08-06陈瑶瑶严良文刘智成郑作芸陈萍萍
陈瑶瑶,严良文,刘智成,郑作芸,余 洁,陈萍萍,江 巍
外源NO对低温胁迫下‘胭脂茄’种子萌发及幼苗生理特性的影响
陈瑶瑶1,严良文1,刘智成1,郑作芸1,余 洁2,陈萍萍1,江 巍1
1. 龙岩市农业科学研究所,福建龙岩 364000;2. 龙岩市新罗区农业局,福建龙岩 364000
以闽西地方茄子品种‘胭脂茄’种子和幼苗为试材,用不同浓度SNP(0、0.1、0.2、0.3、0.4、0.5、1.0、1.5 mmol/L)浸种6 h,分别在28℃和4℃暗培养处理3 d后转入培养箱进行常规培养萌发,统计各处理的发芽指标;对胭脂茄幼苗叶面喷施不同浓度SNP(0、0.1、0.3、0.5、0.8、1.0、1.2、1.5 mmol/L)预处理3 d后,于10℃/5℃下进行低温胁迫,通过测定幼苗的株高、茎粗、鲜重、干重及叶片中超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性,可溶性蛋白和脯氨酸含量以及丙二醛(MDA)含量,研究低温胁迫下外源一氧化氮(NO)预处理后对种子萌发、幼苗生长及相关生理生化特征的影响。结果表明,外源NO供体SNP预处理后,胭脂茄种子的发芽率、发芽势、发芽指数和活力指数的变化趋势均随着SNP浓度的升高呈先增加后减少变化,SNP浓度为0.2 mmol/L时,种子萌发各指标达到最大,SNP浓度超过0.5 mmol/L时各指标降低;施加低浓度(0.1~1.0 mmol/L)SNP预处理能够增加胭脂茄幼苗株高、茎粗、鲜重和干重,可以增加幼苗叶片中可溶性蛋白和脯氨酸含量、提高超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性,降低幼苗叶片中MDA累积,SNP浓度为0.5 mmol/L时CAT活性最高,其余各项指标以SNP浓度为0.8 mmol/L时达到最佳,高浓度SNP对各项指标产生抑制作用。研究结果表明低温胁迫下低浓度SNP预处理后可有效保护胭脂茄种子萌发和幼苗生长,浓度过高反而造成伤害。本研究结果为合理使用外源NO促进胭脂茄种子萌发和幼苗生长提供理论依据,为闽西地区有效防御茄子低温冷害提供应用价值。
外源NO;低温胁迫;胭脂茄;种子萌发;生理特性
龙岩地处福建西部,境内山地丘陵广布,地形复杂,各地海拔落差大,这种独特垂直分布的立体气候特征形成了许多各具特色的地方蔬菜品种。‘胭脂茄’是茄子(L.)优良地方品种,在闽西地区栽培历史悠久,深受当地人民的喜爱,在市场上的售价高于其他一般茄子。近年来‘胭脂茄’在龙岩当地的栽培面积不断扩大且多为露地栽培,播种期大都在12月至翌年1月,故在冬、春季生产时常遭遇连续低温寒潮而造成冷害。尤其是2016年和2020年的低温寒潮,给闽西地区‘胭脂茄’造成了严重损失,农户栽培的胭脂茄生产也因低温而严重减产。因此,寻找出抵御低温的方法对于保护当地蔬菜资源类型,推动地方蔬菜品种资源的有效保护及可持续利用有着十分重要的现实意义。
化学调控是提高植物抗逆性的有效措施,通过施用外源物质来改善作物的生理特性,将节约不少人力和物力。一氧化氮(NO)在植物中是一种重要的信号分子,参与调节植物的多种生理过程和对逆境胁迫应答反应。外源应用NO在植物抗低温胁迫生理等方面已有少量研究。外源应用NO在蔬菜抵抗低温胁迫上发挥着积极的作用,但是最佳适用浓度会因植物基因型不同存在较大的差异。张文博等[1]以‘津研4号’黄瓜幼苗为试验材料,认为低温胁迫下持续0.2 mmol/L外源NO供体SNP处理能提高黄瓜幼苗的耐受性。徐洪雷等[2]在‘山东密刺’黄瓜上施用0.5 mmol/L和1.0 mmol/L SNP,发现能有效提高幼苗对低温胁迫的适应性。于秀针等[3]以番茄‘里格尔87-5’幼苗为材料,认为喷施1.0 mmol/L的SNP显著缓解了低温对幼苗造成的损伤。张永吉等[4]在番茄‘苏粉14’幼苗上喷施0.2 mmol/L SNP发现能有效减轻低温胁迫带来的不利影响。ESIM等[5]以玉米品种cv. Arifiye为材料,认为低温胁迫下0.1 µmol/L SNP处理能缓解幼苗遭受的伤害,王芳等[6]以玉米品种‘郑单958’为材料认为0.10 mmol/L SNP能提高玉米幼苗的耐受性。因此,深入开展外源NO抗逆境作用生理调节机制等研究,对外源NO的产业化开发和利用具有重要的意义。
种子发芽和植物苗期生长发育中的低温现象是影响植物生产力的主要因素之一[7]。本研究通过实验室模拟低温胁迫,主要探索不同浓度SNP预处理后,胭脂茄种子的各项发芽指标,同时通过试验,进一步研究不同浓度SNP处理对低温胁迫下幼苗生理生化的影响,以期了解低温逆境下外源NO在促进胭脂茄种子发芽及幼苗生长生理方面的作用,为合理使用外源NO促进胭脂茄种子萌发和幼苗生长提供理论依据和技术指导,为闽西地区有效防御茄子低温冷害提供应用价值。
1 材料与方法
1.1 材料
1.1.1 种子发芽试验 本试验以外源NO供体SNP作为处理试剂。挑选籽粒大小均匀一致且无病斑的胭脂茄种子为试验材料,在常温下进行不同浓度SNP浸种处理,6 h后放入培养箱中进行不同温度暗培养处理,共10个处理CK0:28℃常温+清水;CK1:28℃常温+0.2 mmol/L SNP;CK2:4℃低温+0 mmol/L SNP;T1:4℃低温+0.1 mmol/L SNP;T2:4℃低温+0.2 mmol/L SNP;T3:4℃低温+0.3 mmol/L SNP;T4:4℃低温+0.4 mmol/L SNP;T5:4℃低温+0.5 mmol/L SNP;T6:4℃低温+1.0 mmol/L SNP;T7:4℃低温+1.5 mmol/L SNP。每皿放100粒种子,3次重复。处理3 d,每日以处理溶液冲洗种子并以处理溶液补充蒸发的水分以维持处理溶液浓度不变。处理3 d后每个处理均转入培养箱进行常规催芽试验处理。NO供体硝普钠(sodium nitroprusside,SNP)购自福晨(天津)化学试剂有限公司,纯度大于99.0%。
1.1.2 幼苗生理生化试验 常规催芽播种后,待幼苗长至4~5片真叶时,每处理30株,挑选生长一致、健壮的植株进行叶面喷施不同浓度SNP的预处理,共设置8个处理。CK:0 mmol/L SNP;T1:0.1 mmol/L SNP;T2:0.3 mmol/L SNP;T3:0.5 mmol/L SNP;T4:0.8 mmol/L SNP;T5:1.0 mmol/L SNP;T6:1.2 mmol/L SNP;T7:1.5 mmol/L SNP。将准备好的液体均匀喷于胭脂茄的叶片至滴水为止,每天早晚喷施,连续3 d后置于光照培养箱(10℃/5℃)低温处理,低温处理72 h后取第二片功能叶测定相关指标。
1.2 方法
1.2.1 种子发芽指标测定 外源NO供体SNP作为处理试剂处理3 d后,恢复至常温28℃继续暗培养。连续记录7 d,每日以清水冲洗种子,记录种子发种子萌发各项指标。
发芽率=发芽种子数/供试种子数×100%;芽数(以胭脂茄的胚根突破种皮为标准),记录种子萌发(发芽标准:胚根突破种皮)情况。
发芽势=规定日期内发芽种子数/供试种子数×100%
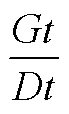
活力指数(VI)=S×Gi(S为幼苗胚根长)
1.2.2 幼苗生长及生理生化指标测定 每个处理随机选取5株,用蒸馏水冲洗干净,滤纸吸干表面水分,测定株高、茎粗和鲜重,然后再放入105℃下杀青20 min,后75℃烘干至恒重,称取干重。
可溶性蛋白含量、脯氨酸含量、超氧化物歧化酶(SOD)活性、过氧化物酶(POD)活性、过氧化氢酶(CAT)活性和丙二醛(MDA)含量的测定,采用苏州科铭生物技术有限公司生产的检测试剂盒,每个处理3次重复。
1.3 数据处理
试验数据采用SPSS 17.0软件进行方差分析和差异显著性分析(<0.05),使用WPS 2021软件绘制图表。
2 结果与分析
2.1 低温胁迫下SNP对胭脂茄种子萌发的影响
由表1可以看出,与常温对照(CK0)相比,低温胁迫下胭脂茄种子的各项指标均显著降低。与低温对照(CK2)相比,喷施0.1~0.3 mmol/L SNP预处理能显著提高胭脂茄种子的各项发芽指标,以SNP浓度为0.2 mmol/L T2处理的效果最好,种子的发芽率、发芽势、发芽指数和活力指数分别比CK2提高了8.05%、86.11%、48.02%和74.99%,T4处理在发芽率和活力指数上与CK2之间无显著差异,T5~T7处理的各项指标均显著低于CK2,且浓度越高下降越显著,T7处理各项指标均达到最低值,种子的发芽率、发芽势、发芽指数和活力指数分别比CK2降低了74.71%、78.57%、74.88%和84.82%。这说明SNP对低温胁迫条件下胭脂茄种子的萌发具有一定的浓度效应。同时试验发现CK1(常温0.2 mmol/L SNP)处理对胭脂茄种子萌发效果与CK0相似。
表1 低温胁迫下不同浓度SNP对胭脂茄种子发芽的影响
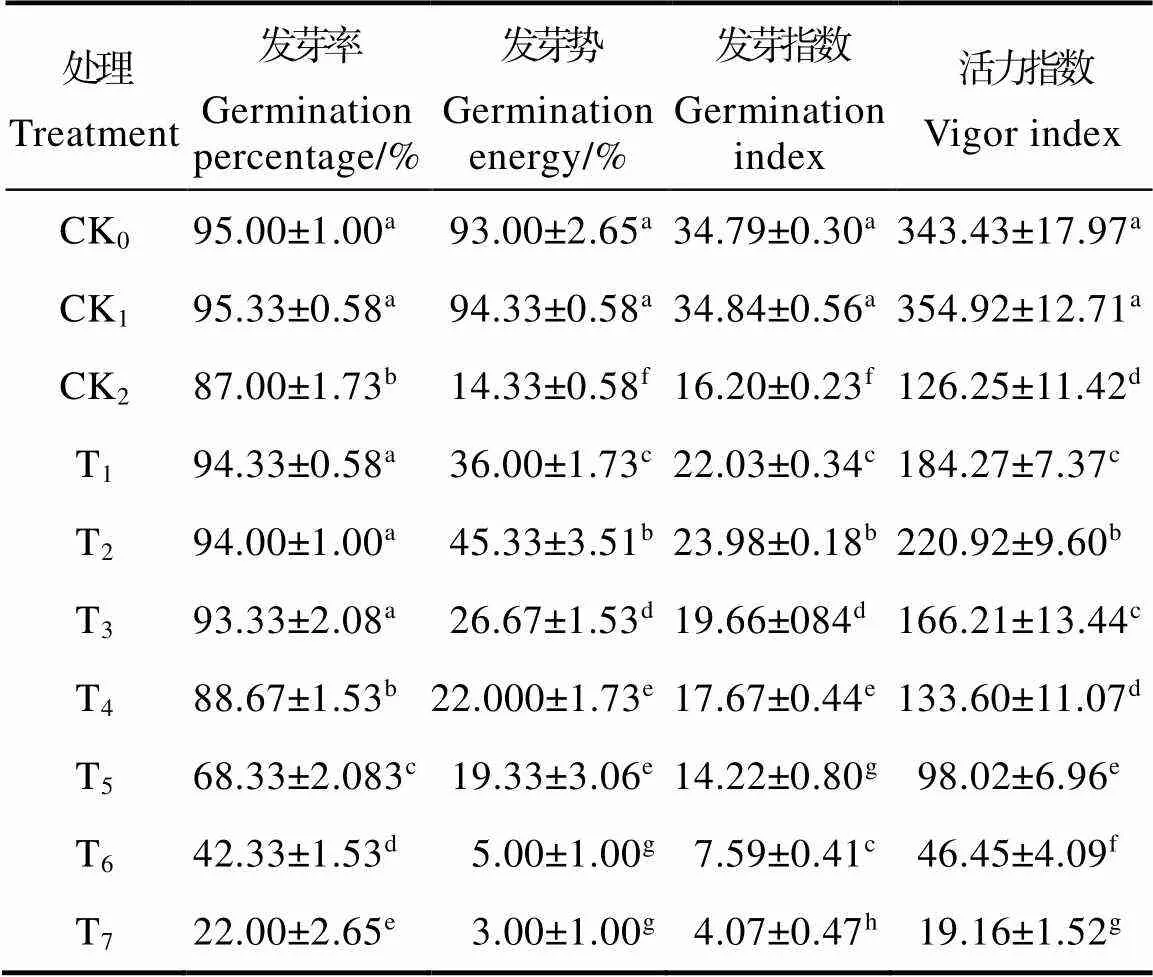
Tab.1 Effect of different concentrations of SNP on germination of S. melongena cv. Yanzhiqie seeds under low temperature stress
注:同列数据后不同小写字母表示处理间差异显著(<0.05)。
Note: Different lowercase letters after the same column of data indicate significant difference (<0.05).
2.2 外源NO对低温胁迫下胭脂茄幼苗生长的影响
由表2可以看出,与CK相比,施加低浓度(0.1~1.0)mmol/L SNP预处理能有效缓解低温胁迫对胭脂茄幼苗生长的抑制作用,增加生长量,然而不同浓度SNP处理对胭脂茄生长量积累的影响也有所不同。其中以T4处理效果最佳,株高、茎粗、鲜重和干重与CK相比显著提高了10.15%、7.32%、12.87%和27.50%;高浓度SNP预处理反而抑制了幼苗的生长,其中T7处理各项指标均显著低于CK。由此可知,低温胁迫影响胭脂茄幼苗的生长,不同浓度SNP处理对低温胁迫下幼苗的生长有明显的影响,具有一定的剂量效应。
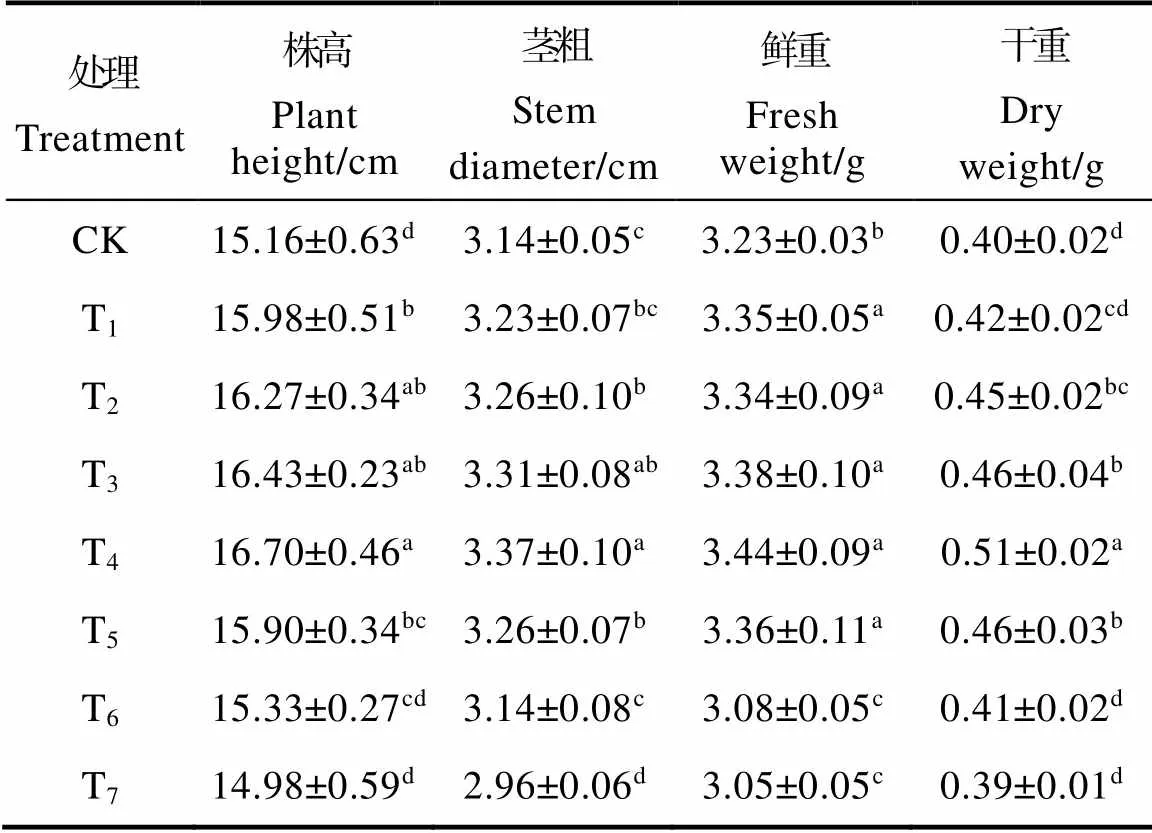
表2 低温胁迫下不同浓度SNP对胭脂茄幼苗生长的影响
注:同列数据后不同小写字母表示处理间差异显著(<0.05)。
Note: Different lowercase letters after the same column of data indicate significant difference (<0.05).
2.3 低温胁迫下SNP对胭脂茄幼苗可溶性蛋白含量的影响
如图1可知,随着SNP溶液预处理浓度的增加,胭脂茄幼苗叶片中可溶性蛋白含量变化趋势呈先增加后减少变化。与CK对比,T2~T5预处理后,可明显提高幼苗叶片中可溶性蛋白的含量,以T4预处理的效果最优,可溶性蛋白含量积累得最多,比CK提高了1.81倍。T6和T7预处理则对幼苗叶片中可溶性蛋白的积累产生了抑制,且处理浓度越大,抑制作用越强。T7预处理后幼苗叶片中可溶性蛋白含量达到最小,显著低于CK14.79%。
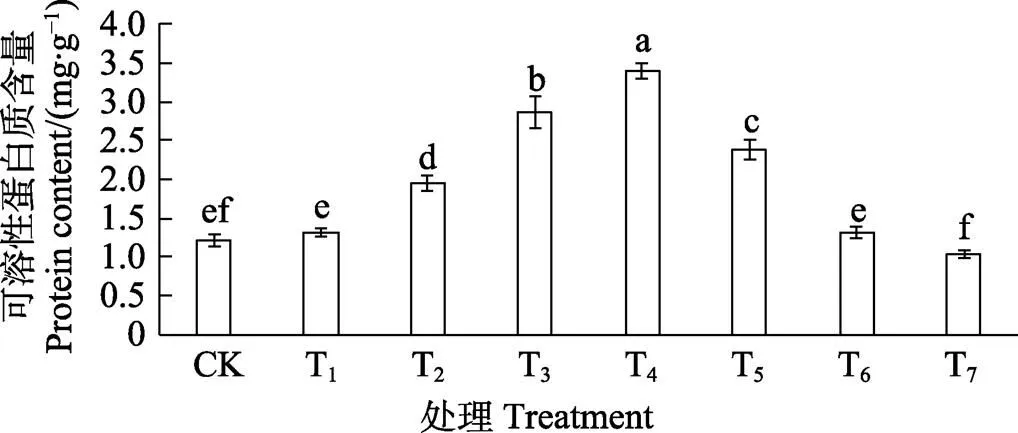
不同小写字母表示处理间差异显著(P<0.05)。
2.4 低温胁迫下SNP对胭脂茄幼苗脯氨酸含量的影响
如图2可知,T1~T5预处理可以提高胭脂茄幼苗叶片中脯氨酸含量,与CK相比,分别提高了25.87%、92.28%、2.66倍和1.30倍,T1处理与CK间无显著差异,T2~T5处理与对照间差异达到显著水平,其中以T4处理效果最佳。T6和T7处理则抑制了脯氨酸含量的增长,且随着浓度的增高,抑制作用增强。T7处理时幼苗叶片脯氨酸含量最低,比对照降低了11.89%,差异显著。
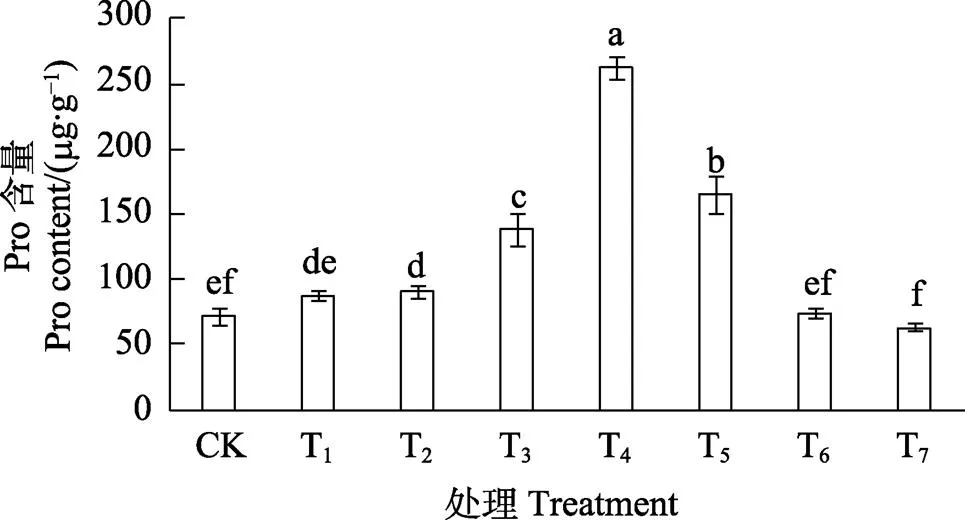
不同小写字母表示处理间差异显著(P<0.05)。
2.5 低温胁迫下SNP对胭脂茄幼苗MDA含量的影响
由图3可见,与CK对比,T1~T5预处理显著降低了幼苗叶片中MDA含量,其中以T4处理效果最好,MDA含量最低,比对照降低了62.36%。T6和T7预处理则显著增加了幼苗叶片中MDA含量,分别比CK增加了24.74%和49.52%,差异显著。表明低温胁迫下适量SNP预处理能有效减轻膜脂氧化的程度,过多反而加重了受伤害程度。
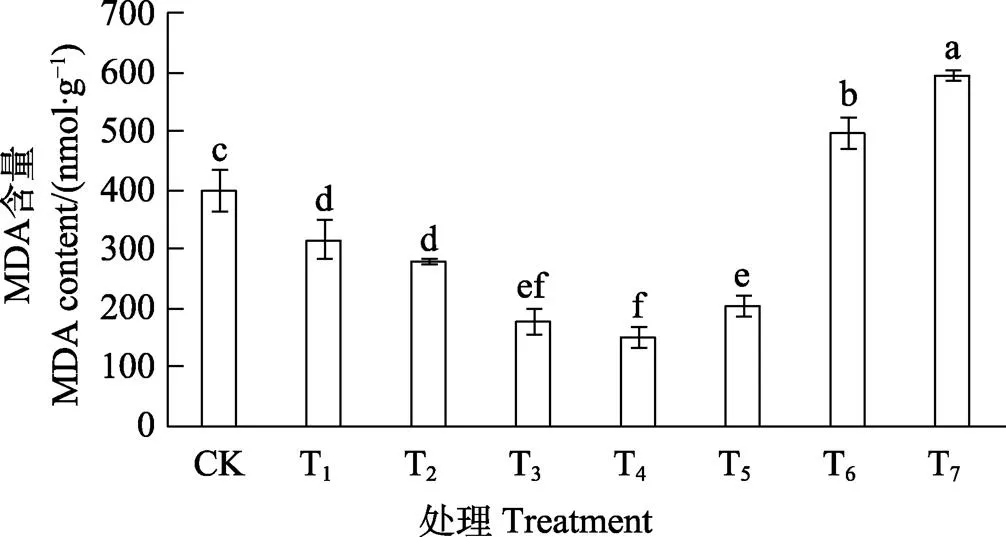
不同小写字母表示处理间差异显著(P<0.05)。
2.6 低温胁迫下SNP对胭脂茄幼苗抗氧化酶活性的影响
由图4A可知,T1~T5预处理后,胭脂茄幼苗叶片中SOD活性均高于CK,其中以T4预处理活性增强最多,较CK提高了1.00倍,差异显著。随着SNP浓度进一步升高,SOD活性下降,T6预处理SOD活性较CK减少6.25%,差异不显著;T7预处理则显著降低了幼苗叶片中SOD活性。如图4B看出,T1~T5预处理后,胭脂茄幼苗叶片中POD活性增强,T2~T5预处理与CK相比差异显著,其中以T4预处理的效果最好,较低温对照提高了1.50倍,随着SNP浓度进一步升高,POD活性下降,T7预处理显著降低了胭脂茄幼苗叶片中POD活性。如图4C可见,T1~T5预处理后胭脂茄幼苗叶片中CAT活性增加,与CK相比,T2~T5预处理差异显著,其中以T3预处理效果最好,较CK提高36.17%。随着SNP浓度进一步升高,CAT活性下降,但T6和T7预处理与对照间无明显差异。
3 讨论
植物的生命周期中,种子萌发是一个重要的进程[8],温度则是影响种子萌发的最主要因子[9]。本研究结果表明在低温胁迫下,胭脂茄种子的发芽率、发芽势和种子活力均显著降低,这与谢顺赞等[10]认为低温胁迫下茄子种子的活力显著降低,黄倩茹等[11]认为低温处理下苋菜发芽率较低,生长受到抑制的结果相似。NO参与了植物体内许多生理方面的调控。本研究发现施加0.1~ 0.4 mmol/L外源NO供体SNP能够减缓低温胁迫造成的伤害,改善胭脂茄种子活力,这与陈银萍等[12]在玉米,于秀针等[3]在番茄种子萌发的研究结果相似。NO对低温逆境下胭脂茄种子的萌发有一定的浓度效应。低浓度SNP可以促进萌发,而高浓度则产生相反的作用。同时本研究发现常温下低浓度SNP预处理后,胭脂茄种子的发芽率、发芽势和种子活力与常温清处理差异不大。因此,对于农户种植来说,播种前要注意天气的变化情况,尽量避免在低温或冷害天气出现时播种,如需播种可选择低浓度SNP预处理浸种,保障胭脂茄的出苗和壮苗率。
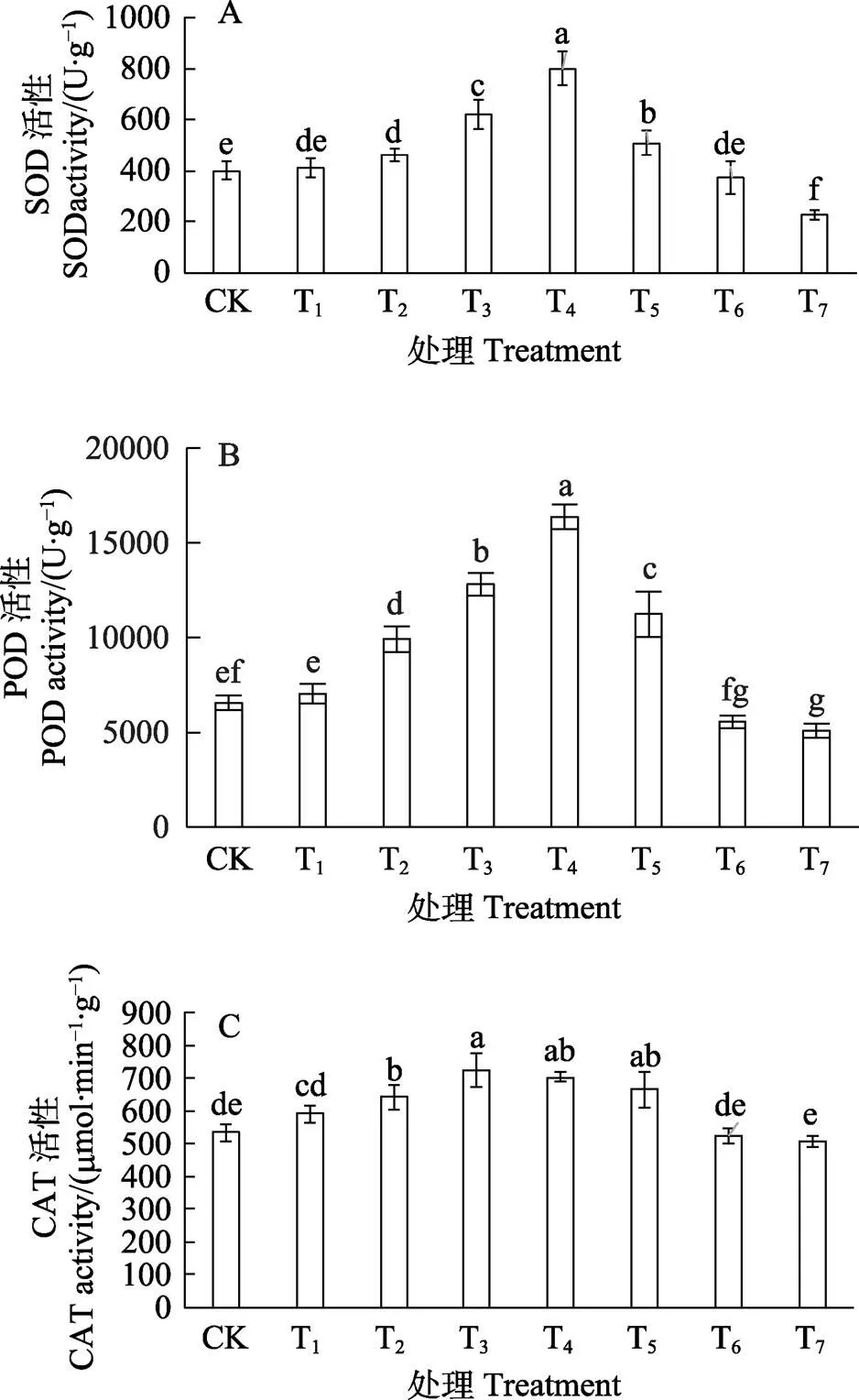
不同小写字母表示处理间差异显著(P<0.05)。
逆境下,植物形态学特征变化反映了植物生物量的变化。本研究发现低温胁迫下胭脂茄幼苗生长受到抑制,生物量积累下降,施加适宜低浓度(0.1~1.0 mmol/L)的外源NO显著缓解胁迫伤害,其中0.8 mmol/L预处理效果最优,幼苗株高、茎粗、鲜、干重值均超过了CK,表明适量的SNP处理能够有效增强植株的抗低温能力,促进幼苗的生长发育,更有利于胭脂茄壮苗培育。
植物细胞中可溶性蛋白含量的提高可以增强植株的耐寒性[13],脯氨酸是植物蛋白质的组分之一[14-15],在植物对抗逆境方面有着非常重要的作用[16-20]。本研究结果表明,低温胁迫下,低浓度的SNP预处理后,胭脂茄幼苗叶片中可溶性蛋白质和脯氨酸含量均显著高于CK,且SNP浓度为0.8 mmol/L时提高的最多。这与牟雪姣等[21]在蝴蝶兰,刘希元等[22]在辣椒上利用外源NO提高幼苗叶片可溶性蛋白和脯氨酸含量的结果相符。以上结果可以推断外源NO能有效提高植物体内加强保护性物质的累积。
现有研究普遍认为抗氧化酶活性与植物的抗寒性密切相关[23-27]。在所有的抗氧化酶中,SOD在清除活性氧方面起到至关重要的作用,SOD能够催化超氧阴离子自由基形成H2O2,增强植物的抗逆性,然后H2O2被POD和CAT所清除[28]。刘旭等[29]对‘秀娘’茄子和张永吉等[30]对‘改良扬茄’品种的研究发现,外源NO处理增强胁迫下幼苗叶片的SOD、POD和CAT活性,提高耐低温能力。本试验中,低温胁迫下0.1~1.0 mmol/L的SNP预处理,可以显著增强胭脂茄幼苗叶片中SOD、POD和CAT的活性,其中以0.8 mmol/L处理效果最明显,说明外源NO通过増强SOD、POD和CAT等抗氧化酶的活性促进了酶促系统的抗寒能力。
遭遇低温冷害后,植物体内MDA含量积累,造成植物膜脂过氧化伤害。因此,MDA含量高低常用作鉴别逆境伤害程度的指标之一[31]。本研究中低浓度SNP预处理通过降低胭脂茄叶片的MDA积累来缓解低温对幼苗的损伤,这与在黄瓜[1]幼苗上的研究结果相似。这可能是外源NO处理提高了抗氧化酶活性降低了H2O2含量和超氧阴离子的活性。
NO对植物的作用具有两重性。本试验结果表明,低温胁迫下低浓度SNP预处理后可有效保护胭脂茄种子萌发和幼苗生长,浓度过高反而造成伤害。这与王英姿等[32]在茶树幼苗,茹刚等在伏毛铁棒锤[33]和杜卓涛等在苦瓜幼苗的[34]研究结果相似。
4 结论
综上所述,外源NO能显著缓解低温胁迫对胭脂茄种子的伤害,促进萌发,显著增加幼苗生物量积累,降低幼苗叶片中MDA累积,增加可溶性蛋白和脯氨酸含量,提高SOD、POD和CAT活性,减缓低温胁迫对抗氧化酶防御系统的破坏,减轻胁迫引起的伤害。NO参与响应低温逆境胁迫,单一测定某一个或几个方面的生理指标,能正确反映其提高植物抗寒性的实质,下一步的研究工作需要把机理研究与田间试验相结合,通过自然条件下寒害的防御效果来制定应用方案,才能将外源NO切实应用到农业生产栽培中。
[1] 张文博, 杨志峰, 吴 佩, 赵明伟, 刘慧英, 崔金霞. 持续外源一氧化氮处理对黄瓜(L.)幼苗生长发育及耐冷性的影响[J]. 石河子大学学报(自然科学版), 2020, 38(5): 642-647.
ZHANG W B, YANG Z F, WU P, ZHAO M W, LIU H Y, CUI J X. Effects of continuous exogenous nitric oxide treatments on growth, development and cold tolerance of cucumber (L.) seedlings[J]. Journal of Shihezi University (Natural Science), 2020, 38(5): 642-647.
[2] 徐洪雷, 于广建. 一氧化氮(NO)对黄瓜低温胁迫的缓解作用[J]. 东北农业大学学报, 2007, 38(5): 606-608.
XU H L, YU G J. Alleviating effect of nitric oxide on cucumber seedling against low temperature stress[J]. Journal of Northeast Agricultural University, 2007, 38(5): 606-608.
[3] 于秀针, 张彩虹, 姜鲁艳.吐尔逊娜依·热依木江,马 艳,马彩霞. 外源NO对低温胁迫下番茄种子萌发和幼苗生长的影响[J]. 北方园艺, 2014(22): 5-8.
YU X Z, ZHANG C H, JIANG L Y, REYIMUJIANGT N, MA Y, MA C X. Effect of exogenous nitric oxide on tomato seed germination and growth of tomato seedling[J]. Northern Horticulture, 2014(22): 5-8.
[4] 张永吉, 祁建波, 张云虹, 苏 芃, 张永泰, 周如美, 张 瑛. 喷施外源NO对番茄幼苗抗低温胁迫的影响[J]. 扬州大学学报(农业与生命科学版), 2020, 41(4): 115-118.
ZHANG Y J, QI J B, ZHANG Y H, SU P, ZHANG Y T, ZHOU R M, ZHANG Y. Effects of exogenous NO spraying on low temperature stress resistance of tomato seedlings[J]. Journal of Yangzhou University (Agricultural and Life Science Edition), 2020, 41(4): 115-118.
[5] ESIM N, ATICI O. Nitric oxide improves chilling tolerance of maize by affecting apoplastic antioxidative enzymes in leaves[J]. Plant Growth Regulation, 2014, 72(1): 29-38.
[6] 王 芳, 李永生, 彭云玲, 王汉宁, 方永丰, 王 威. 外源一氧化氮对玉米幼苗抗低温胁迫的影响[J]. 干旱地区农业研究, 2017, 35(4): 270-275.
WANG F, LI Y S, PENG Y L, WANG H N, FANG Y F, WANG W. Effects of exogenous nitric oxide on low temperature stress of maize seedlings[J]. Agricultural Research in the Arid Areas, 2017, 35(4): 270-275.
[7] ABREU H M C D, NOBILE P M, SHIMIZU M M, YAMAMOTO P Y, MAZZAFERA PInfluenee of air temperature on proteinase activity and beverage quality in[J]. Brazilian Journal of Botany, 2012, 35(4): 357-376.
[8] 王丽燕. 硅对NaCl胁迫下野大豆种子萌发的影响[J]. 大豆科学, 2010, 29(5): 906-908.
WANG L Y. Effects of exogenous silicon on germination of glycine soja under salt stress[J]. Soybean Science, 2010, 29(5): 906-908.
[9] 闫兴富, 曹 敏. 光照和温度对望天树种子萌发的影响[J]. 植物学通报, 2006, 23(6): 642-650.
YAN X F, CAO M. Influence of light and temperature on the germination of(Dipterocarpaceae) seeds[J]. Chinese Bulletin of Botany, 2006, 23(6): 642-650.
[10] 谢顺赞, 卢永奋, 马春梅. 低温胁迫对茄种子萌发的影响[J]. 长江蔬菜, 2009(20): 43-44.
XIE S Z, LU Y F, MA C M. Effect of low temperature on seed germinating in eggplant[J]. Journal of Changjiang Vegetables, 2009(20): 43-44.
[11] 黄倩茹, 张爱冬, 查丁石, 吴雪霞, 孔令娟, 李建勇. 不同温度处理对苋菜种子萌发和幼苗生长的影响[J]. 长江蔬菜, 2021(16): 13-15.
HUANG Q R, ZHANG A D, ZHA D S, WU X X, KONG L J, LI J Y. Effects of different temperature treatments on amaranth seed germination and seedling growth[J]. Journal of Changjiang Vegetables, 2021(16): 13-15.
[12] 陈银萍, 王晓梅, 杨宗娟, 于 飞, 思显佩. NO对低温胁迫下玉米种子萌发及幼苗生理特性的影响[J]. 农业环境科学学报, 2012, 31(2): 270-277.
CHEN Y P, WANG X M, YANG Z J, YU F, SI X P. Effects of nitric oxide on seed germination and physiological reaction of maize seedlings under low temperature stress[J]. Journal of Agro-Environment Science, 2012, 31(2): 270-277.
[13] 马文涛, 樊卫国. 贵州野生柑橘的抗寒性测定和综合评价[J]. 西北植物学报, 2014, 34(10): 2063-2069.
MA W T, FAN W G. Determination and comprehensive evaluation on cold-tolerance of wild citrus from Guizhou[J]. Acta Botanica Boreali-Occidentalia Sinica, 2014, 34(10): 2063-2069 .
[14] 吴广霞, 杨德光, 唐献龙, 席景会. 植物低温胁迫生理研究进展[J]. 作物杂志, 2008(3): 17-19.
WU G X, YANG D G, TANG X L, XI J H. Research progress on physiology of plant cold hardiness[J]. Crops, 2008(3): 17-19.
[15] 蒋明义, 郭绍川, 张学明. OH胁迫下稻苗体内脯氨酸积累及其抗氧化作用[J]. 科学通报, 1997, 42(6): 646-649.
JIANG M Y, GUO S C, ZHANG X M. Proline accumulation and antioxidant effect in rice seedlings under OH stress[J]. Chinese Science Bulletin, 1997, 42(6): 646-649.
[16] YANG S L, CHEN K, WANG S S, GONG M. Osmoregulation as a key factor in drought hardening-induced drought tolerance in[J]. Biologia Plantarum, 2015, 59: 529-536.
[17] JIANG M Y, GUO S C, ZHANG X M. Proline accumulation in rice seedlings exposed to hydroxyl radical stress in relation to antioxidation[J]. Chinese Science Bulletin, 1997, 42: 855-859.
[18] GIBERTI S, FUNCK D, FORLANI G. Δ1 -pyrroline-5- carboxylate reductase from: stimulation or inhibition by chloride ions and feedback regulation by proline depend on whether NADPH or NADH acts as co-substrate[J]. New Phytologist, 2014, 202(3): 911-919.
[19] SZABADOS L, SAVOURÉ A. Proline: a multifunctional amino acid[J]. Trends in Plant Science, 2010, 15: 89-97.
[20] 王翠平, 严 莉, 乔改霞, 李 健. 脯氨酸通过活性氧信号抑制植物生长[J]. 植物生理学报, 2017, 53(9): 1788-1794.
WANG C P, YAN L, QIAO G X, LI J. Proline inhibits plant growth by reactive oxygen species signaling[J]. Plant Physiology Communications, 2017, 53(9): 1788-1794.
[21] 牟雪姣, 刘理想, 孟鹏鹏, 金克炳. 外源NO缓解蝴蝶兰低温胁迫伤害的生理机制研究[J]. 西北植物学报, 2015, 35(5): 978-984.
MOU X J, LIU L X, MENG P P, JING K B. Physiological mechanism of exogenous nitric oxide on alleviating low temperature stress ofspp.[J]. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(5): 978-984.
[22] 刘希元, 吴春燕, 张广臣, 杨 璐, 梁 超. 喷施外源NO对缓解辣椒幼苗低温伤害的机理研究[J]. 西北农林科技大学学报(自然科学版), 2020, 48(11): 63-70.
LIU X Y, WU C Y, ZHANG G C, YANG L, LIANG C. Mechanisms of spraying external nitric oxide to alleviate injury of pepper seedlings caused by low temperature[J]. Journal of Northwest A & F University(Natural Science Edition), 2020, 48(11): 63-70.
[23] HOSSAIN Z, NOURI M Z, KOMATSU S. Plant cell organelle proteomics in response to abiotic stress[J]. Journal of Proteome, 2012, 11(1): 37-48.
[24] 李超汉, 张 琳, 史庆华, 李青竹, 郭晓青, 李 霞, 于贤昌. GMPase超表达对番茄植株抗坏血酸含量及耐冷性相关生理指标的影响[J]. 园艺学报, 2011, 38(4): 692-700.
LI C H, ZHANG L, SHI Q H, LI Q Z, GUO X Q, LI X, YU X C. Effects of GMPase overexpression on ascorbic acid content and relative index to low-temperature tolerance in tomato plants[J]. Acta Horticulturae Sinica, 2011, 38(4): 692-700.
[25] 肖春燕. 低温胁迫下NO调控黄瓜幼苗光合碳同化机理研究[D]. 新疆: 石河子大学, 2014.
XIAO C Y. Regulation of nitric oxide on photosynthetic carbon assimilation mechanism in cucumber seedlings under low temperature stress[D]. Xinjiang: Shihezi University, 2014.
[26] 赵 悦, 赵艳艳, 黄 霞, 罗周塔叶, 马云婷. 夜间低温胁迫对番茄抗氧化酶活性的影响[J]. 青海大学学报(自然科学版), 2021, 39(3): 34-40.
ZHAO Y, ZHAO Y Y, HUANG X, LUOZHOU T Y, MA Y T. Effects of low temperature stress at night on the antioxidant enzyme activities ofMill[J]. Journal of Qinghai University, 2021, 39(3): 34-40.
[27] 张永平, 姚雪琴, 杨少军, 许 爽, 陈幼源. 低温胁迫及恢复对厚皮甜瓜光合作用和抗氧化特性的影响[J]. 上海农业学报, 2017, 33(1): 41-49.
ZHANG Y P, YAO X Q, YANG S J, XU S, CHEN Y Y. Effects of low temperature treatment and recovery on the photosynthesis and antioxidanteharacteristics in melon seedlings[J]. Acta Agriculturae Shanghai, 2017, 33(1): 41-49.
[28] JALEEL C A, RIADH K, GOPI R, MANIVANNAN P, INÈS J, AI-JUBURI H J, ZHAO C X, SHAO H B, PANNEERSELVAM R. Antioxidant defense responses: physiological plasticity in higher plants under abiotic constraints[J]. Acta Physiol Plant, 2009, 31:427-436
[29] 刘 旭, 林碧英, 吴宏琪, 李小琼, 祖颖达, 钟路明, 王爱红. 外源NO对低温胁迫下茄子幼苗生长及生理特性的影响[J]. 西南农业学报, 2020, 33(12): 2760-2765.
LIU X, LIN B Y, WU H Q, LI X Q, ZU Y D, ZHONG L M, WANG A H. Effects of exogenous no on growth and physiological characteristics of eggplant seedlings under low temperature stress[J]. Southwest China Journal of Agricultural Sciences, 2020, 33(12): 2760-2765.
[30] 张永吉, 苏 芃, 祁建波, 张 瑛, 张永泰, 陈以博, 李子恒, 张云虹. 外源一氧化氮对低温胁迫下茄子幼苗抗性的影响[J]. 植物生理学报, 2020, 56(1): 66-72.
ZHANG Y J, SU P, QI J B, ZHANG Y, ZHANG Y T, CHEN Y B, LI Z H, ZHANG Y H. Effects of exogenous nitric oxide on the resistance of eggplant seedlings to low temperature stress[J]. Plant Physiology Journal, 2020, 56(1): 66-72.
[31] 马德华, 孙其信. 温度逆境对不同品种黄瓜幼苗膜保护系统的影响[J]. 西北植物学报, 2001, 21(4): 656-661.
MA D H, SUN Q X. Effects of temperature stress on membrane protective system of cucumber seedlings[J]. Acta Botanica Boreali-Occidentalia Sinica, 2001, 21(4): 656-661.
[32] 王英姿, 李银花, 陈金华, 刘仲华, 黄建安. 外源一氧化氮对低温胁迫下茶树幼苗生理特性的影响[J]. 茶叶科学, 2019, 39(3): 335-341.
WANG Y Z, LI Y H, CHEN J H, LIU Z H, HUANG J A. Effects of exogenous nitric oxide on physiological characterist-ics of tea plants under cold stress[J]. Journal of Tea Science, 2019, 39(3): 335-341.
[33] 茹 刚, 陈学林, 于文惠, 张桃桃. 外源NO对低温胁迫下伏毛铁棒锤种子萌发及幼苗生理特性的影响[J]. 西北农林科技大学学报(自然科学版), 2021, 49(2): 137-144, 154.
RU G, CHEN X L, YU W H, ZHANG T T. Effects of exogenous NO on seed germination and seedling physiological characteristics ofHand.-Mazz under low temperature stress[J]. Journal of Northwest A & F University(Nat.Sci.Ed.), 2021, 49(2): 137-144, 154.
[34] 杜卓涛, 商 桑, 朱白婢, 田丽波, 杨 衍. 外源NO对低温胁迫下苦瓜幼苗生长和几个生理指标的影响[J]. 热带作物学报, 2016, 37(3): 482-48.
DU Z T, SHANG S, ZHU B B, TIAN L B, YANG Y. Effects of exogenous no on plant growth and physiological characteristics inL. seedlings under low temperature stress[J]. Chinese Journal of Tropical Crops, 2016, 37(3): 482-48.
Effect of Exogenous NO on the Germination of Eggplant (cv. Yanzhiqie) Seeds and the Physiological Characteristics of Seedlings under Low Temperature Stress
CHEN Yaoyao1, YAN Liangwen1, LIU Zhicheng1, ZHENG Zuoyun1, YU Jie2, CHEN Pingping1, JIANG Wei1
1. Longyan Institute of Agricultural Sciences, Longyan, Fujian 364000, China; 2. Agriculture Bureau of Xinluo District, Longyan, Fujian 364000, China
Seeds and seedlings ofcv. Yanzhiqie, a local eggplant cultivar in western Fujian, were soaked with different concentrations of (0, 0.1, 0.2, 0.3, 0.4, 0.5, 1.0, 1.5 mmol/L) for 6 hours, respectively cultured in dark at 28℃ and 4℃ for 3 days and then transferred to an incubator for conventional culture and germination, and the germination indicators of each treatment were statistically analyzed. The leaves ofcv. Yanzhiqie seedlings were pretreated with different concentrations of SNP (0, 0.1, 0.3, 0.5, 0.8, 1.0, 1.2, 1.5 mmol/L) for 3 days and subjected to low temperature stress at 10℃ / 5℃. The effects of exogenous nitric oxide (NO) pretreatment on the germination of seeds, and growth and related physiological and biochemical characteristics of seedlings were studied by determining plant height, stem diameter, fresh weight, and dry weight of seedlings, activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT), and contents of soluble protein, proline, and malondialdehyde (MDA) in leaves. The germination percentage, germination energy, germination index and vigor index ofcv. Yanzhiqie seeds increased firstly and then decreased with the increase of SNP (an exogenous NO donor) concentration, and all indicators of seed germination reached the maximum at 0.2 mmol/L, and decreased at > 0.5 mmol/L.Pretreatment with low concentration (0.1–1.0 mmol/L) of SNP could increase plant height, stem diameter, fresh weight and dry weight ofcv. Yanzhiqie seedlings, increase the contents of soluble protein and proline in leaves, improve the activities of superoxide dismutase (SOD), peroxidase (POD), and catalase (CAT), and decrease MDA accumulation in leaves, The CAT activity was the highest at 0.5 mmol/L, and other indicators were optimal at 0.8 mmol/L. High concentration of SNP inhibited all indicators. The above suggests that pretreatment with low concentration of SNP could effectively promote the germination ofcv. Yanzhiqie seeds and growth of seedlings under low temperature stress, while high concentration cause damage. The results of this study would provide a theoretical basis for the proper use of exogenous NO to promote the germination ofcv. Yanzhiqie seeds and the growth of seedlings, and are of reference value for effectively protecting eggplants from low temperature damage in western Fujian.
exogenous NO; low temperature stress;cv. Yanzhiqie; seed germination; physiological characteristics
S641.1
A
10.3969/j.issn.1000-2561.2022.07.019
2021-12-21;
2022-01-29
龙岩市科技项目(No. 2019LYF12011);福建省2020年个人科技特派员项目(No. 2020080421);福建省2021年个人科技特派员项目(No. 202135080180)。
陈瑶瑶(1983—),女,硕士,助理研究员,研究方向:蔬菜生理与栽培。E-mail:huanan_1983@163.com。
