肾上腺皮质癌13例临床病理特征及预后分析
2022-08-06张昕婷陈余朋
张昕婷,陈余朋,罗 胜,张 声,陈 虹
肾上腺皮质癌(adrenal cortial carcinoma, ACC)临床较罕见,发病率较低[1],其恶性程度高,侵袭性强,进展迅速,预后差。本文旨在分析ACC的临床病理特点及Weiss评分,采用免疫组化检测ACC中PD-1、PD-L1的表达,分析其临床病理特征、诊断、鉴别诊断及与预后的相关性,为ACC的免疫治疗提供参考。
1 材料与方法
1.1 材料收集2011年1月~2021年7月福建医科大学附属第一医院病理科诊断的13例ACC标本,其中男性10例(77%),女性3例(23%),年龄4~74岁,平均(48.77±18.12)岁。所有病例均经两位高年资病理医师重新阅片明确诊断。
1.2 方法
1.2.1HE染色 标本均经10%中性福尔马林固定,常规脱水,石蜡包埋,4 μm厚连续切片,常规HE染色,光镜下观察组织学形态。
1.2.2免疫组化 采用免疫组化EnVision两步法染色,抗体α-inhibin、Melan-A、vimentin、Syn、CgA、CK、PD-1及免疫组化试剂盒,均购自福州迈新公司。PD-L1采用DAKO公司PD-L1 IHC22C3 pharmDX试剂盒,于DAKO Atuostaniner Link48组织染色机平台完成。
1.3 结果判断PD-1表达于肿瘤间质活化的T细胞表面,以细胞质及细胞膜呈棕黄色颗粒为阳性,随机选取10个高倍镜视野(400×),评估阳性细胞在肿瘤细胞中所占百分比的平均值,阳性细胞数≥1%为阳性,<1%为阴性。PD-L1结果判读[2]采用肿瘤比例评分(tumor proportion sore, TPS)系统,计算任何强度的部分或完全膜染色的活肿瘤细胞占标本中活肿瘤细胞的百分比,采用百分数表示。肿瘤细胞质染色、肿瘤内间质及坏死区域不包含在评估范围内。其中,TPS<1%为PD-L1阴性,TPS≥1%为PD-L1阳性,TPS≥50%为PD-L1强阳性。
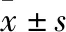
2 结果
2.1 临床特点13例ACC患者中高血压5例(38.46%),皮质醇增多2例(15.38%),腹痛4例(30.77%),无明显症状5例(38.46%)。根据AJCC第8版TNM分期系统,Ⅱ期12例(92.31%),Ⅲ期1例(7.69%)(表1)。本组1例合并胃肠道间质瘤病史,其余均无手术史。
2.2 病理检查
2.2.1眼观 肿瘤体积较大,最大径>5 cm,呈结节状外观,常见纤维性包膜,切面实性,呈灰白、灰黄色,常伴出血、坏死,质软。本组肿瘤平均最大径(11.84±5.21)cm,中位值11 cm。
2.2.2镜检 肿瘤常侵犯被膜,浸润至周围脂肪组织,脉管内瘤栓多见,大部分呈腺泡状、巢状(图1A),也可见梁索状或实性片状结构。这些结构常混合存在,弥漫性结构常大于肿瘤的30%,平均(47±18)%,多伴坏死,肿瘤体积较大者,坏死广泛,间质富于血管。肿瘤细胞呈中~重度异型性,胞质可从空泡状到嗜酸性,肿瘤中的透明细胞减少,甚至缺乏,细胞核的形态表现为较大差异,部分核较小,均匀一致,呈Fuhrmann 2级。部分核具有明显多形性,可见巨核、怪异核,呈Fuhrmann 4级(图1B)。核分裂象多见,常>5个/50 HPT,也可见病理性核分裂象。有1例呈横纹肌样形态,肿瘤细胞胞质嗜酸、核偏位,伴明显核仁(图1C)。Weiss评分平均(5.29±1.20)分,中位数6分。
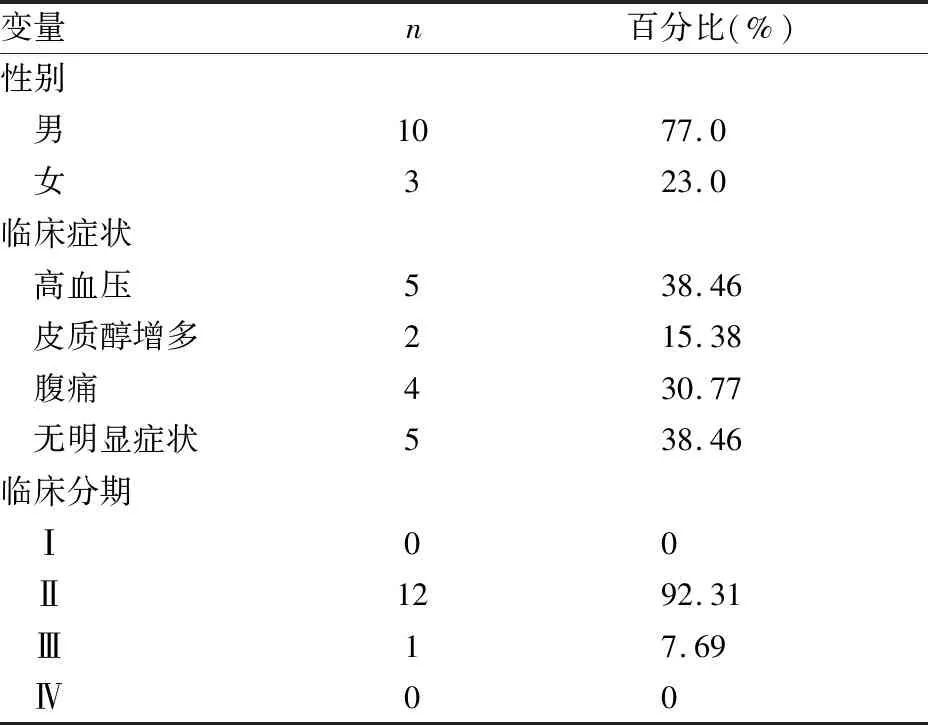
表1 13例ACC患者的临床信息
2.2.3免疫表型 ɑ-inhibin、Melan-A、Syn、vimentin阳性率分别为84.62%、100%、76.92%、100%;CgA和CK阴性率分别为92.31%和61.54%。PD-1阳性1例(7.69%),该例免疫组化阳性率为5%(图2A)。PD-L1阳性2例(15.38%),2例免疫组化阳性率分别为40%(图2B)和1%。网织纤维染色显示:ACC的巢状结构消失,网织纤维断裂或不连续(图2C)。
2.3 生存分析13例患者均获得随访,中位随访时间54个月(4~123个月),平均生存时间(48.77±35.80)个月。7例存活,6例死亡,其中3例复发伴全身多发转移。患者出现内分泌症状(皮质醇分泌增多及高血压)与低生存率相关[40.0%(2/5)vs50.0%(4/8),P=0.043]。肿瘤中弥漫性结构占比(≤30%、>30%)与生存率无明显相关[50.0%(1/2)vs45.0%(5/11),P=0.395]。肿瘤细胞高细胞核级(1~2级、3~4级)与生存无明显相关[50.0%(3/6)vs43.0%(3/7),P=0.652]。Weiss评分(≤5分、>5分)与生存率无明显相关[40.0%(2/5)vs50.0%(4/8),P=0.405]。Ki-67增殖指数与生存率无明显相关,其中≤10%或>10%的Ki-67增殖指数为16.7%(1/6)vs71.4%(5/7)(P=0.275);≤20%或>20%的Ki-67增殖指数为44.4%(4/9)vs50.0%(2/4)(P=0.469)。PD-L1阴性与生存率高相关[54.5%(5/11)vs50.0%(1/2),P=0.045];PD-1阳性与生存率无明显相关[50.0%(1/2)vs45.5%(5/11),P=0.745]。
2.4 Roc曲线肿瘤最大径<10 cm者4例,均存活;最大径≥10 cm者9例,其中死亡6例,病死率占66.67%,提示肿瘤最大径越大患者的预后越差。本组结果显示:肿瘤最大径对预后敏感,肿瘤最大径越大,与死亡相关性越高,敏感度为94.0%(P=0.008,图3)。其中计算约登指数,肿瘤最大径临界值为11.7 cm,敏感度83.3%,特异性为1。
2.5 Cox单因素分析单因素分析结果显示:内分泌症状HR(95%CI)为0~2 509.25(P=0.435);肿瘤最大径HR(95%CI)为0.862~1.16(P=0.996);PD-L1的HR(95%CI)为0.044~3.366(P=0.387);均不是影响ACC患者预后的独立危险因素(表2)。
图1 A.瘤细胞排列呈腺泡状、巢状;B.瘤细胞呈中~重度异型性,胞质丰富嗜酸,核具有多形性,可见巨核、怪异核;C.瘤细胞呈胞质嗜酸,核偏位,呈横纹肌样 图2 A.1例PD-1免疫组化阳性率5%,EnVision两步法;B.1例PD-L1免疫组化阳性率约40%,EnVision两步法;C. ACC中巢状结构消失,网织纤维断裂,网织纤维染色

图3 肿瘤最大径的Roc曲线

表2 ACC的Cox单因素分析
2.6 Cox多因素分析多因素分析结果提示:内分泌症状HR(95%CI)为0~5.454(P=0.956)、肿瘤最大径HR(95%CI)为0.756~1.341(P=0.965);PD-L1的HR(95%CI)为0.014~24.946(P=0.748);均不是影响ACC患者预后的独立危险因素(表3)。
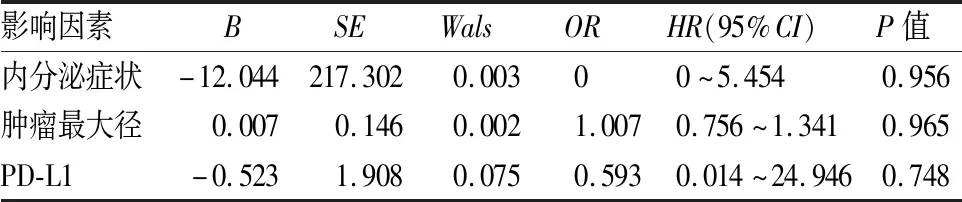
表3 ACC的Cox多因素分析
3 讨论
ACC是发生于肾上腺皮质的恶性肿瘤,多数呈散发性,发病年龄呈双峰分布,分别为5岁以下及50岁以上,占儿童恶性肿瘤的1.3%和成人恶性肿瘤的0.02%~0.2%[3]。ACC的预后较差,恶性程度高,侵袭性强,进展迅速[4]。但是ACC的进展、复发及预后存在显著个体差异,部分晚期患者仍能获得较长的生存时间[5]。ACC的发生、发展可能与IGF-2过表达、TP53基因突变[6]以及Wnt/β-catenin通路的异常激活相关[7]。由于ACC复杂性以及可供研究的病例数较少等原因,影响ACC预后及分子机制分析。
Tella等[8]对美国国家癌症数据库(NCDB)中ACC病例进行大样本回顾性研究:患者年龄高、查尔森合并症指数高、肿瘤级别高、分期晚及未行手术治疗与预后不良相关。根据欧洲肾上腺肿瘤研究网络(ENSAT)[9],Ki-67增殖指数是ACC的可靠预后因子。苏停停等[10]研究表明在晚期远处转移的患者中,Ki-67增殖指数显著高于无转移者。最近有研究表明[11],联合应用细胞骨架重塑因子VAV2和Ki-67能够更加可靠地预测患者的预后。本文将Ki-67增殖指数在肿瘤细胞中的表达转换为分类变量,分别研究≤10%vs>10%或≤20%vs>20%对预后的影响,生存分析结果显示Ki-67增殖指数不具有预后价值。将Weiss评分分为两组(≤5分、>5分),肿瘤的核级分为两组(1~2级、3~4级),生存分析显示均不具有预后价值。
根据肿瘤是否具有内分泌功能,分为功能性和无功能性,具有内分泌功能的肿瘤占45%~70%,多数分泌皮质醇[12]。Berruti等[13]研究524例接受根治性切除手术的ACC患者,首次提出皮质醇高分泌与患者的总生存时间(overall survival, OS)和无复发生存时间(relapse free survival, RFS)缩短相关。李少华等[12]研究表明,合并皮质醇高分泌者的死亡风险提高13.53倍。长期皮质醇增高会导致免疫抑制,进而增加转移的机会,皮质醇高分泌也会增加术后并发症发生的概率,肿瘤复发的风险提高67.0%。本组生存分析显示具有内分泌症状的患者生存率低于不具有内分泌症状的患者(P=0.043),但Cox单因素及多因素分析显示其不能显著影响预后,可能与本组纳入回归模型的病例数较少相关。
既往研究表明肿瘤分期是影响ACC预后的重要因素[14-15]。据TNM分期,肿瘤直径影响Ⅰ、Ⅱ期,临界值为5 cm。本组肿瘤最大径<10 cm者均存活,直径≥10 cm者,病死率占66.67%,提示肿瘤直径越大患者的预后越差。本组采用绘制Roc曲线发现肿瘤最大径对预后敏感,肿瘤最大径越大,与死亡相关性越高,敏感度94.0%(P=0.008)。其中计算约登指数,最大径临界值为11.7 cm,敏感度83.3%,特异性为1。Cox单因素及多因素分析发现肿瘤最大径不是独立预后危险因素,可能与本组纳入分析的病例数较少相关。本组发现PD-L1阴性与ACC的术后生存率高相关,但Cox单因素及多因素分析尚未证明其是独立预后危险因素。PD-1表达于肿瘤间质的T细胞表面,PD-L1与活化的PD-1结合后,可诱导T细胞凋亡。肿瘤微环境诱导T细胞高表达PD-1,易使PD-1通路持续激活[16-17]。PD-1/PD-L1抑制剂可以阻断PD-1与PD-L1的结合,阻断负向调控信号,恢复T细胞活性,增强免疫应答。现已有研究证明[18],肺癌、胃癌、胰腺癌等多种肿瘤通过过表达PD-L1,诱导形成免疫抑制剂肿瘤微环境,逃避机体的抗肿瘤免疫反应。
本组结果显示ACC组织中PD-L1阴性与术后生存率高相关,但肿瘤间质的淋巴细胞PD-1表达较低,可能与ACC的肿瘤组织中坏死较多,缺乏间质淋巴细胞,其表达较低。Tierney等[19]发现,与肾上腺皮质腺瘤(adrenocortical adenoma, ACA)的肿瘤细胞及间质相比,ACC低表达PD-L1(3%)、高表达PD-L2(44%),PD-L2可能成为免疫抑制剂靶点,与本组PD-L1阳性率低的结果一致。
本组回顾性分析13例ACC的临床病理特征及预后相关因素,发现具有内分泌症状、肿瘤最大径越大及PD-L1高表达能够影响患者的预后,但不是独立危险因素。目前,ACC患者预后较差,免疫应答低,免疫治疗的开展亟待进一步的多中心、大样本的研究验证。
