小鼠SMC1A基因原核表达系统的构建及其生物信息学探讨
2022-08-06胡丁旺邱荣晖傅梅萍福建医科大学基础医学院福州350122
胡丁旺 邱荣晖 傅梅萍 福建医科大学基础医学院 福州 350122
染色体结构维持蛋白(structural maintenance of chromosome,SMC)在染色体结构细胞周期性的动态变化中发挥着重要作用[1],而SMC1A作为染色体结构维持蛋白家族的一个重要成员,它是编码凝聚素核心复合物的一个亚单位,该亚单位将姐妹染色单体束缚在一起,以确保在有丝分裂和减数分裂中正确的染色体分离[2]。SMC1A基因在参与DNA损伤修复的过程中,作为重组蛋白复合物的组成部分,可通过重组进行DNA修复,被认为是DNA修复的必要因素,并与细胞的生长、迁移和凋亡密切相关[3-5]。
SMC1A不仅在DNA修复的过程发挥重要作用,也是维持基因组稳定性的关键因素,而基因组的不稳定性被认为是发生癌症的重要原因之一[6]。临床研究表明,SMC1A表达低的急性髓性白血病患者生存时间明显更短[7],而SMC1A基因的突变可导致科妮莉亚德朗热综合征[8],在结肠直肠癌体细胞基因突变检测中也发现了SMC1A基因的突变[9]。
SMC1A并不是一个稳定的蛋白,己经参与了多种人类疾病的发生。为探讨SMC1A的结构和功能,本研究通过克隆小鼠SMC1A基因,构建pET28a-SMC1A原核表达系统,分析其遗传学和生物信息学特性,为研究机体SMC1A基因组稳定性和进一步探究SMC1A基因在相关疾病中的作用机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 动物 试验用ICR小鼠,体质量20 g左右,来自福建医科大学实验动物中心。
1.1.2 仪器与试剂 2720 Thermal PCR仪(热安上海仪器仪表有限公司);pMDTM19-T Vector Cloning Kit(批号:6013)和PrimeScriptTM1st Strand cDNA Synthesis Kit(批号:6110A)均购自宝日医生物技术有限公司;胶回收试剂盒(批号:DP209)、质粒小提试剂盒(批号:DP104)和T4 DNA连接酶(批号:RT406)均购自天根生化科技有限公司;Anti-His Mouse mAb(批号:HT501)和山羊抗鼠二抗HRP(批号:HS211)均购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 小鼠SMC1A基因引物设计 利用基因库中SMC1A的基因序列,设计一对SMC1A基因引物对和载体T7引物对,序列结果见表1,引物委托生工生物公司进行合成。

表1 引物信息
1.2.2 小鼠SMC1A基因的扩增 取小鼠新鲜心脏组织,提取总RNA,再按照PrimeScriptTM1st Strand cDNA Synthesis Kit的操作说明,反转录成cDNA,并根据引物的PCR条件,扩增得到目的基因。
1.2.3 重组质粒的构建和鉴定 鉴定正确的PCR产物使用胶回收试剂盒进行纯化回收,胶回收样品与pMD-19T载体按照试剂盒进行添加,并置于4℃环境下过夜反应,反应完成后加入50μL的DH5α感受态细胞进行转化,并于37℃恒温培养箱中过夜培养,次日选取阳性菌落进行菌落PCR鉴定。
1.2.4 SMC1A蛋白序列分析及蛋白结构预测与功能分析 采用DNAstar软件建立不同种属SMC1A核酸遗传进化树,并进行同源性和抗原肽分析。采用软件SignalP 4.1 Server、NetNG-Lycl.OServer和NetPhos 3.1进行信号肽、N-糖基化位点和磷酸化位点分析。采用SWISS-MODEL建立SMC1A蛋白3D结构图。
1.2.5 pET28a-SMC1A表达蛋白的Western-blot鉴定 所构建原核表达载体pET28a-SMC1A表达的重组蛋白大小为131.2 kD。将PET-28a(+)质粒载体和重组质粒PET28a-SMC1A分别转入BL21(DE3)感受态细胞中表达,采用1.2.3方法进行PCR鉴定,并选取阳性菌落入恒温箱过夜培养,第二天添加IPTG进行诱导,诱导前取1 mL菌液备用。诱导4 h后,菌液取1 mL离心留沉淀,添加上样缓冲液进行变性,截取SDS-page胶上相应条带位置进行His标签蛋白Western-blot试验。
2 结 果
2.1 SMC1A基因PCR扩增产物 经PCR扩增得到SMC1A基因的1%琼脂糖凝胶电泳鉴定见图1。结果提示,3 000~5 000 bp间可见一条带,而SMC1A基因大小为3 703 bp,具有一致性。

图1 SMC1A基因PCR扩增结果
2.2 重组质粒pET28a-SMC1A PCR鉴定结果目的基因SMC1A上下游引物与T7上下游载体引物分别组合进行PCR鉴定,1~4号孔道的条带均出现在3 000~5 000 bp,大小与预期一致(见图2),说明pET28a-SMC1A原核表达载体构建成功。
图2 pET28a-SMC1A PCR鉴定结果
2.3 SMC1A基因同源性分析结果 从NCBI Gen-Bank下载得到恒河猴源、人源、猪源、小鼠源、大鼠源和斑马鱼源SMC1A基因,并加入克隆得到的SMC1A基因测序序列,进行核酸遗传进化树比对和同源性分析。结果发现,小鼠源SMC1A基因与大鼠源、恒河猴源和人源的SMC1A基因具有高同源性(见图3-图4)。

图3 核酸遗传进化树(×100)
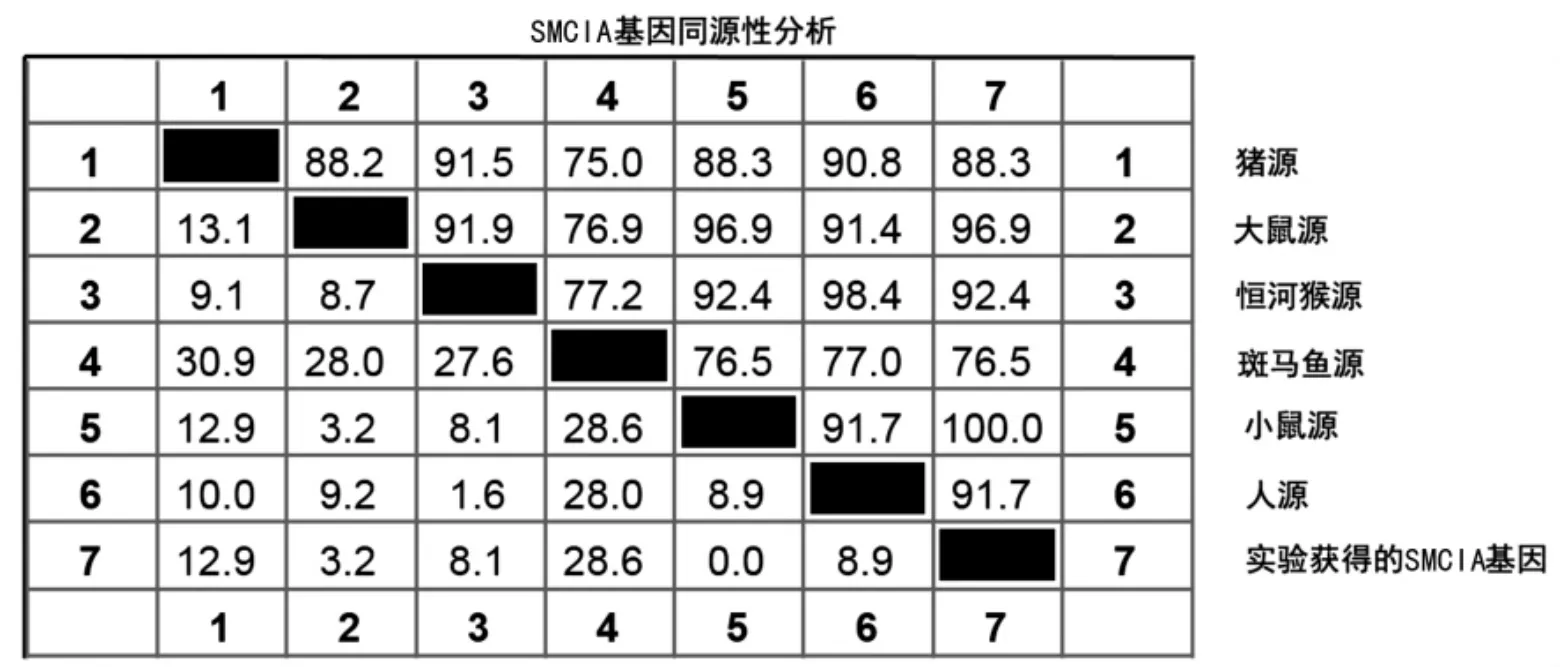
图4 不同种族来源的SMC1A基因同源性分析
2.4 SMC1A蛋白功能分析 SMC1A基因可编码翻译1 233个氨基酸,其蛋白功能分析发现,SMC1A蛋白无N-糖基化位点、跨膜螺旋区域和信号肽,但在SMC1A蛋白多肽上可能存在82个达到阈值的磷酸化位点(见图5),包括47个丝氨酸磷酸化位点、22个苏氨酸磷酸化位点、13个酪氨酸磷酸化位点。

图5 SMC1A蛋白磷酸化能力预测
2.5 抗原肽分析 预测SMC1A蛋白的抗原肽35条,选取的代表性抗原肽具体信息见表2。

表2 SMC1A蛋白抗原位肽分析结果
2.6 SMC1A蛋白3D结构 SMC1A蛋白肽链经多次螺旋、折叠及一系列的结构修饰后,软件模拟的SMC1A蛋白的3D模型见图6。

图6 SMC1A蛋白3D模型
2.7 重组质粒pET28a-SMC1A表达蛋白的Western-blot鉴定 重组质粒PET28a-SMC1A所表达的带His标签蛋白,约为135.6 kD。根据预测蛋白大小截取相应泳道蛋白条带,利用Anti-His Mouse mAb(1:1 000)对蛋白进行Western-blot检测,结果表明,IPTG诱导前和诱导后,100~140 kD位置均出现较为明显的蛋白印迹,且诱导后的蛋白印迹强于诱导前(见图7)。

图7 重组蛋白的Western-blot鉴定
3 讨 论
在癌症的发生过程中,内聚蛋白的缺陷导致了染色体的不稳定性,而SMC1A作为染色体结构维持蛋白的重要成员之一,对于染色体结构的稳定性是至关重要的。众多研究显示,SMC1A与癌症的发生密切相关,SMC1A基因的缺失、异位和突变,都可能造成染色体破坏,从而引起相关疾病的发生[10]。为了明确SMC1A的结构和功能,通过克隆SMC1A基因并构建至pET-28a(+)原核表达载体,经PCR鉴定和测序鉴定,证实pET28a-SMC1A构建成功,与不同种属核苷酸序列的同源性分析显示,与大鼠源同源性高达96.9%,而与人源基因同源性约为91.7%,与人源基因的高同源性确认了SMC1A基因导致的疾病在鼠类动物上的开展和研究的可行性。
蛋白质要发挥其机体功能,相关研究认为蛋白质之间的相互作用必不可少[12],DNA损伤修复、自噬和凋亡等重要过程的发生均需要蛋白质相互作用的参与和介导,而蛋白质之间发生相互作用主要依赖于蛋白翻译后的多种修饰作用,常见的蛋白修饰作用有甲基化、乙酰化、磷酸化和泛素化等,这些修饰作用常常发生于赖氨酸、精氨酸、丝氨酸、苏氨酸和酪氨酸等氨基酸残基上[13]。笔者通过蛋白磷酸化分析发现,SMC1A蛋白多肽上存在较多的磷酸化位点,通过这些不同磷酸化位点进一步筛选分析,或许可以找到SMC1A介导DNA损伤修复、自噬和凋亡的关键分子机制。SMC1A蛋白上共有35条抗原肽段,足够多的抗原肽段可以为SMC1A基因疾病模型的免疫治疗提供更多的抗原表位选择。另外,蛋白肽链一级、二级、三级、四级结构的修饰不同决定了蛋白具有不同的功能,笔者通过软件模拟SMC1A蛋白的3D结构图,初步分析SMC1A蛋白结构的螺旋、折叠和跨膜特性,并对重组蛋白进行Westernblot鉴定,在IPTG诱导前后蛋白表达量存在差异,但IPTG的最佳诱导浓度以及最佳诱导时间还有待进一步探究。
综上所述,对于SMC1A结构和功能的探讨,为SMC1A介导的相关疾病的研究提供理论方向。通过研究SMC1A蛋白在癌症中的表达状况与分子功能,对于进一步明确癌症发病的分子机制有着积极的意义,并且可能为癌症的治疗与预防寻找到新的突破口。
