伪狂犬病病毒FJMH1907b株的分离和gD基因的演化分析
2022-08-06吴学敏汪翊灵陈如敬陈秋勇王隆柏车勇良刘玉涛周伦江
吴学敏 汪翊灵 陈如敬 陈秋勇 王隆柏 车勇良 严 山 刘玉涛 周伦江*
(1.福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心 福州 350013;2.闽侯县农业农村局畜牧兽医站 福建闽侯 350100)
伪狂犬病病毒(Pseudorabies virus,PRV)是一种神经性疱疹病毒,可感染多种哺乳动物,包括反刍动物、食肉动物和啮齿动物,导致易感动物中枢神经系统疾病[1-2]。猪是PRV的天然宿主,伪狂犬病(Pseudorabies,PR)对养猪业危害性大,具有高度隐性感染的特点,可引起持续性感染,特别是耐过的母猪呈长期带毒生产[3]。2011年以来,我国许多规模化猪场暴发了PR,主要表现为猪群PRV-gE抗体阳性率显著升高,普遍出现母猪流产、仔猪神经症状和病死率高等临床情况,近几年还相继发现免疫PR疫苗的养猪场发生伪狂犬病,并分离到新的PRV流行毒株[4-6],相关研究表明,新分离的PRV毒株出现了变异,而经典毒株的疫苗未能完全保护新型强毒力PRV的感染[7-10]。PRV已发现16种囊膜蛋白,其中11种功能性囊膜蛋白,gD(US6)为糖基化蛋白,是PRV的主要免疫原之一,在病毒感染细胞至复制生长过程中起着重要的作用,也最先被机体免疫系统识别引起免疫应答[11-12]。研究表明,gD蛋白抗体是主要中和抗体之一,能够充分中和PRV,且不存在补体时也能有效中和[13]。本研究对福建省闽侯县发生疑似PR的猪场进行PRV分离鉴定,再对新分离PRV毒株gD基因进行PCR扩增,通过测序比对分析,探究猪伪狂犬病病毒gD基因的遗传进化规律,为PR预防和控制提供理论依据。
1 材料与方法
1.1 细胞与病毒 PK-15细胞由本研究室保存,用于病毒分离和传代培养;伪狂犬病病毒参考毒株Fa株由本研究室保存。
1.2 病料与病毒分离 从福建省闽侯县某猪场采集疑似PRV感染猪的脑、肺、脾脏和肝脏组织,参考文献[7]的方法,处理病料并接种于PK-15细胞,将发生病变的细胞传至3~4代,待细胞70%发生病变时收获病毒液,冻存于-80℃,备用。
1.3 主要试剂 病毒核酸提取试剂盒、PCR扩增高保真酶Mix、GC Buffer等均购自北京全式金公司;DMEM培养基和胰酶购自HyClone公司;犊牛血清购自杭州四季青公司;琼脂糖、10×TAE缓冲液购自北京索莱宝公司。
1.4 引物设计合成 参考GenBank中PRV基因序列(NC_006151),设计扩增gE基因保守序列的引物和gD基因的引物,序列分别为gE-F:5'-AACTATGGCATGACCGCCAA-3',gE-R:5'-GTGGAGAAGAAGAGTCCGGC-3';引物gD-F:5'-ATGATGATGGTGGCGCGCGAC-3',gD-R:5'-TTATTGTTCTTCTGCGATGGTGGCGAG-3'。引物由铂尚生物技术公司合成,两对引物预计扩增的片段大小分别为612 bp和1 100 bp。
1.5 PCR检测鉴定 按照病毒核酸提取试剂盒说明书提取组织上清液和病毒培养液的病毒DNA作为模板,以Fa株的核酸作为阳性对照,用gE引物进行PCR扩增,产物经1%琼脂糖凝胶电泳观察鉴定。
1.6 gD基因扩增 以分离的病毒DNA为模板,用gD引物进行PCR扩增反应,反应条件为:94℃预变性5 min;94℃变性30 s,58℃复性45 s,72℃延伸45 s,进行35个循环;最后72℃延伸10 min。反应结束,取5μL于1%琼脂糖凝胶电泳观察结果,并将目的条带胶回收,送上海铂尚生物技术公司测序。
1.7 gD基因序列及氨基酸序列分析 将测序结果用DNAStar软件中SeqBulider程序推导对应的氨基酸序列,挑选GenBank中登录的具有代表性的15个毒株使用MEGA 5.05和MegAlign软件进行同源性比对分析,并构建遗传进化分析树,探究它们的亲缘关系。选取的毒株为Fa株(AY196984)、Min-A株(AY169694)、La株(AY174090)、SA215株(DQ367438)、FZ株(EF645837)、TJ株(KJ789182)、LC株(MF434034)、FJ-Y21株(MK922107)、HNXY株(MN003373)、Anhui-ZJ1株(MK922121)、Kaplan株(AJ271966)、Becker株(AY368490)、NiA3株(KU900059)、Yangsan株(AY217094)和疫苗毒Bartha株(KY398733)。
2 结果与分析
2.1 病毒分离鉴定 于PK-15细胞上稳定传代的病毒,待接种48 h后可见细胞变圆,出现合胞体,约70%细胞出现病变时收起,进行PCR检测鉴定,以Fa株作为阳性对照,结果见图1,分离到的病毒与阳性对照在600 bp处出现明显条带,并对PCR产物进行测序,与GenBank中PRV-gD基因序列一致,表明分离的病毒为PRV,命名为FJMH1907b。
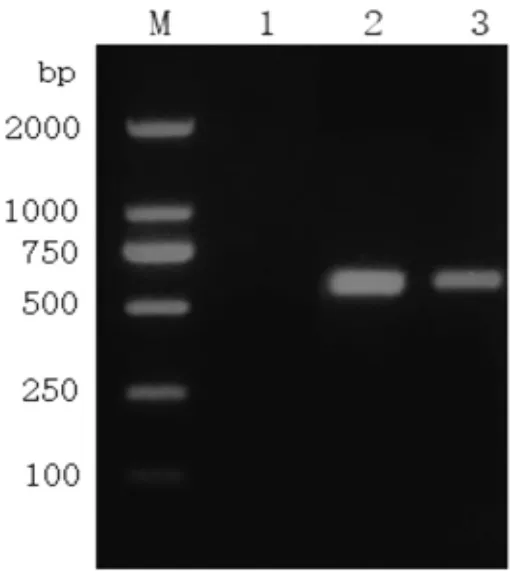
图1 PCR鉴定电泳图
2.2 gD基因扩增结果 以分离的病毒FJMH1907b株和Fa株核酸为模板,PCR扩增gD基因,结果见图2,均在1 100 bp处出现预期条带,将条带回收送检测序。
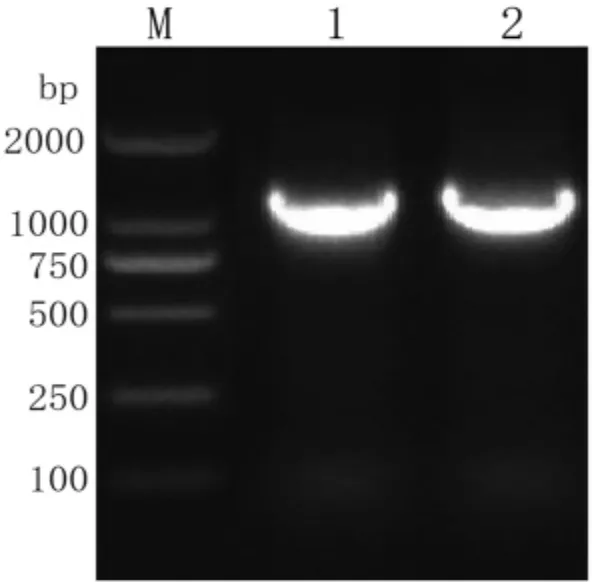
图2 gD基因PCR扩增电泳图
2.3 gD核苷酸序列比对分析 将FJMH1907b株gD基因片段扩增测序结果,与GenBank中收录的15株PRV对应核苷酸序列进行比对分析,由构建的遗传进化树可见,新分离FJMH1907b毒株与国外Kaplan毒株及疫苗毒Bartha株不属于一个大的分支上,与国内FJ-Y21株、Anhui-ZJ1株、LC株及TJ株同属一个小分支上(见图3)。

图3 PRV-gD基因核苷酸序列遗传进化树
2.4 gD基因推导氨基酸序列比较 将gD基因推导的氨基酸序列进行比较分析,结果显示(见图4)推导出对应氨基酸共369aa,差异较大的区域集中在aa278~aa282,存在连续氨基酸缺失或增加,另aa287、aa341存在A-V和P-Q互换;部分毒株个别氨基酸也存在突变,主要变化有A105V、I121V、R276K、F323L、S355P,其中疫苗毒Bartha株的aa81存在N突变成S,新分离FJMH1907b株的aa271存在R突变成Q。

图4 gD基因推导氨基酸序列比较
2.5 gD基因推导氨基酸序列比对分析 将gD基因推导的氨基酸序列进行比对分析,构建的遗传进化树显示(见图5),与核苷酸序列的比对结果相似,新分离FJMH1907b毒株处于相对独立分支,与国外Kaplan毒株及疫苗毒Bartha株不属于一个大的分支上,与国外Becker毒株、NiA3株也不在一个分支上,与国内Fa株、FZ株、FJ-Y21株、Anhui-ZJ1株、LC株及TJ株同属一个较小分支上。

图5 PRV-gD氨基酸序列遗传进化树
2.6 gD氨基酸同源性比较分析 根据推测的氨基酸序列,采用MAGE软件比对获得PRV gD蛋白氨基酸同源性比对矩阵,结果显示(见图6):新分离FJMH1907b毒株与其它参考毒株的同源性为87.7%~100%,与国外毒株的同源性为87.7%~99.7%,其中与疫苗毒Bartha株的同源性仅87.7%、韩国Yangsan株为99.7%;与国内Fa株、FJ-Y21株、TJ株、Anhui-ZJ1株及LC株同源性为100%。
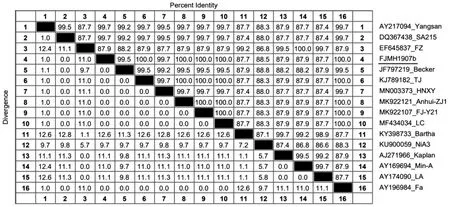
图6 gD氨基酸序列同源性矩阵
3 讨 论
PRV为线性双股DNA病毒,基因全长约150 kb,其中G+C含量高达73%,编码的囊膜蛋白中有11种是糖偶联蛋白,包括gL、gH、gB、gC、gN、gD、gI和gE蛋白等,大部分与病毒的入侵感染和复制生长增殖密切相关,部分也直接参与宿主的免疫反应,产生相应的抗体[1,2,14-15]。gD蛋白也是主要免疫原性糖蛋白之一,是病毒感染过程所必需的,具有高度保守性,是机体中和抗体的目标蛋白之一[11]。gD蛋白氨基酸序列分析和蛋白空间构象研究表明,gD蛋白具有跨膜区、细胞膜结合位点和信号肽区的典型免疫活性特性[16]。自2011年以来,我国出现新的PRV流行毒株,陆续相关研究发现新毒株毒力基因和抗原保护性基因均出现一定的变异,也给该病的防控带来新的挑战[17]。部分规模化猪场的猪群PRV-gE抗体阳性率显著升高,出现母猪流产、仔猪神经症状和死亡率升高等情况,甚至还发现部分免疫PR疫苗的猪场发生伪狂犬病,并分离到新的PRV流行毒株。相关研究表明,新分离的PRV毒株出现了变异,而经典毒株的疫苗未能完全保护新型强毒力PRV的感染[8-10]。
本研究对新分离的PRV毒株FJMH1907b株的gD基因核苷酸序列和对应氨基酸序列与参考毒株进行对比分析,结果显示福建新分离FJMH1907b毒株与疫苗毒Bartha株不属于一个大的分支上,且两者对应的氨基酸序列同源性为87.7%,这可能是导致该猪场伪狂犬病免疫失败而发病的原因之一,或PRV经典毒株疫苗对新型毒株不能提供完全保护。PRV gD蛋白具有高度保守性,氨基酸序列比对分析结果显示,不同地域分离的毒株具有一定差异,主要集中在aa278~aa282位置存在连续氨基酸缺失或增加,以及在aa276、aa287、aa341存在R-K、A-V和P-Q互换,新分离FJMH1907b株gD蛋白氨基酸也存在上述变化,同时在aa271存在R突变成Q。因此,本研究对PRV gD基因核苷酸序列和对应氨基酸序列进行对比分析发现,gD蛋白较保守,但存在一定地域差异性,与徐志文等研究结果一致[16];与国外Bartha株存在较大的差异,兔源gD蛋白多抗血清对不同PRV毒株交叉中和效价差异不显著[18],或许PRV gD蛋白个别氨基酸的突变不会引起其抗原性重大改变,但新分离FJMH1907b株gD基因及对应氨基酸序列的比对分析结果,结合目前猪场PRV的流行情况,对该病的防控应因地制宜,定期做好病原学和血清学监测,合理安排疫苗免疫。
