乌司他丁对体外循环下心脏瓣膜置换术患者外周血单个核细胞焦亡的影响
2022-08-05周一鸣惠康祥周俊辉涂立刚
周一鸣,惠康祥,周俊辉,涂立刚*
0 引言
体外循环(Cardiopulmonary bypass,CPB)下心脏瓣膜置换术是目前治疗心脏瓣膜病的主要方法,该术式已较为成熟,手术成功率高[1]。而CPB、手术操作刺激及缺血再灌注损伤等因素又可诱发机体炎性反应及氧化应激反应,增加术后相关并发症,影响患者预后[2]。研究发现,核苷酸结合寡聚化结构域样受体蛋白3 (Nucleotide-binding oligomerization domain-like receptor protein 3,NLRP3)炎症复合体通路的激活参与机体多种生理病理过程[3]。在该通路被激活的过程中,活化的含半胱氨酸的天冬氨酸蛋白水解酶1 (Cysteinyl aspartate specific proteinase 1,Caspase-1)切割消皮素-D (Gasdermin-D,GSDMD)氨基端和羟基端的连接体,产生的N端片段(GSDMD-N)可靶向作用于细胞膜,增加质膜的通透性,导致炎性细胞程序性死亡,即细胞焦亡[4]。外周血单个核细胞(Peripheral blood mononuclear cell,PBMCs)是外周血中具有单个核的细胞,包括淋巴细胞、单核细胞和树突状细胞,主要参与机体炎性反应。作为一种非特异性蛋白酶抑制剂,乌司他丁(Ulinastatin,UTI)已广泛用于心脏外科手术。研究表明,UTI抑制促炎细胞因子的生成并促进抗炎介质的释放,减少肺损伤并改善CPB后的肺功能[5]。另一项前瞻性临床试验结果表明,UTI在CPB手术中可抑制炎性细胞因子,缩短术后机械通气时间和重症监护室(Intensive Care Unit,ICU)驻留时间,有利于促进患者康复[6]。本研究拟探讨UTI对CPB下心脏瓣膜置换术患者围术期炎性反应和PBMCs焦亡的影响。
1 资料与方法
1.1 一般资料 本研究已获本医院医学伦理委员会批准,并与患者及其家属签署知情同意书。选择于2020年2月至2021年5月入住本院和河南省胸科医院的患者共60例,择期行心脏瓣膜置换术,性别不限,年龄45~64岁,体重指数(Body mass index,BMI) 18~25 kg/m2,美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级Ⅱ或Ⅲ级,纽约心脏病协会(New York Heart Association,NYHA)心功能分级II或III级。排除标准:左室射血分数(Left ventricular ejection fraction,LVEF)<45%;近1个月内发生心肌梗死;Ⅲ度房室传导阻滞;既往有心脏手术史;有糖尿病及过敏病史;近期有急性感染史;近期使用皮质激素治疗史;肝肾功能明显异常。采用随机数字表法将患者分为乌司他丁组(UTI组)和生理盐水组(NS组),每组各30例。
1.2 麻醉方法 患者入室后监测心电图、心率、脉搏血氧饱和度(Saturation of pulse oxygen,SpO2)及患者状态指数(Patient state index,PSI)等,面罩吸氧,建立外周静脉血管通路。Allen试验后,局麻下行桡动脉穿刺置管术,监测有创血压。麻醉诱导:咪达唑仑0.04~0.06 mg/kg,舒芬太尼0.5~1.0 μg/kg,依托咪酯0.2~0.3 mg/kg,罗库溴铵0.6~1.0 mg/kg,气管插管术后行机械通气,潮气量 6~8 ml/kg,通气频率12~16 次/min,吸呼比=1∶2,吸入氧浓度(Fraction of inspired oxygen,FiO2) 40%~80%,维持呼气末二氧化碳分压(Partial pressure of end tidal carbon dioxide,PETCO2) 35~45 mmHg。维持麻醉:两组患者均持续输注丙泊酚4~12 mg/(kg·h),吸入七氟烷1~1.3个最低肺泡浓度(Minimum alveolar concentration,MAC),CPB期间停止吸入,间断静脉注射舒芬太尼 0.5~1.0 μg/kg、罗库溴铵0.3~0.6 mg/kg,维持PSI值25~55。行右颈内静脉穿刺术及漂浮导管置入术,监测中心静脉压及肺动脉压,连续监测鼻咽温与直肠温,必要时采用输液加温以及医用变温毯等措施保温。术中通过调整输液,检测血气、观察尿量等方法,使用相应药物维持电解质在合理范围,维持出入量平衡及循环稳定。手术在低温和低流量的CPB下进行。术毕保留气管导管转入重症监护室治疗,并继续机械通气。术后应用患者静脉自控镇痛(Patient-controlled intravenous analgesia,PCIA)进行术后镇痛,配方为舒芬太尼2.5 μg/kg、地佐辛0.5 mg/kg加生理盐水稀释至100 ml。参数设置:无背景剂量,速度为2 ml/h,患者自控镇痛(Patient controlled analgesia,PCA)剂量0.5 ml,锁定时间15 min。患者各项生命体征恢复,达到ICU拔管指征后,即拔除气管导管,面罩吸氧。患者各项生命体征平稳,达到转出ICU标准后,即转入普通病房继续治疗。
1.3 药物干预 UTI组患者接受总剂量为20 000 U/kg的UTI,其中半量于手术切皮前输注完毕,另一半剂量经CPB管路给药。NS组以等容量生理盐水替代。
1.4 观察指标 麻醉诱导后切皮前 (T1)、CPB开始后30 min (T2)、CPB停止即刻 (T3)及停止后24 h (T4)时,采集颈内静脉血样2 ml置于促凝管,再采集6 ml置于乙二胺四乙酸抗凝管,4 ℃冰箱保存,6 h内处理。促凝管血样1 000 g离心20 min,取上清进行下一步实验;抗凝管血样采用改良的Ficoll密度梯度离心法提取PBMCs,重悬于含12%胎牛血浆的1640培养液中,经过夜诱导得贴壁PBMCs,刮取单核细胞用PBS制成细胞悬液,采用MoFloAstrios EQ流式细胞仪(美国Beckman公司)检测单核细胞纯度,其纯度>90%,进行后续试验。用酶联免疫吸附法(Enzyme-linked immunosorbent assay,ELISA)检测血浆白细胞介素(Interleukin,IL)-18及IL-1β的浓度。用Western blot法检测PBMCs中NLRP3、Caspase-1、GSDMD蛋白表达,蛋白上样量为30 μg,以目的蛋白条带灰度值和内参甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)条带灰度值的比值反映目的蛋白的表达水平。记录患者术中丙泊酚、舒芬太尼及去甲肾上腺素用量,术后机械通气时间及ICU停留时间。

2 结果
2.1 两组患者一般情况比较 本研究共纳入60例患者。UTI组术前取消手术1例,术后二次开胸止血1例,最终纳入分析28例;NS组术后不同意继续参与本研究1例,实验操作不当,血样污染,无法检测指标1例,最终纳入分析28例。该56例患者均顺利完成手术并出院。两组患者一般情况比较,差异均无统计学意义(P>0.05)。见表1。
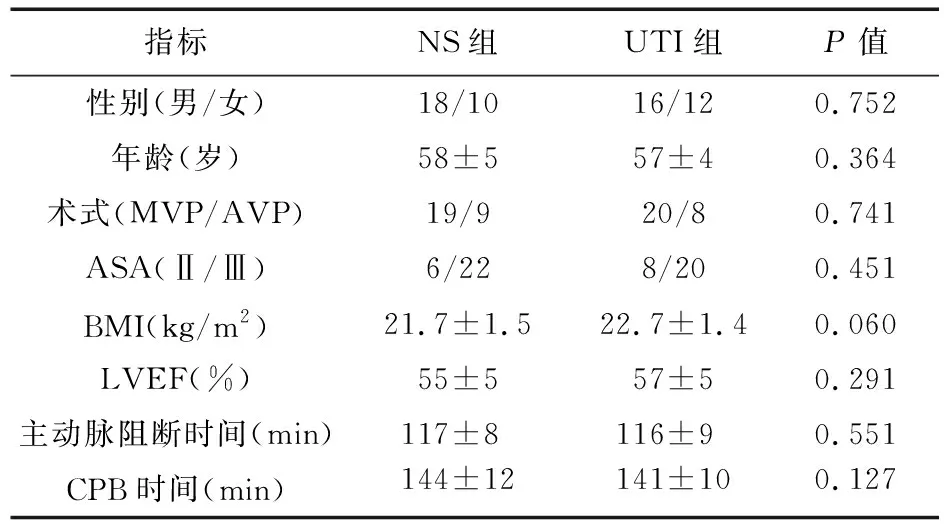
表1 两组患者一般情况比较(n=28)
2.2 两组患者术中资料比较 两组患者术中丙泊酚、舒芬太尼、去甲肾上腺素用量及ICU停留时间比较,差异均无统计学意义(P>0.05),术后机械通气时间比较,UTI组较NS组降低,差异有统计学意义(P<0.05)。见表2。
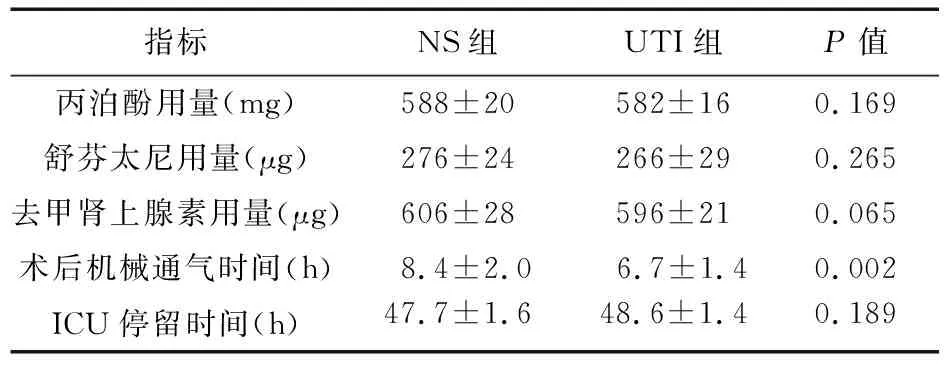
表2 两组患者术中药物用量及术后机械通气时间、ICU停留时间比较(n=28)
2.3 两组患者血浆IL-18、IL-1β水平比较 与T1时比较,T2~T4时两组患者血浆IL-18与IL-1β的浓度升高(P<0.05);T2-T4时,UTI组患者血浆IL-18与IL-1β水平较NS组降低(P<0.05)。见表3。

表3 两组患者血浆IL-18、IL-1β水平比较(n=28)
2.4 两组患者PBMCs中NLRP3、Caspase-1、GSDMD水平比较 Western blot法检测单核细胞中NLRP3、Caspase-1、GSDMD蛋白表达,见图1。与T1时比较,T2~T4时两组患者PBMCs中NLRP3、Caspase-1及GSDMD蛋白表达升高(P<0.05);T2~T4时,UTI组患者PBMCs中NLRP3、Caspase-1及GSDMD蛋白表达水平较NS组降低(P<0.05)。见表4。
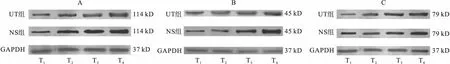
图1 两组患者NLRP3、Caspase-1及GSDMD蛋白表达注:A.NLRP3蛋白;B.Caspase-1蛋白;C.GSDMD蛋白
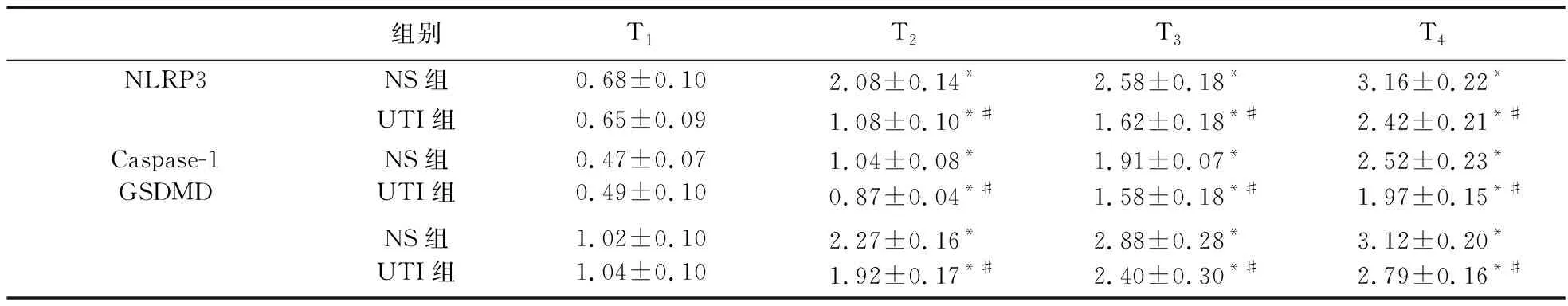
表4 两组患者PBMCs中NLRP3、Caspase-1、GSDMD水平比较(n=28)
3 讨论
在该药品使用说明书中,UTI初始剂量为每次25 000~500 000 U,每天1~3次。因此,UTI的用药范围较广,安全性较高。本研究先从患者的安全考虑,再参考相关文献报道的用药剂量[7],确定UTI组患者接受总剂量为20 000 U/kg的UTI,其中的半量于手术切皮前输注完毕,另一半的剂量经CPB管路给药。结果表明,未见UTI相关不良反应发生。本研究中两组患者术后机械通气时间比较,UTI组较NS组降低,UTI有利于术后早期拔管,可能与其降低炎性反应,减少肺部感染及对呼吸中枢的影响小等因素有关[8-10]。
正常人外周血中IL-18和IL-1β水平和活性都很低,当机体受到刺激,上述炎症因子的水平会增加,活性增强发生炎性反应,因此,人外周血中IL-18和IL-1β的浓度可以反映机体炎性反应的程度[11]。此外,IL-18和IL-1β是NLRP3炎症通路的主要效应分子,其浓度增高提示该通路的激活[12]。本研究显示,NS组和UTI组患者IL-18和IL-1β水平与T1比较,在T2~T4时升高,提示患者在手术开始后,随着CPB及手术操作等刺激,机体发生剧烈的炎性反应。而UTI组患者在T2~T4时IL-18和IL-1β水平升高程度较NS组患者低,表明UTI在此类手术患者中发挥一定的抗炎作用。
研究发现,在单核细胞、巨噬细胞、粒细胞、树突状细胞、上皮细胞及成骨细胞的细胞质内均有NLRP3表达,在炎症感染和内源性刺激作用下,其表达上调[13]。本研究显示,两组患者PBMCs中NLRP3、Caspase-1蛋白表达上调,提示在此类患者中,NLRP3炎症通路参与其炎性反应机制,而UTI组患者NLRP3、Caspase-1蛋白表达下调,提示UTI可以抑制该炎症通路。这与李祥等[14]的研究结论一致。因此,UTI可以通过抑制NLRP3、Caspase-1的表达来减轻炎性反应。
已有研究证实,GSDMD是Caspase-1诱导的细胞焦亡的关键底物蛋白[15]。GSDMD蛋白在各种细胞中广泛表达,如心肌细胞、内皮细胞、单核细胞等,它包含2个特征性结构域,N端具有在细胞膜上打孔的能力,介导细胞焦亡的发生;GSDMD-C端结构域具有自体抑制功能,在细胞静息状态下,C端可抑制N端结构域的功能[16],而敲除GSDMD基因可抑制Caspase-1通路引起的炎性坏死[17]。本研究中的两组患者PBMCs中均有GSDMD蛋白的表达,这是细胞焦亡参与其中的有力证据,而UTI组患者GSDMD蛋白表达水平较NS组患者低,提示UTI可能通过抑制PBMCs焦亡,发挥抗炎作用。本研究初步证实,UTI可通过下调PBMCs中GSDMD蛋白表达,抑制Caspase-1通路引起的炎性坏死。
综上所述,UTI减轻了CPB下心脏瓣膜置换术患者的炎性反应,其抗炎机制可能与抑制NLRP3、Caspase-1蛋白表达、降低其下游炎症因子IL-18、IL-1β的水平、抑制PBMCs焦亡有关。以上观点出自单中心、小样本临床研究,尚待多中心、大样本的临床研究进一步证实。
