右美托咪定减轻大鼠肾缺血再灌注的机制及致肝损伤中的作用研究
2022-08-05鹿文琪李小绪
鹿文琪,李小绪
(1.蚌埠医学院第一附属医院麻醉科;2.蚌埠医学院第一附属医院神经外科,安徽 蚌埠 233000)
导致急性肾脏损伤的其中一个机制是肾脏缺血再灌注损伤(RIRI)。肾脏属于高灌注脏器,因此对缺血非常敏感[1],RIRI也是手术治疗肾脏疾病过程中较常见的病理生理现象。在大多数情况下,RIRI不仅会损伤原位脏器,还可能引起远隔脏器的损伤,而肝脏做为人体内最大的实质性脏器,其血流量大,极易受到循环中有害物质的影响而出现病理改变和功能损伤[2]。王切[3]等研究表明,RIRI发生后,肝脏也会遭受过氧化损伤。RIRI的发生过程涉及多种蛋白和因子,其中以白细胞介素(interleukin,IL)家族最为常见[4]。除此之外,有研究表明,高迁移率族蛋白 B1[5-6](high mobility group box 1 protein,HMGB1)、Toll 样受体4[7-10](toll-like receptor 4,TLR4)及核转录因子-κB(nuclear factor kappa B,NF-κB)信号通路都参与了RIRI的发生过程,并在其中起到了重要的作用[11-12]。并且,白细胞介素家族能够与这些通路相互影响,加重RIRI。有研究人员发现,RIRI在一些脏器如脑、心、肝、肾等中的发展程度能够被右美托咪定抑制[13]。但Dex在其中作用的机制还没有定论。由此,本文主要研究由于RIRI导致的大鼠肝损伤通过Dex预处理后,其HMGB1/TLR4/NF-κB信号通路受到的影响。
1 材料与方法
1.1 材料与试剂
低温离心机(KH20R-Ⅱ,湖南凯达科学仪器有限公司),Precisa 电子分析天平( LS220ASCS,上海精密科学仪器有限公司),凝胶成像系统(DNRLumiBIS,DNR公司,以色列),蛋白转印系统(Trans-Blot Turbo,Bio-Rad公司,美国)。Dexmedetomidine(Dex,批号:181230BP,江苏恒瑞医药股份有限公司),戊巴比妥钠(中国医药集团上海化学试剂公司)。全自动生化检测仪(上海跃进医疗器械有限公司)。IL-6、IL-8、IL-12 和TNF-α ELISA试剂盒(南京建成生物工程研究所)。TLR4试剂盒(博士德生物工程有限公司,武汉),HMGB1试剂盒(博士德生物工程有限公司,武汉),NF-κB试剂盒(博士德生物工程有限公司,武汉)。
1.2 动物分组
SD大鼠(雄性,SPF级)60只,重量区间250~300 g,年龄8~10 w,购买时间为2020年6月,购买地点为天津医科大学动物中心,使用许可证号:SYXK(津)2020-0012。按照随机数字法对60只SD大鼠(雄性)进行分组:假手术组(Sham组)、RIRI组和 Dex 预处理组(Dex使用剂量分别为12.5、25、50 μg/kg),每组12 只。所有实验动物进行标准饲养,实验前12 h禁饮禁食。Sham组大鼠与RIRI 组大鼠进行相同的手术,但不进行肾蒂封闭处理。RIRI 组大鼠经非创伤性血管钳封闭双肾蒂,导致其缺血,封闭45 min后开放肾蒂。Dex预处理各剂量组大鼠在手术前30 min分别腹腔注射12.5、25、50 μg/kg的Dex。手术结束后,以青霉素溶液(20万U/mL)分次充分清洗术野,逐层缝合皮肤,最后肌注青霉素钠(4万U/只)避免术后感染,术后72 h内将实验动物进行处死。在对动物进行处死之前,给与所有的大鼠腹腔注射50 mg/kg戊巴比妥钠将其麻醉,然后固定这些大鼠,分离它们的股静脉并置管。
1.3 标本采集
将各组大鼠于手术后12~24 h以3 mg/mL戊巴比妥钠(50 mg/kg)腹腔注射充分麻醉后仰面固定于手术台上,常规消毒后,取股静脉血离心后取上清液,一部分用全自动生化仪检测AST、ALT、尿素氮(BUN)、血肌酐(Scr)及尿酸(UA)含量,另一部分按试剂盒说明采用ELISA 法检测IL-6、IL-8、IL-12 和TNF-α。随后处死大鼠,取出肝脏和肾脏迅速放入-80 ℃中保存,用于后续实验。
1.4 大鼠肝脏及血清生化指标检测
肝脏组织炎症指标检测:取肝脏组织0.1 g,加入预冷的生理盐水1 mL,制成10%匀浆,离心 (4 ℃,4000 r/min) 10 min,取上清液1.5 mL,按IL-6、IL-8、IL-12 和TNF-α试剂盒操作说明采用ELISA 法检测。
1.5 组织蛋白印迹Western Blot法检测HMGB1、TLR-4、NF-κB步骤
将大鼠的肾脏组织取出,并将其放在0.8 mL细胞裂解液之中,使用仪器超声细胞破碎仪对该组织进行低温匀浆处理,条件为12 000 r/min,-14 ℃,离心时间为10 min。离心结束后,取产物的上清,放置于-80 ℃冰箱之中保存。吸取1 μL的蛋白质溶液,通过BCA法对蛋白质含量进行检测,根据检测结果,在样品中适当的添加细胞裂解液,使得上样蛋白浓度能够保持一致。在样品中按4∶1的比例加入5×上样缓冲液,充分混匀后在95 ℃条件下5 min使蛋白质变性。按一定的次序上样,安排好己知分子量的标准物,通过进行SDS-PAGE电泳的方法来对蛋白质进行分离,在电泳结束之后,经由蛋白转移装置来将蛋白转移到硝酸纤维素膜上,这一操作按照常规的转移蛋白的方法进行。在该转移操作结束后,加入TBST溶液进行洗膜,在室温条件下充分的摇动。洗膜结束后,将硝酸纤维素膜放入封闭液中,在室温条件下摇动。结束封闭后,放置硝酸纤维素膜于一塑料袋中加入一抗溶液(1∶1000,5%脱脂牛奶溶解在TBST中,兔抗人IkBα抗体、兔抗人NF-κB抗体),加入溶液的体积为每平方厘米膜加0.1 mL,在4 ℃条件下过夜。加入HRP标记的抗兔二抗,洗膜后成像),首先混匀然后装入袋中,小心的去除袋子里所有的气泡,最后用封膜机将开口封上,在4 ℃的环境里过夜。去除反应液,使用TBST清洗3次,每次时间为10 min。清洗结束后,在膜上加入带有荧光的二抗(1∶20 000,LI-COR Biosciences,5%脱脂牛奶溶解在TBST中,加HRP标记抗兔二抗),在室温条件下轻轻振荡1 h,然后取出膜,在PBS溶液之中洗膜,重复洗膜3次,每次时间是10 min。通过Odyssey Western Blot分析仪进行读片。
1.6 统计学方法
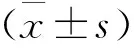
2 结 果
2.1 各组大鼠血清肾功能指标比较
与Sham组相比,RIRI组和Dex预处理各剂量组大鼠血清BUN、SCr及UA水平显著增高(P<0.01),表明大鼠缺血再灌注肾损伤模型成功。与Sham组相比,RIRI组和Dex预处理各剂量组大鼠血清ALT和AST水平显著增高(P<0.01),差异有统计学意义。与RIRI组相比,Dex预处理组随着Dex剂量的增高ALT和AST水平逐渐下降,其中低剂量组下降不明显,差异无统计学意义(P>0.01),而中、高剂量组明显下降,差异具有统计学意义(P<0.01),见表1、图1。

表1 右美托咪定对3组大鼠血清生化指标的影响
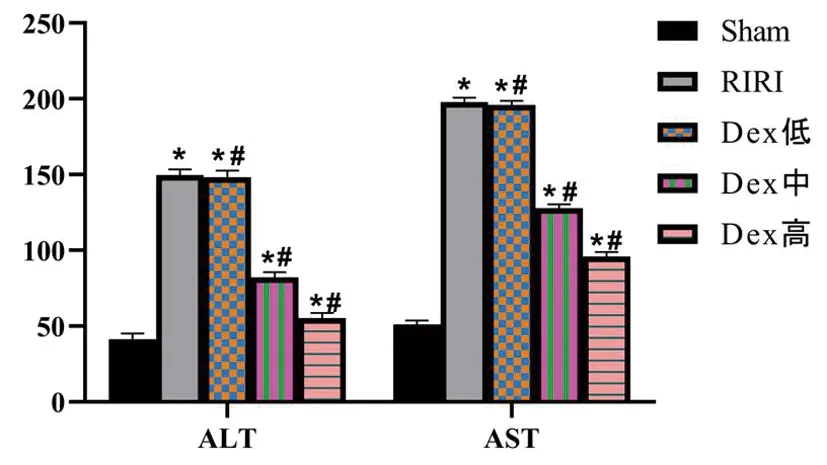
Dex低、中、高剂量分别为12.5、25、50 μg/kg,*与Sham 组相比(P<0.01);#与RIRI组相比(P<0.01)图1 右美托咪定对3组大鼠血清生化指标的影响
2.2 各组大鼠肝组织与血清炎性指标比较
与Sham组相比,RIRI组和Dex预处理各剂量组大鼠肝组织与血清 IL-6、IL-8和TNF-α水平显著调高(P<0.01),差异有统计学意义。与RIRI组大鼠相比,Dex预处理组随着Dex剂量的增高 IL-6、IL-8和TNF-α逐渐下降,其中低剂量组下降不明显,差异无统计学意义(P>0.01),而中、高剂量组明显下降,差异具有统计学意义(P<0.01),见表2、图2。

表2 右美托咪定对3组大鼠肝组织和血清炎症因子水平影响的比较

Dex低、中、高剂量分别为12.5、25、50 μg/kg,*与Sham组相比(P<0.01);#与RIRI组相比(P<0.01)图2 右美托咪定对3组大鼠肝组织和血清炎症因子水平影响的比较
2.3 不同组大鼠肾脏组织中HMGB1、TLR-4和NF-κB蛋白表达水平的比较
与Sham组相比,HMGB1、TLR-4和NF-κB的蛋白表达水平在RIRI组和DEX预处理组中显著升高(P<0.01),差异有统计学意义。相较于RIRI组,随着Dex剂量逐渐增高,HMGB1、TLR-4、NF-κB的蛋白表达水平在Dex预处理组中逐渐下降,其中低剂量组下降趋势不明显,差异无统计学意义(P>0.01),而中、高剂量组下降水平显著,差异具有统计学意义(P<0.01),见表3、图3。

表3 不同组大鼠肾组织HMGB1、TLR-4、NF-κB蛋白表达水平

Dex低、中、高剂量分别为12.5、25、50 μg/kg,*与Sham组相比(P<0.01);#与RIRI组相比(P<0.01)图3 各组大鼠肾组织HMGB1、TLR-4、NF-κB蛋白表达水平的变化
3 讨 论
RIRI是在发生缺血和再次灌注过程中的炎症反应事件[14],指的是肾脏组织缺血之后恢复血液的灌注导致肾脏的功能得不到恢复,从而产生一系列的生理及病理反应。在这一过程中,微血管通透性发生明显改变,其通透性显著增加,其原因主要是由于炎症细胞的浸润,组织间液增多,使得肾组织水肿、进一步导致肾髓质细胞功能紊乱及肾间质和肾小管的变性[15-17]。而RIRI常是多脏器损伤中的关键的病理生理发展过程,研究报道,RIRI导致的多脏器损伤患者的死亡率高达50%~80%[18]。目前临床工作中尚无切实有效的肾缺血再灌注损伤的治疗策略,对其治疗目前仍然依赖于药物。然而,这些药物的治疗疗效一直欠佳。肾脏缺血再灌注损伤常常伴随其他器官尤其是肝脏器官的损伤及功能障碍,这是由于肝脏对于肾缺血再灌注引起的血液中促炎调节因子含量升高更加敏感。相关研究表明,在缺血再灌注的情况下IL-6、IL-8、TNF-α等炎症标志物的水平会显著升高[19-21]。本实验的结果证实,检测RIRI组大鼠血清中的IL-6、IL-8、TNF-α均明显增高,这与既往报道的肾脏缺氧再灌注模型相一致,不仅如此,我们在肝脏组织中的检测也得到了相同的结果,即RIRI组明显高于假手术组,证明IL-6、IL-8、TNF-α作为炎症因子在肾脏缺氧再灌注大鼠的肝脏损伤中发挥重要作用。在研究肾缺血再灌注损伤模型中是否有IL-6、IL-8、TNF-α等炎症因子浸润的同时,本研究还检测了大鼠血清ALT、AST水平,结果显示:RIRI组大鼠血清ALT和AST水平显著调高,表明肾缺血再灌注同时引起了大鼠肝功能损伤。
右美托咪定(Dex)是高效、高选择性的α2肾上腺素受体激动剂,主要用于患者在麻醉时或机械通气时的镇静,不仅不会对呼吸造成抑制,还具有抗焦虑和镇痛作用,随着研究的进展,发现Dex可减轻IRI[15,22]8580475-8580487,其发挥作用的方式主要是依赖于α2肾上腺素受体[23]。Dex能够调节细胞的增殖和凋亡过程,对于炎症反应也有介导作用,同时还具有抗氧化等作用。本实验发现,通过应用Dex预处理肾缺氧再灌注损伤大鼠模型后,与RIRI组大鼠相比,Dex预处理各剂量组大鼠ALT和AST水平随着使用剂量的增多有逐渐下降的趋势,以中高剂量组下降最为明显,提示Dex预处理可减轻大鼠肝功能损伤,对IRI引起肝损伤有保护作用。不仅如此,我们还发现,与RIRI组大鼠相比,Dex预处理各剂量组大鼠炎症介质IL-6、IL-8及TNF-α水平均随着使用剂量的增多逐渐下降,表明Dex预处理明显还可抑制炎症介质相关因子的表达,减轻大鼠机体的炎症反应。但是,目前关于Dex保护受到RIRI损伤脏器的具体作用机制仍旧缺少相关研究报道。研究表明HMGB1/TLR4/NF-κB通路在心肌IRI过程中被激活,并导致各种炎症因子的级联反应,是组织发生损伤的重要机制[24]。本研究各组大鼠肾组织HMGB1、TLR-4、NF-κB蛋白表达量显示:与Sham组相比,RIRI组大鼠肾组织HMGB1、TLR-4和NF-κB表达水平显著调高,提示RIRI中HMGB1/TLR4/NF-κB信号轴也被激活,与RIRI组大鼠相比,Dex预处理各剂量组大鼠肾组织HMGB1、TLR-4和NF-κB水平均下降,同样,以中高剂量组下降最为明显。提示Dex减轻RIRI的作用机制可能与抑制了 HMGB1/TLR4/NF-κB 信号通路的传导有关。
综上所述,本研究结果表明,Dex可能通过抑制或减少 HMGB1/TLR4/NF-κB 信号通路的传导而发挥抗炎作用,使肾缺血再灌注所致的肝损伤有所减轻。
