微囊化沙门菌SP4噬菌体的制备及其缓释特性分析
2022-08-05张永英张逸博吕兴帮朱守创石玉祥
张 博,张永英,郝 贺,张逸博,吕兴帮,朱守创,朱 阵,石玉祥,2*
(1. 河北工程大学生命科学与食品工程学院,邯郸 056000; 2. 河北省禽病工程技术研究中心,邯郸 056000)
噬菌体是一类细菌性病毒,在自然界中广泛存在,其能感染或裂解细菌,并能快速复制增殖,最终达到抗菌的效果,目前,用噬菌体抗菌的方法已经得到了广泛的应用。噬菌体有着特异性强、安全无毒、自我复制还有广泛存在等诸多优势,有望替代抗生素用于防治细菌性感染。噬菌体在治疗动物细菌性疾病方面有着非常显著的成效,但噬菌体的稳定性较差,当噬菌体进入动物胃时,噬菌体的活性易被胃酸、消化酶等损坏,因而失活。所以,口服噬菌体治疗过程中保存活性的问题便成为亟待解决的重要问题。
微囊化技术虽然问世时间不长,但有着非常广阔的前景,主要是利用一些特殊的方法,使某种特殊物质达到预想的密度,并被另一种或几种物质所包裹,从而形成特殊的状态,满足用药的特殊需求,该技术目前已广泛应用于生物制剂的控制释放领域。微囊化技术在国内外均有大量研究,但关于沙门菌噬菌体微囊化包被方面的报道较少,此项技术还有很大发展空间。微囊化技术虽然有着很多的优点,但需要选择出合适的包被材料来进行微囊化包被,不合理的材料只会使包封率很低,其在肠道中不能很好地释放,所产生的治疗效果甚至不如直接口服噬菌体,所以选择合适的微囊化材料是至关重要的。微囊化材料的选择要求无毒、耐酸、且具有较好的生物相容性,常用的包被材料以天然材料为主,如明胶、乳清蛋白、海藻酸钠、壳聚糖、壳寡糖、果胶、黄原胶、变性淀粉等。本研究采用阳离子醚化淀粉(CES)/海藻酸钠(SA)/黄原胶(XG)/纳米TiO/壳寡糖(COS)对沙门菌SP4噬菌体进行微囊化包被,以期获得一种理想的提高噬菌体抗菌效果的方法。
1 材料与方法
1.1 材料与试剂
禽源肠炎沙门菌SDH株、SP4噬菌体由河北工程大学生命科学与食品工程学院兽医实验室分离鉴定;木糖赖氨酸脱氧胆盐琼脂(XLD)、亚硒酸盐胱氨酸增菌液(SC)购自青岛高科技工业园海博生物技术有限公司;LB固体、LB半固体、LB液体培养基、模拟胃液、模拟肠液、微球破解液等由本实验室配制。
1.2 沙门菌SP4噬菌体的分离与纯化
将20 μL SP4噬菌体原液与500 μL对数生长期肠炎沙门菌SDH株悬液混匀,加入5 mL冷却至50 ℃的含7 g·L琼脂的LB培养基,置于预先凝固的LB平板上制成双层平板,37 ℃倒置培养过夜。挑取单个噬菌斑,接种于菌液,37 ℃、170 r·min振荡培养12 h,取样制成双层平板进行纯化,反复纯化2~3次。
1.3 阳离子醚化淀粉/海藻酸钠/黄原胶/纳米TiO2/壳聚糖微囊化微球的制备
将CES溶于去离子水,60 ℃备用(A液),纯化后的SP4噬菌体悬液剂量与CES相同,浓度约为10CUF·mL(B液),A液和B液混合均匀备用(C液)。将SA溶于Tris-HCl溶液(50 mmol·L)备用(D液),XG溶于去离子水,混合均匀备用(E液),纳米TiO置于去离子水中制成母液,超声处理1 h后,适当稀释后,再超声处理15 min,备用(F液),将C、D、E、F 4液置于同一烧杯,混合均匀,去除气泡,备用(G液)。使用无菌注射器,向2 g·dL的CaCl溶液(H液)中以10 mL·min滴速距溶液5 cm 高度处滴入G液,形成ALG-Ca,室温静置30 min, 等待微球固定,收集噬菌体微球,置于COS溶液(I液)中覆膜30 min,过滤收集噬菌体微球,置于4 ℃密封保存,或置于电热鼓风干燥箱中30 ℃干燥24 h后,4 ℃密封保存。
1.4 微囊化SP4噬菌体微球效价和包封率的测定
取1 g SP4噬菌体微球,置于微球破解液中,待完全溶解后,用0.22 μm滤膜过滤除菌,以LB培养液对噬菌体液进行10倍连续稀释,各取10 μL稀释液与10 μL宿主菌悬液混合,静置3 min,迅速制成双层平板,37 ℃倒置培养过夜,噬菌斑数在30~300的平板计数,计算噬菌体效价。噬菌体效价(PFU·mL)=噬菌斑数×稀释倍数×100。同时计算微囊化SP4噬菌体的包封率。计算公式为包封率(%)=噬菌体微球中含药量/初始投入的噬菌体量×100%。
1.5 微囊化沙门菌SP4噬菌体微球的形态表征
1.5.1 形态观察 采用1 200万像素数码相机观测样品宏观形貌。采用扫描电子显微镜(SEM)观测样品微观形貌,取适量微囊化沙门菌SP4噬菌体微球用导电胶粘到样品台上,对样品喷金处理,进行电镜扫描。工作条件:加速电压5.0 kV,工作距离8.9 mm,观察并记录样品图像,通过宏观和微观对微囊化沙门菌SP4噬菌体微球进行形态表征。
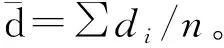
1.6 单因素试验
通过改变CES、SA、XG、COS的浓度,设计分析试验,选择出最合适的SP4噬菌体微球的各因素值。
1.6.1 CES浓度优化 固定SA浓度为1.0 g·dL,XG浓度为1.0 g·dL,COS浓度为1.0 g·dL,分别以2.0、2.2、2.4、2.6 g·dL的CES浓度按照“1.3”方法制备SP4噬菌体微球,优化CES的浓度。
1.6.2 SA浓度优化 固定CES浓度为2.4 g·dL,XG浓度为1.0 g·dL,COS浓度为1.0 g·dL,分别以1.0、2.0、3.0、4.0 g·dL的SA浓度按照“1.3”方法制备SP4噬菌体微球,优化SA的浓度。
1.6.3 XG浓度优化 固定CES浓度为2.4 g·dL, SA浓度为2.0 g·dL,COS浓度为1.0 g·dL,分别以0.5、1.0、1.5、2.0 g·dL的XG浓度按照“1.3”方法制备SP4噬菌体微球,优化XG的浓度。
1.6.4 COS浓度优化 固定CES浓度为2 .4 g·dL,SA浓度为2.0 g·dL,XG浓度为1.0 g·dL,分别以0.4、0.6、0.8、1.0 g·dL的COS浓度按照“1.3”方法制备SP4噬菌体微球,优化COS浓度。
1.7 微囊化沙门菌SP4噬菌体微球的稳定性及释放行为
1.7.1 微囊化SP4噬菌体pH稳定性的测定 将SM缓冲液调整至不同的pH(2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0),向已经调节好的SM缓冲液中分别加入1 g微囊化SP4噬菌体微球,孵育30 min 后,加入微球裂解液中,待其完全裂解后,经0.22 μm滤膜过滤,按“1.4”方法测定效价。
1.7.2 微囊化SP4噬菌体热稳定性的测定 称取等量微囊化SP4噬菌体微球7份,分别置于温度为10、20、30、40、50、60、70 ℃的水浴锅中,孵育1 h后,加入微球裂解液,待其完全裂解后,经0.22 μm滤膜过滤,按“1.4”方法测定效价。
1.7.3 微囊化SP4噬菌体模拟胃液稳定性的测定 将pH2.0和pH3.0的模拟胃液置于7个试管中,向其中分别加入200 mg的微囊化SP4噬菌体微球,在37 ℃摇床120 r·min振荡培养30、60、90、120、150、180 min时取出,加入微球裂解液,待其完全裂解后,经0.22 μm滤膜过滤,按“1.4”方法测定效价。以SM缓冲液作为对照。
1.7.4 微囊化SP4噬菌体模拟肠液释放行为的测定 取模拟肠液(pH7.5)置于试管中,加入200 mg 的微囊化SP4噬菌体微球,分别在37 ℃摇床120 r·min振荡培养2、4、6、8 h时,取100 μL反应后的溶液,经0.22 μm滤膜过滤,按“1.4”方法测定效价。
1.7.5 微囊化SP4噬菌体保存稳定性的测定 湿态和干燥微囊化SP4噬菌体微球于4和25 ℃分别保存,每隔7 d,抽取少量的微球按“1.4”方法测定其效价。
1.8 数据处理与统计
应用SPSS19.0软件,釆用单因素方差分析和Turkey检验进行统计分析,<0.05为差异有统计学意义,最后采用Graph Pad Prism软件作图。
2 结 果
2.1 微囊化沙门菌SP4噬菌体微球的形态表征
2.1.1 形态观察结果 宏观图像如图1A所示,微囊化SP4噬菌体微球干燥前形貌良好,呈规整球状,分散均匀。通过SEM得到微囊化SP4噬菌体微球的微观表面形貌如图1B所示,微球干燥后失水收缩,呈球状或类球状,表面粗糙,存在一定凹陷,没有黏连聚集现象。
A. 宏观图像;B. 微观图像A. Macro image; B. Microscopic image图1 宏观和微观形态表征Fig.1 Macroscopic and microscopic morphological characterization
2.1.2 粒径测定 由图2可知,微囊化SP4噬菌体微球的平均粒径为(950±20) μm,变异系数小于4%。表明试验得到的微囊化SP4噬菌体微球颗粒均匀,球形规整,该工艺能有效、均匀地完成对噬菌体的包被。
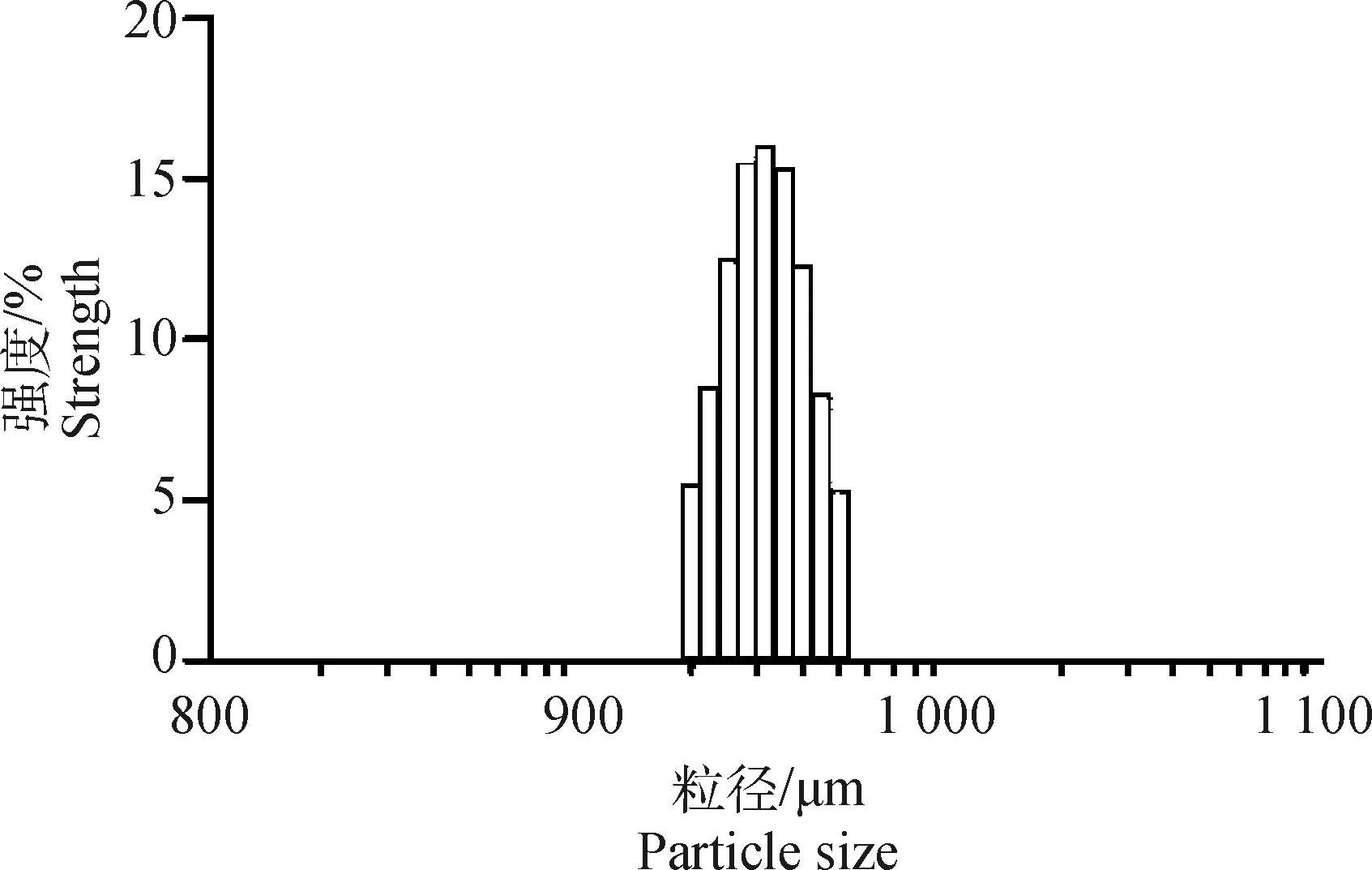
图2 微囊化SP4噬菌体微球粒径分布Fig.2 Particle size distribution of microencapsulated SP4 phage microspheres
2.2 单因素试验
2.2.1 CES浓度优化结果 微囊化SP4噬菌体微球的包封率与CES浓度相关,且随着CES浓度的增大呈现先上升再下降的趋势。其中,当CES浓度为2.4 g·dL时,包封率最高,为88.9%。表明,CES溶液的最佳浓度为2.4 g·dL(图3A)。
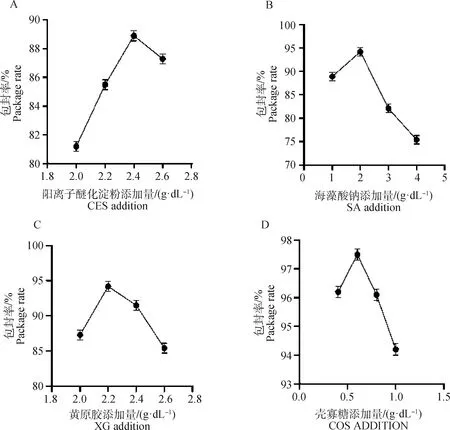
A. GES最佳浓度测定结果;B. SA最佳浓度测定结果;C. XG最佳浓度测定结果;D. COS最佳浓度测定结果A. Determination results of the optimum concentration of GES; B. Determination results of the optimum concentration of SA; C. Determination results of the optimum concentration of XG; D. Determination results of optimal concentration of COS图3 微囊化SP4噬菌体微球中GES、SA、XG、COS浓度优化的测定结果Fig.3 Optimization of GES, SA, XG and COS concentrations in microencapsulated SP4 phage microspheres
2.2.2 SA浓度优化 在SA选用浓度范围里,微囊化SP4噬菌体微球的包封率随SA浓度的增大呈现先上升再下降的趋势,当SA溶液浓度为2 g·dL时,包封率达到峰值为94.2%。表明,SA溶液的最佳浓度为2 g·dL(图3B)。
2.2.3 XG浓度优化结果 随着XG浓度的升高,微囊化SP4噬菌体微球的包封率达到峰值后逐渐下降,包封率最高为94.2%,此时XG溶液浓度为1 g·dL。表明,XG溶液最佳浓度为1 g·dL(图3C)。
2.2.4 COS浓度优化结果 在COS选用浓度范围,微囊化SP4噬菌体微球的包封率随COS浓度的增大呈现先上升再下降的趋势,当COS溶液浓度为0.6 g·dL时,包封率达到峰值为,97.5%。表明,COS溶液最佳浓度为0.6 g·dL(图3D)。
2.3 微囊化SP4噬菌体微球的pH稳定性
微囊化包被的SP4噬菌体经不同pH(2.0~10.0)SM液处理后,均存在活性。SM液pH为5.0~8.0 时,活性无明显变化。当pH低于5.0或高于8.0时,有降低趋势。在pH为2.0时,SP4噬菌体活性仍能达到10PFU·mL以上。结果表明,SP4噬菌体经微囊化包被后能有效提高酸碱耐受性(图4)。
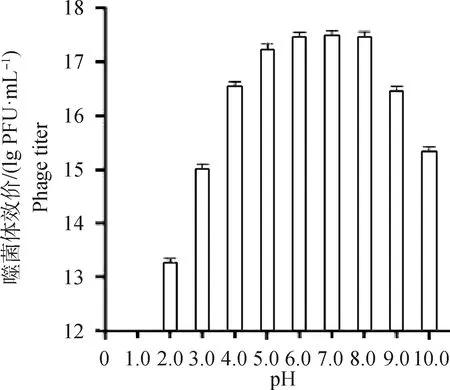
图4 微囊化SP4噬菌体pH稳定性Fig.4 pH stability of microencapsulated SP4 phage
2.4 微囊化SP4噬菌体微球在不同温度中的稳定性
微囊化包被的SP4噬菌体在不同温度孵育后测效价,在10、20和30 ℃,微囊化包被的SP4噬菌体活性基本不变,而随着温度的升高,活性逐渐虽表现出下降趋势,但在70 ℃高温下作用1 h后,SP4噬菌体活性仍能达到10PFU·mL以上,表明SP4噬菌体经微囊化包被后在高温环境下仍能保持较高活性(图5)。
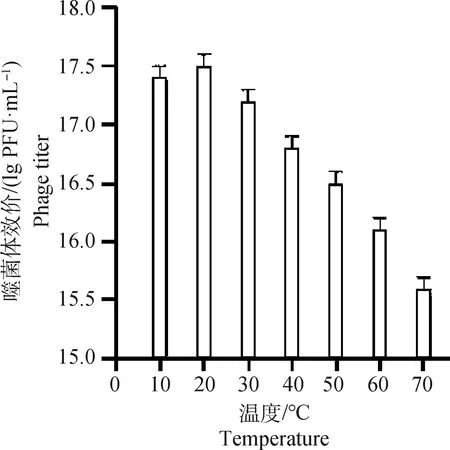
图5 微囊化SP4噬菌体热稳定性Fig.5 Thermal stability of microencapsulated SP4 phage
2.5 微囊化SP4噬菌体微球在模拟胃液中的稳定性
结果显示,在不同pH模拟胃液中,SP4噬菌体的活性均随着时间的增加而降低,直至完全失去活性。当pH2.0时,SP4噬菌体的总活性和比活性呈现0~30 min SP4噬菌体活性缓慢下降(<0.05),30~60 min SP4噬菌体活性急速下降(<0.05);当pH3.0时,SP4噬菌体的总活性和比活性呈现0~150 min SP4噬菌体活性缓慢下降(<0.05),150~180 min SP4噬菌体活性急速下降(<0.05)。在SM缓冲液中SP4噬菌体的活性并未发生显著变化(>0.05)。表明微囊化SP4噬菌体微球在模拟胃液中具有良好的耐受性(图6)。
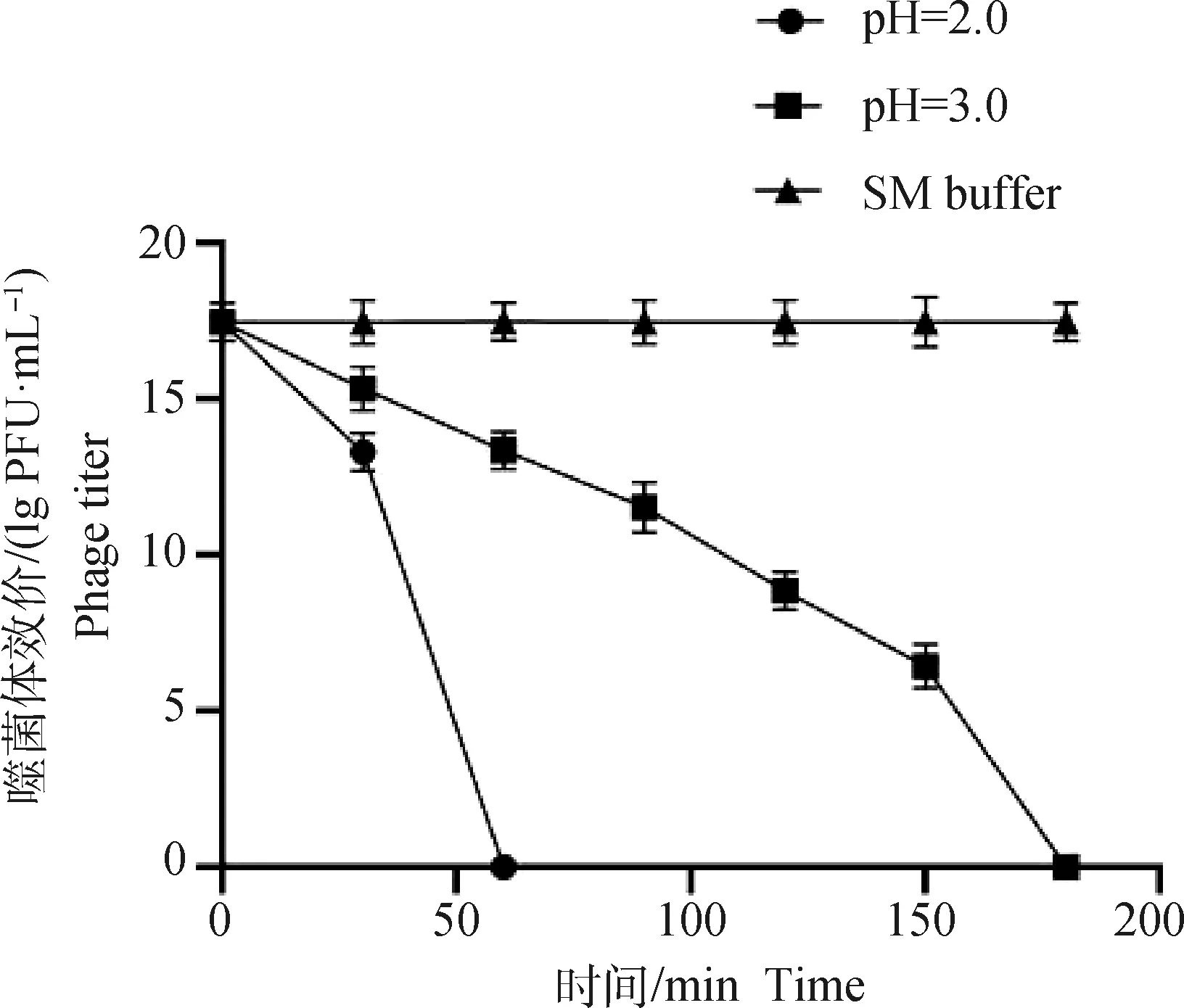
图6 微囊化SP4噬菌体模拟胃液稳定性Fig.6 Stability of microencapsulated SP4 phage simulated gastric juice
2.6 微囊化SP4噬菌体微球在模拟肠液中的释放行为
随着时间的增加,模拟肠液中SP4噬菌体的效价逐渐升高,4 h之后,SP4噬菌体效价基本不变,表明微囊化SP4噬菌体微球中的SP4噬菌体全部释放(图7)。
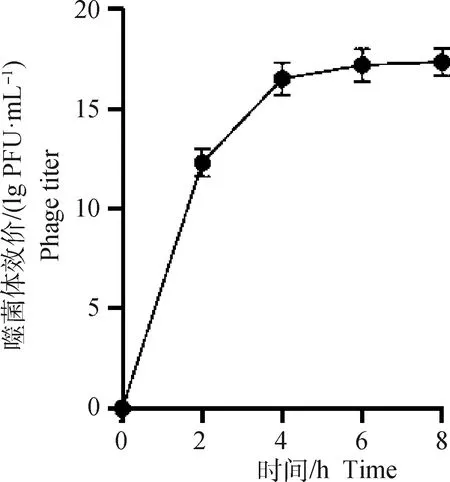
图7 微囊化SP4噬菌体模拟肠液释放曲线Fig.7 Microencapsulated SP4 phage simulated intestinal fluid release curve
2.7 微囊化SP4噬菌体微球的保存稳定性研究
将湿态和干燥微囊化SP4噬菌体微球分别放置25和4 ℃中保存,每隔1周,测定微囊化SP4噬菌体微球效价,微球经干燥后效价略微降低。结果显示,湿态的微囊化SP4噬菌体微球在4 ℃保存时,活性变化不显著,干燥的微囊化SP4噬菌体微球在25和4 ℃中效价均降低,25 ℃时较为明显,表明微囊化SP4噬菌体微球在4 ℃环境下保存具有较好的稳定性(图8)。
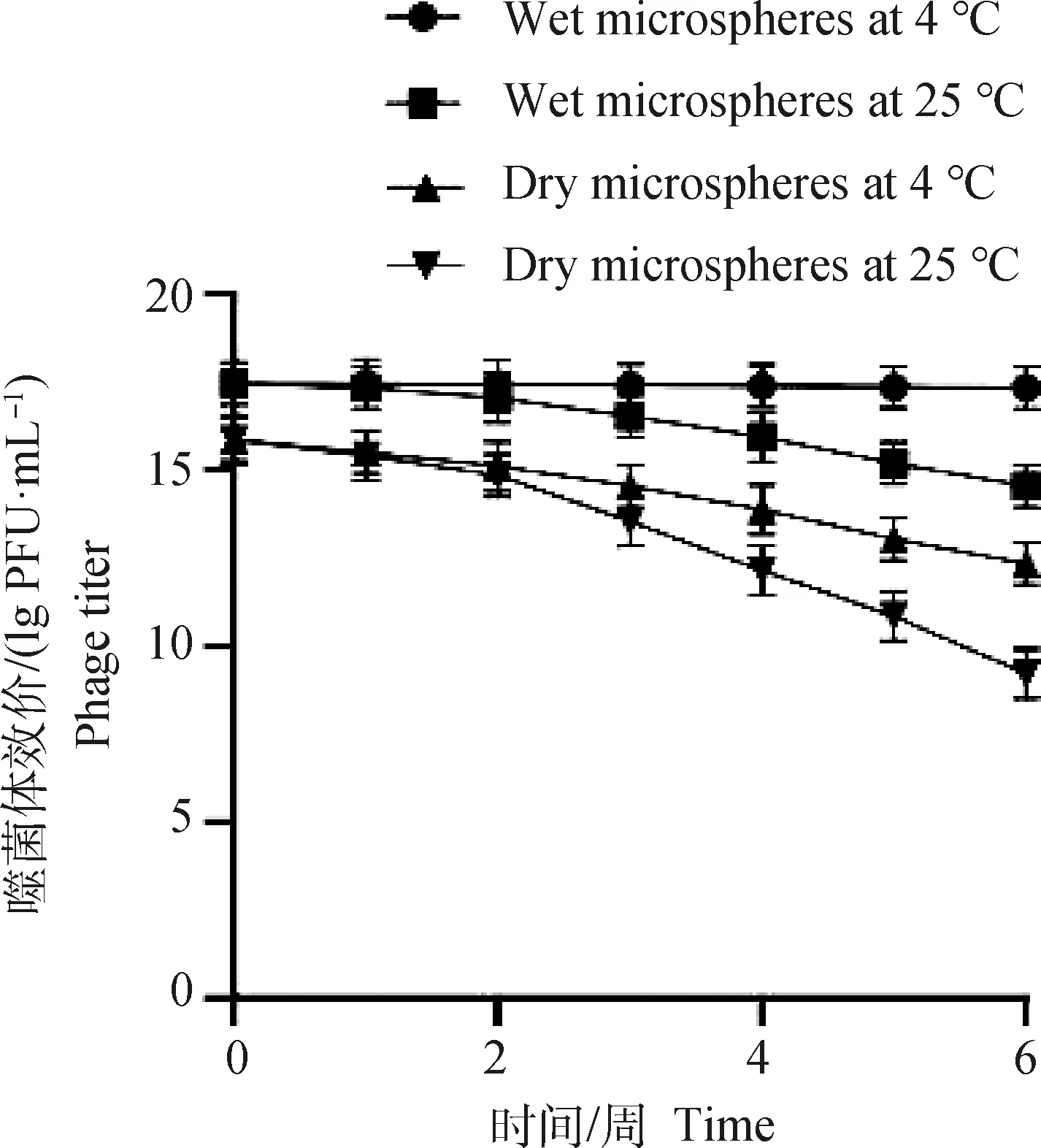
图8 微囊化SP4噬菌体保存稳定性Fig.8 Preservation stability of microencapsulated SP4 phage
3 讨 论
噬菌体应用方式主要以口服为主,国内外大量研究表明,噬菌体通过口服进入,经过胃液作用后,活性降低甚至失活,因此,进入体内的噬菌体能更好发挥杀菌作用,就需要在经过胃液后仍能保持较高的活性,为了能够提高噬菌体的活性,利用微囊化技术对其进行包被成为一种可行方法。
噬菌体直接进行包被其效果并不理想,本试验发现,CES可有效改善这一现象,CES的正电荷和SP4噬菌体的负电荷相互结合,使SP4噬菌体的成分结合更加紧密,能够提高SP4噬菌体微球的稳定性,既利于SP4噬菌体活性的保持,也使SP4噬菌体微球缓慢释放噬菌体,延长SP4噬菌体在肠道杀菌时间。SA和CaCl的体系能够实现对噬菌体的微囊化,主要是由于SA与Ca离子发生反应,形成海藻酸钙聚合物,具有良好的生物降解性和生物相容性,有效地对SP4噬菌体进行微囊化。XG由于其具有较好的大分子特殊结构和胶体特性也常被用作微囊化材料,有文章研究证实,由SA和CaCl制备的微球易出现拖尾现象,形状不规则,根据XG的胶体特性,加入XG与SA之间相互结合,可明显改善此问题并提高包封率。纳米TiO是一种新型纳米材料,性质稳定,本身无毒,可被用于药物的包被材料,韩雪等通过试验证明,纳米TiO可以显著促进噬菌体对受体细菌的侵染效率,显著增加噬菌体在细菌周围的聚集,提高噬菌体的杀菌效果。COS通常是由壳聚糖加工生成,由于其具备较好的相容性、无毒、良好的成膜性,常被用作成膜材料,其效果比壳聚糖更佳,在SA和CaCl反应后,使用COS对微囊化SP4噬菌体微球进行覆膜,既可提高SP4噬菌体微球的稳定性,利于保藏,也不影响微球释放SP4噬菌体。筛选出的这些包被材料价格低廉,简单易得,在生产过程中不需要严苛的生产环境,可以降低生产成本,有利于大规模的工业生产。
在试验期间发现,控制包被材料的浓度至关重要。当SA浓度过小时,混合液过于稀释,不能形成微球,当SA浓度过大时,混合液过于黏稠,不易形成微球。可能是由于SA溶液与SP4噬菌体混合后体系稳定性下降的原因,所以需要用XG和SA进行混合,既能形成形状规则的微球,也能提高微球的包封率。
生物制剂的微囊化包被技术在国内外已相对成熟,马永生等研究表明,噬菌体经过微囊化包被后明显提高了其在强酸中的存活时间,这与本试验结果一致。本研究通过筛选多种不同特性的天然材料组合使用来弥补试验过程中发现的SP4噬菌体包被产生的各项不足之处,进一步完善噬菌体的临床抗菌效果。试验表明,选用的多种天然材料间存在着较好的生物相容性,并对噬菌体包被的不足进行一一完善,效果明显。虽然在pH为2.0和3.0的模拟胃液中长时间时也会失去活性,但有效地延长了SP4噬菌体存活的时间,与未包被的SP4噬菌体相比,SP4噬菌体保留了大量的活性,短时间内效价下降不显著。有研究报道,噬菌体在高温环境下容易失去活性,本研究显示,微囊化SP4噬菌体微球在高温环境下较未包被的噬菌体相比,有效地提高了SP4噬菌体的存活时间。经试验,微囊化SP4噬菌体微球在去离子水中效价不变,证明其在去离子水中不释放。海藻酸钙凝胶具有pH响应特性,在酸性的胃部环境中,海藻酸钙糖链上的羧基被质子化,糖链间发生氢键缔合作用,微球表面形成不溶于水的海藻酸胶,即所谓的海藻酸外壳,凝胶结构不溶胀,可保护被包埋物质免受胃酸和消化酶的破坏;在pH中性的肠道环境中,海藻酸钙凝胶发生溶胀,包埋物向外释放。微囊化SP4噬菌体微球在肠液中释放时,短时间内释放较少,可能是因为仅微球表面少量SP4噬菌体脱离微球,随着时间的增加,微球包被材料与肠液充分反应,微球破裂,SP4噬菌体快速释放。噬菌体微囊化后在临床抗菌应用时不仅要以较高的活性通过胃液进入到肠液中,还要能够在肠液中将噬菌体释放出来,从而达到抗菌的效果,本研究证实,筛选出的微囊化包被材料能够实现这一点,这也是该微囊化噬菌体微球的优势之一。
目前,抗生素的大量使用,导致细菌耐药性愈发严重,噬菌体作为杀菌物质具有很大的优势和应用潜力。本研究将SP4噬菌体进行微囊化包被,对其临床抗菌应用过程中的问题进行研究,以期能在很大程度上弥补抗生素的缺陷,在鸡源细菌防治中起重要的作用。
4 结 论
通过阳离子醚化淀粉/海藻酸钠/黄原胶/纳米TiO/壳寡糖体系的制备方法能够有效地包封SP4噬菌体,包封率较高,包被后酸碱耐受性、热稳定性、模拟胃液稳定性、保存稳定性及模拟肠液释放行为良好。本试验结果为进一步采用多因素试验制备微囊化沙门菌SP4噬菌体奠定了基础。
