青蒿琥酯通过Keap1/Nrf2通路抑制氧化应激改善犬急性肾损伤的体内外分析
2022-08-05朱道仙郝福星傅宏庆
陆 江,朱道仙,刘 莉,郝福星,吴 植,傅宏庆
(1.江苏农牧科技职业学院宠物科技学院,泰州 225300; 2.江苏农牧科技职业学院动物医学院,泰州 225300; 3.江苏省兽用生物制药高技术研究重点实验室,泰州 225300)
近年来,急性肾衰竭已成为危害我国宠物犬猫健康的一种常见病。急性肾损伤(acute kidney injury, AKI)是导致其发生的主要因素,AKI可导致肾功能急剧下降,继而引起代谢产物在体内迅速积聚,水、电解质和酸碱平衡紊乱,出现氮质血症等,病情严重,死亡率高,且目前尚无有效的治疗方法。氧化应激反应是造成急性肾损伤的主要病理因素,其导致的病理损伤贯穿于多种肾病发生、发展的过程中。因而抑制氧化应激反应发展是防治急性肾损伤的关键。Kelch样环氧氯丙烷相关蛋白1/核因子E2相关因子2(Keap1/Nrf2)信号通路可激活下游抗氧化代谢酶靶基因的转录表达,从而提高机体抗氧化能力,减轻氧化应激损伤。
青蒿琥酯(artesunate, ART)是青蒿素的衍生物,是一种安全有效的抗疟药,而且还具有抗氧化应激、抗炎、抗肿瘤及免疫调节等作用。青蒿琥酯可减轻烟草烟雾暴露小鼠肺组织氧化损伤,改善小鼠肺功能。但青蒿琥酯是否可通过抑制氧化应激改善犬急性肾损伤及其作用机制,目前尚未清晰。因此,本研究采用庆大霉素(gentamicin,GM)诱导犬急性肾损伤和MDCK细胞损伤,通过体内外试验观察青蒿琥酯对GM诱导犬急性肾损伤的治疗作用及机制,为临床治疗提供合理用药依据。
1 材料与方法
1.1 实验动物
泰迪型贵宾犬,4岁左右,体重(7±1)kg,雄性,健康状况良好,免疫及驱虫程序齐全,购于江苏农牧科技职业学院宠物美容犬房。实验动物使用许可证为SYXK(苏) 2021-0037。
1.2 细胞株
MDCK(犬肾)细胞(中国科学院上海生命科学研究院细胞库提供)。1基因过表达MDCK细胞由感染转染1质粒的慢病毒而成,记为M-K细胞。Nrf2敲减表达MDCK细胞由转染Nrf2的siRNA(靶序列5′-GACATGGATTTGATTGACATACT-3′)而成,记为M-SiNrf2细胞。M-K细胞和M-SiNrf2细胞基因表达均经RT-qPCR验证。
1.3 试剂
青蒿琥酯及硫酸庆大霉素购自美国Sigma-Aldrich公司。ML385购自上海芮晖化工科技有限公司,活性氧、总过氧化物歧化酶(T-SOD)、丙二醛(MDA)和谷胱甘肽(GSH)检测试剂盒购自南京建成生物工程研究所。兔源抗Kelch样环氧氯丙烷相关蛋白1(Keap1)、核因子E2相关因子2(Nrf2)、血红素氧合酶1(HO1)、谷胱甘肽半胱氨酸连接酶催化亚基(GCLC)和β-actin等抗体及HRP标记山羊抗家兔IgG抗体均购自英国Abcam公司。
1.4 动物试验
1.4.1 试验设计 选取20只泰迪型贵宾犬,以商品化成年犬粮(冠能成年犬犬粮,规格12 kg·袋,雀巢普瑞纳宠物食品有限公司)进行7 d适应性饲喂后,随机等分成4组:对照组(Control)、庆大霉素模型组(GM)、青蒿琥酯治疗组(GM+ART)、青蒿琥酯+ML385干预组(GM+ART+ML385)。除对照组外,其他各组犬参考张萍等方法,每天上午9:00按照40 mg·kg体重肌肉注射庆大霉素,连续5 d,若血清肌酐(Cr)及临床症状无明显变化,则按体重以40 mg·kg间隔12 h重复给药,直至Cr>270 μmol·L,尿素氮(UN)升高,停止用药,犬急性肾损伤模型建立成功。然后,GM+ART组每天按体重以10 mg·kg肌肉注射青蒿琥酯,GM+ART+ML385组每天按体重以10 mg·kg肌肉注射青蒿琥酯的同时注射ML385(30 mg·kg),GM组和Control组注射等量生理盐水作为对照。第12天时,停止给药。在整个试验过程中,一犬一笼进行饲喂管理,每天上午09:00和下午16:00各喂食1次,且每天在宠物训练场自由活动15 min,此外所有的犬可自由饮水。
1.4.2 血清肾功能生化指标测定 分别于试验前第0天及试验第3、6、9与12天的上午8:00,空腹采血并制备血清,用生化分析仪测定血清肌酐(Cr)和尿素氮(UN)含量,按ELISA试剂盒(上海联迈生物工程有限公司)操作说明测定肾损伤因子-1(KIM-1)含量。
1.4.3 肾组织中氧化应激水平测定 试验结束时,各组随机选取3只犬用10%氯化钾注射液静脉推注致死,分别取右侧肾组织0.2 g,加入1 mL RIPA裂解液和蛋白酶抑制剂,在冰盒上用玻璃匀浆器研磨,12 000 r·min离心15 min,取上清液提取总蛋白,-80 ℃保存备用。按照试剂盒的步骤使用酶标仪在550 nm处通过比色法测定肾组织匀浆中总超氧化物歧化酶(T-SOD)、丙二醛(MDA)和谷胱甘肽(GSH)水平。
1.4.4 Western blot检测肾组织中Kelch样ECH相关蛋白1(Keap1)、核因子E2相关因子2(Nrf2)及谷胱甘肽半胱氨酸连接酶催化亚基(GCLC)蛋白表达 取“1.4.3”中肾组织匀浆上清液,BCA法测定蛋白浓度,然后用10%的SDS-PAGE电泳胶将蛋白样品进行电泳分离,再转印至PVDF膜上,分别加入Keap1(1∶1 000)、Nrf2(1∶1 000)、GCLC(1∶500)、和β-actin(1∶1 000)抗体在4 ℃摇床中孵育过夜。次日,加山羊抗家兔IgG抗体(1∶5 000)室温下孵育1 h后,在化学发光成像仪中显影成像。以β-actin为内参,采用Image J分析软件对各组条带的光密度值进行测定,以对照组数值为标准化进行分析。试验重复3次,取平均值。
1.5 细胞试验
1.5.1 细胞培养 将MDCK细胞接种于DMEM培养基,置于5% CO培养箱中37 ℃培养,定时换液,待细胞密度达90%后用0.25%胰蛋白酶进行细胞消化、传代处理。细胞融合至80%时,即为处于对数生长期的待试验细胞。
1.5.2 细胞MTT活性检测 取“1.5.1”中的细胞,按每孔100 μl接种于96孔培养板中。然后分成对照组(加等量PBS)、GM试验组(分别加入1.0、2.0、4.0、8.0 mmol·LGM)、ART试验组(0.5、5.0、50.0 μmol·LART)。培养24 h后,按20 μL·孔加入MTT继续培养4 h,然后弃去培养液,加入200 μl DMSO工作液,震荡10 min充分混匀,570 nm处测定各孔A值。每组设置6次重复,计算细胞增殖率=A试验/A对照×100%。
1.5.3 ART对GM诱导的MDCK细胞的影响 取“1.5.1”中的细胞,按每孔100 μL接种于96孔培养板中。然后分成对照组(加等量PBS)、GM对照组(加4.0 mmol·LGM)、GM+低剂量ART干预组(4.0 mmol·LGM+0.5 μmol·LART)和GM+高剂量ART干预组(4.0 mmol·LGM+50.0 μmol·LART),共培养24 h,每组设置6次重复,用于后续试验。细胞活性检测方法同“1.5.2”。
1.5.4 活性氧(ROS)检测 将“1.5.3”中细胞加入DCF-DA工作液,按照DCF-DA检测试剂盒说明进行,然后用荧光显微镜观察荧光强度,以对照组为标准化,利用Image J分析。
1.5.5 T-SOD及GSH检测 将“1.5.3”中细胞用300 μL细胞裂解液,4 ℃ 12 000 r·min离心10 min,收集上清用BCA法测定蛋白含量,参照T-SOD和GSH试剂盒说明书进行T-SOD及GSH检测。
1.5.6 qRT-PCR检测 取“1.5.3”中细胞,用TRIzol法提取细胞总RNA,通过逆转录合成cDNA 并用于实时荧光PCR扩增。靶基因的引物由上海生工生物工程有限公司合成(表1)。以β-肌动蛋白(β-actin) 为内参基因,PCR扩增35个循环:95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s。每个样本进行3次平行,以对照组表达量进行归一化处理,目的基因 mRNA 的相对表达量用 2-ΔΔ法计算。

表1 荧光定量PCR引物序列Table 1 Primer sequences for quantitative real-time PCR
1.5.7 Western blot检测 收集“1.5.3”中细胞,经胰酶消化后,加入含蛋白酶抑制剂的细胞裂解液,冰上裂解 30 min后,再4 ℃以12 000 r·min离心 10 min,收集上清,BCA法检测蛋白浓度。将各组蛋白浓度调至一致,置于-80 ℃备用。然后用Western blot检测相关蛋白表达,方法同“1.4.4”。
1.6 细胞验证试验
将MDCK、M-K与M-SiNrf2细胞分别接种于96孔培养板中,每孔100 μL。每种细胞分成3组,对照组(加等量PBS)、GM组(加4.0 mmol·LGM),ART组(加4.0 mmol·LGM和50.0 μmol·LART),每组设置6次重复,共育24 h,用于后续试验。然后,用MTT法检测细胞活性,“1.5.3”方法检测细胞活性氧(ROS),Western blot法检测Keap1/Nrf2通路相关蛋白表达。
1.7 数据分析
试验数据以(“平均数±标准差”)表示,两组间数据采用SPSS 23.0进行检验比较,<0.05表示差异显著,<0.01表示差异极显著。
2 结 果
2.1 ART对GM诱导犬急性肾损伤的影响
由图1可知,与对照组比较,GM组的血清Cr、UN及KIM-1水平逐渐升高;GM+ART组和GM+ART+ML385组血清Cr、UN及KIM-1水平前6 d逐渐升高,然后呈降低趋势;第12天时,GM+ART组的Cr、UN及KIM-1水平均极显著低于GM组,说明ART可以改善GM诱导犬急性肾损伤的肾功能,但给予Nrf2抑制剂ML385后可减弱这些变化(<0.01,图1A、B、C)。与GM组及GM+ART+ML385组比较,GM+ART组肾组织中GSH水平升高(<0.01,图1D),T-SOD活性升高(<0.01,图1E),MDA水平降低(<0.01,图1F),说明ART提高了GM诱导犬急性肾损伤肾抗氧化能力,这种作用可被ML385逆转。与GM组比较,GM+ART组肾组织中Keap1蛋白表达下调(<0.05),Nrf2及GCLC蛋白表达上调(<0.01);与GM+ART组比较,GM+ART+ML385组肾组织中Nrf2及GCLC蛋白表达下调(<0.01,图1G、H)。
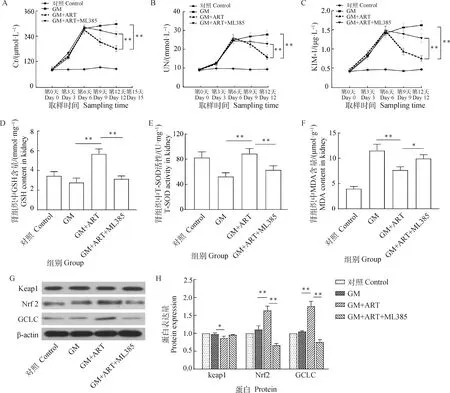
A、B、C分别为血清中Cr、UN及KIM-1含量;D、E、F分别为肾组织中GSH含量、T-SOD活性及MDA含量;G、H为Keap1、Nrf2及GCLC的Western blot 结果。*.P<0.05;**.P<0.01,下同A, B and C. The content of Cr, UN and KIM-1 in serum; D, E and F. The GSH content, T-SOD activity and MDA content in kidney; G and H. Western blot results of Keap1, Nrf2 and GCLC. *.P<0.05;**.P<0.01, the same as below图1 ART改善GM诱导犬急性肾损伤的肾功能、降低肾组织的氧化应激水平并激活Keap1/Nrf2通路Fig.1 ART improved renal function, reduce oxidative stress and activate Keap1/Nrf2 pathway in acute kidney injury induced by GM
2.2 ART对GM胁迫下MDCK细胞活性的影响
由图2可知,GM浓度在1.0~8.0 nmol·L时,与对照组比较,随着GM水平增加,MDCK增殖率逐渐降低(图2A),而ART对MDCK增殖率无显著影响(图2B)。当加入4.0 mmol·LGM后,MDCK细胞增殖率降低,同时,加入ART后,可提高细胞增值率,呈剂量依赖关系,以50.0 μmol·LART效果最佳(图2C)。
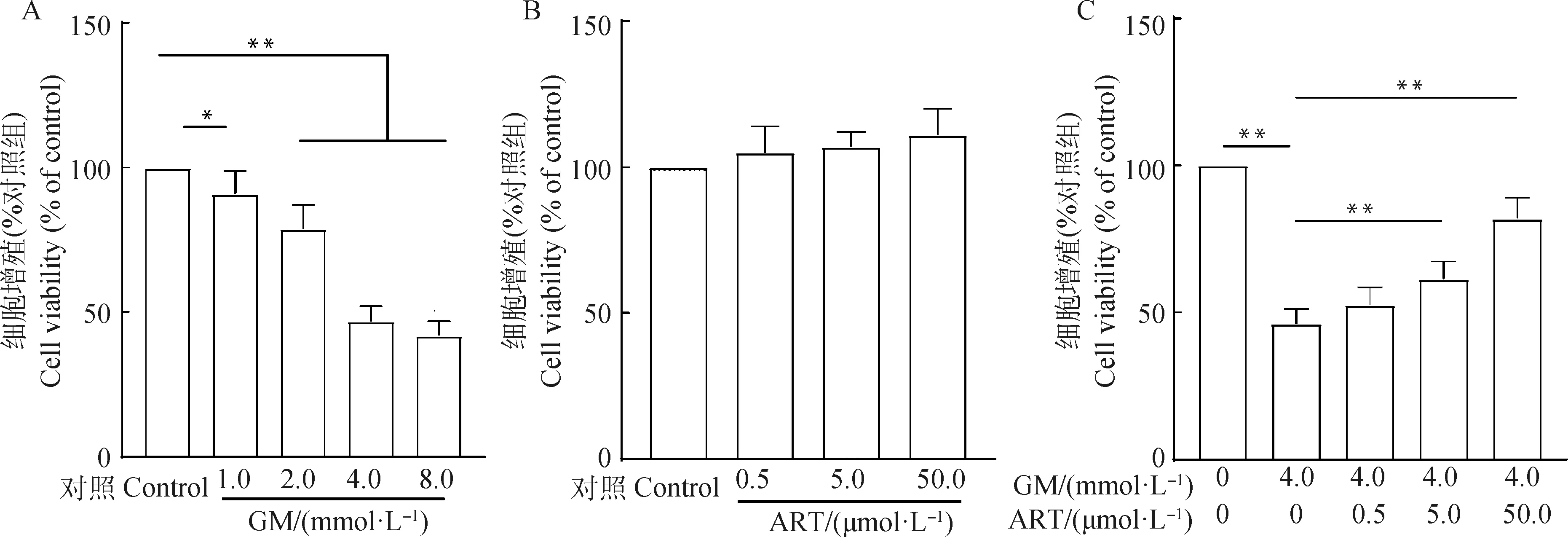
A.GM对MDCK细胞增殖影响;B.ART对MDCK细胞增殖影响;C.GM+ART对MDCK细胞增殖影响A.Effect of GM on viability of MDCK cell; B.Effect of ART on viability of MDCK cell; C.Effect of GM+ART on viability of MDCK cell图2 ART提高GM胁迫下MDCK细胞的活性Fig.2 ART improved the activity of MDCK cells under GM stress
2.3 ART对GM诱导MDCK细胞氧化应激的影响
GM能导致细胞ROS水平显著升高,与GM组(4.0 mmol·L)比较,加入低剂量ART(5.0 μmol·L) 及高剂量ART(50.0 μmol·L)均可使绿色荧光显著降低(<0.01,图3A、B)。说明ART能够抑制GM诱导MDCK细胞产生ROS。与对照组(未加GM和ART)比较,GM组的T-SOD活性及GSH含量升高(<0.05);与GM组比较,GM+高剂量ART组的T-SOD活性及GSH含量进一步升高(<0.05,<0.01,图3C、D)。
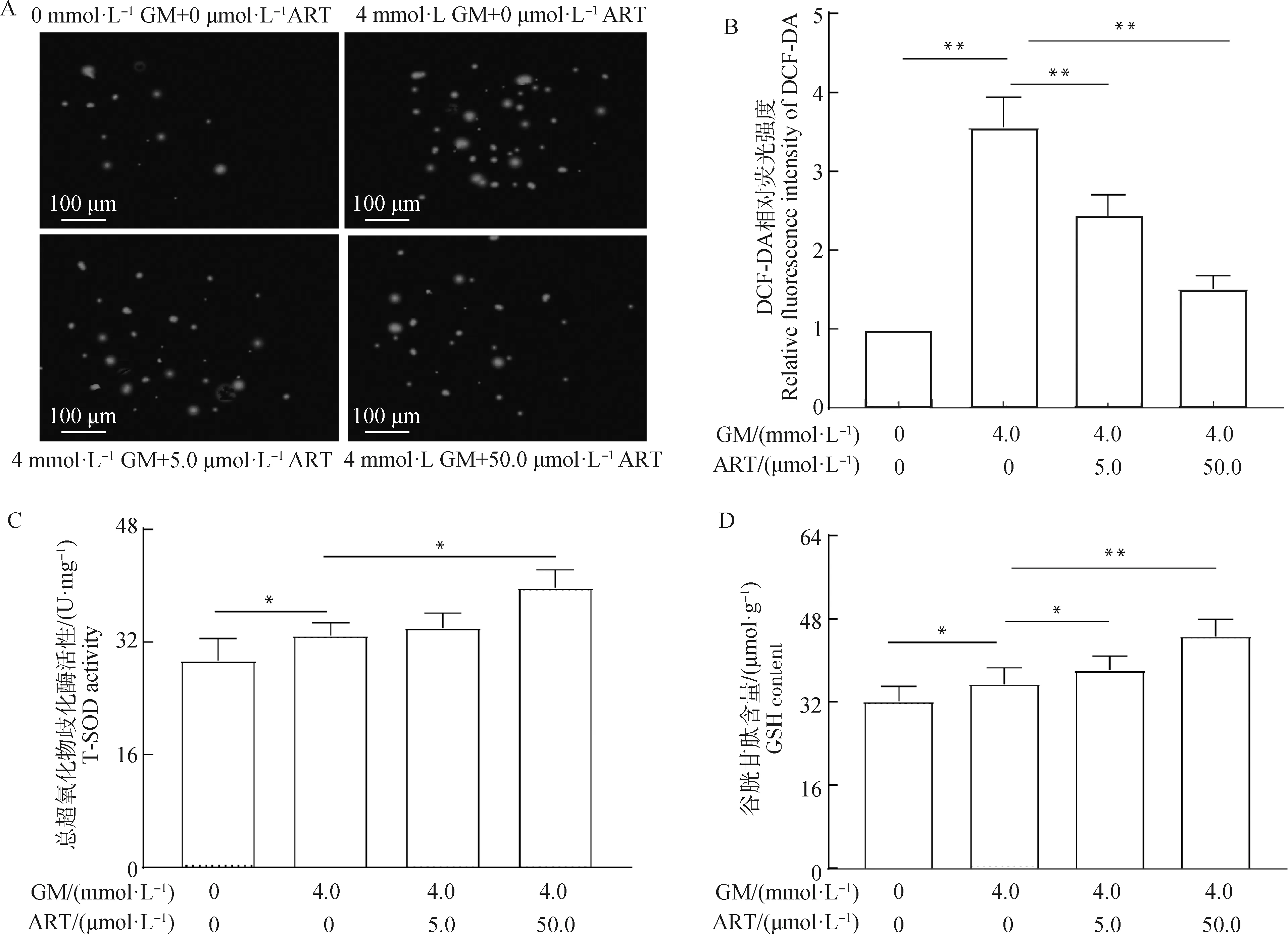
A.DCF-DA荧光染色结果;B.DCF-DA荧光染色强度;C.T-SOD活性;D.GSH含量A.the results of DCF-DA fluorescence staining; B.fluorescence intensity of DCF-DA; C.T-SOD activity; D.GSH content图3 ART提高GM胁迫下MDCK细胞的抗氧化应激能力Fig.3 ART enhanced the antioxidant capacity of MDCK cells under GM stress
2.4 ART对GM胁迫下MDCK细胞Keap1/Nrf2通路的影响
与对照组比较,GM组1基因mRNA表达显著下调,2、1及基因mRNA表达显著上调(<0.05);与GM组比较,GM+高剂量ART组(GM+50.0 μmol·LART)1基因mRNA表达显著下调(<0.05),2、1及基因mRNA表达显著上调(<0.01),GM+低剂量ART组(GM+5.0 μmol·LART)2和1基因mRNA表达显著上调(<0.05),见图4A。与对照组比较,GM组Keap1蛋白表达显著下调,Nrf2、HO1及GCLC蛋白A表达显著上调(<0.05);GM组比较,GM+高剂量ART组和GM+低剂量ART组Keap1蛋白表达均显著下调(<0.05),Nrf2、HO1及GCLC蛋白表达显著上调(<0.01,<0.05,图4B、C、D、E、F)。

A. Keap1、Nrf2、HO1及GCLC的mRNA相对表达量;B. Keap1、Nrf2、HO1及GCLC蛋白Western blot结果;C、D、E及F.Keap1、Nrf2、HO1及GCLC相对表达量A. The relative mRNA expression levels of Keap1, Nrf2, HO1 and GCLC; B. Western blot analysis of Keap1, Nrf2, HO1 and GCLC; C, D, E and F. Relative expression levels of Keap1, Nrf2, HO1 and GCLC, respectively图4 ART对GM胁迫下MDCK细胞Keap1/Nrf2通路相关分子表达的调节Fig.4 Regulation of ART on the expression related molecules of Keap1/Nrf2 pathway in MDCK cells under GM stress
2.5 抑制Keap1/Nrf2通路减弱ART对GM胁迫下MDCK细胞的保护作用
与MDCK细胞比较,M-K细胞Keap1基因mRNA表达显著上调(<0.01),M-SiNrf2细胞Nrf2基因mRNA表达显著下调(<0.01,图5A),这说明M-K细胞过表达Keap1,M-SiNrf2细胞敲低Nrf2表达是成功的。由图5B可知,在MDCK细胞中,与GM组比较,GM+ART组细胞增殖率显著升高,而在M-K细胞和M-SiNrf2细胞中无显著差异。在MDCK细胞中,GM+ART组DCF-DA荧光强度显著低于GM组,而在M-K细胞和M-SiNrf2细胞中,GM+ART组细胞增殖率与GM组无统计学差异(图5C)。在MDCK细胞中,与GM组比较,GM+ART组Keap1蛋白表达下调,Nrf2、HO1及GCLC蛋白表达上调(<0.01),而在M-K细胞和M-SiNrf2细胞中GM组与GM+ART组各蛋白表达无统计学差异;在相同处理下(GM+ART),与MDCK细胞比较,M-K细胞和M-SiNrf2细胞Keap1蛋白表达上调,Nrf2、HO1及GCLC蛋白表达下调(<0.05,图5D、E、F、G、H)。这说明过表达Keap1和敲低Nrf2,可减弱ART对GM胁迫下MDCK细胞的保护作用。

A. Keap1及Nrf2的mRNA相对表达量;B. 细胞增殖;C. DCF-DA相对荧光强度;D. Keap1、Nrf2、HO1及GCLC蛋白Western blot结果;E、F、G及H.Keap1、Nrf2、HO1及GCLC相对表达量A. The relative mRNA expression levels of Keap1 and Nrf2; B. Cell viability; C. Fluorescence intensity of DCF-DA; D. Western blot analysis of Keap1, Nrf2, HO1 and GCLC; E, F, G and H. Relative expression levels of Keap1, Nrf2, HO1 and GCLC, respectively图5 抑制Keap1/Nrf2通路减弱ART对GM胁迫下MDCK细胞的保护作用Fig.5 Inhibition of Keap1/Nrf2 pathway attenuates the protective effect of ART on MDCK cells under GM stress
3 讨 论
ROS作为氧化应激反应的核心分子,参与细胞坏死、凋亡及自噬,过量ROS会造成组织氧化损伤、炎症、纤维化等,是多种疾病发生的主要原因。庆大霉素可以导致多种细胞的ROS过量产生,诱导氧化应激反应而发生损伤。本研究细胞试验结果显示,GM可导致MDCK细胞ROS水平升高,细胞增殖率降低,ART可降低GM诱导MDCK细胞ROS水平,提高细胞增殖率;动物试验结果也表明,GM可引起犬肾组织T-SOD及GSH等抗氧化物质减少,脂质过氧化中间产物MDA增多,血中肾功能指标Cr、UN及KIM-1水平均升高,给予ART可提高GM诱导急性肾损伤犬抗氧化能力,降低血中肾功能指标水平。KIM-1是一种上皮细胞的黏附因子,已成为肾损伤的早期诊断指标。说明青蒿琥酯对GM引起犬急性肾损伤具有保护作用,可能与抑制氧化应激有关。
Keap1/Nrf2信号通路在氧化应激反应中发挥重要的作用。在正常生理状态下,Nrf2与Keap1以复合物形式存在于细胞质内,维持低含量非活性的稳定状态。激活后,Nrf2从Keap1上解离,进入细胞核,激活下游HO1、GCLC及COX-2等多种把基因的表达。HO1可以减轻血红素介导氧化应激,是一种抗氧化损伤的重要防御性因子。GCLC是谷氨酸-半胱氨酸连接酶(GCL)的亚基,通过调节GSH的表达,发挥抗氧化作用。小鼠铅中毒时,肝肾组织中1 mRNA水平显著提高,2和-1 mRNA水平降低,表明铅暴露会干扰Nrf2通路,抗氧化能力受到抑制,引起肝、肾损伤;灌胃柴胡多糖可激活Nrf2通路,通过激活Keap1 / Nrf2 / HO-1途径,并降低炎症程度来预防肝、肾损伤。有研究表明,2基因的缺失加重单侧输尿管梗阻所致的肾组织损伤和肾纤维化进程。还有研究发现,5/6肾切除大鼠残余肾组织中Nrf2及其靶基因的表达显著下调,并出现肾间质纤维化及炎症反应。本研究结果表明,无论是实验犬还是MDCK细胞,GM都能引发氧化应激反应,当用ART处理后,能够激活Keap1/Nrf2信号通路,提高下游抗氧化靶基因表达,使机体的T-SOD、GSH等抗氧化物质含量增高,显著改善了GM引起的氧化应激反应。提示青蒿琥酯可能通过激活Keap1/Nrf2信号通路抑制氧化应激来改善GM诱导犬急性肾损伤。
为了进一步验证这一机制,本研究分别在动物水平和细胞水平进行了Keap1/Nrf2信号通路阻断试验。在GM诱导急性肾损伤动物模型中,发现与给予ART组比较,给予试验犬ART同时加入Nrf2抑制剂ML385后Nrf2及其调控下游抗氧化代谢酶HO1和GCLC蛋白表达下调,肾组织抗氧化应激能力降低,T-SOD和GSH水平降低,MAD水平升高。说明抑制Nrf2表达,可降低ART对GM诱发犬急性肾损伤的保护作用。与MDCK细胞比较,在过表达Keap1和敲减Nrf2表达的MDCK细胞中,Nrf2及其下游抗氧化代谢酶HO1和GCLC表达下调,ART抗GM诱导细胞氧化应激能力也显著减弱。说明抑制Keap1/Nrf2信号通路可减弱青蒿琥酯对MDCK细胞抗氧化能力。
4 结 论
青蒿琥酯可以通过激活Keap1/Nrf2通路,上调下游靶基因抗氧化代谢酶HO1及GCLC等分子表达,抑制氧化应激反应,在庆大霉素诱导急性肾损伤进程中具有良好的保护效应。为青蒿琥酯在临床上防治犬急性肾损伤的应用提供科学依据。
