猪丁型冠状病毒S1-CTD相互作用宿主蛋白的筛选和鉴定
2022-08-05汤荣锋范前进郭龙军时洪艳陈建飞
汤荣锋,范前进,郭龙军,张 鑫,石 达,时洪艳,陈建飞,冯 力
(中国农业科学院哈尔滨兽医研究所,兽医生物技术国家重点实验室/猪消化道传染病创新团队,哈尔滨 150069)
猪丁型冠状病毒(porcine deltacoronavirus, PDCoV)是一种引起仔猪腹泻的猪肠道冠状病毒,属于δ冠状病毒属,是具有囊膜的单股正链RNA病毒。最早于2012年在中国香港被报道,随后在美国、韩国等多地暴发。中国多个省份相继报道和分离了多株PDCoV。PDCoV全基因组约为25.6 kb,编码4种结构蛋白(纤突蛋白S、膜蛋白M、包膜蛋白E和核衣壳蛋白N)以及3种辅助蛋白(NS6、NS7和NS7a)。结构蛋白S蛋白包括S1和S2两个亚基,S1介导病毒与细胞受体结合,包括C端结合域(S1-CTD)和N端结合域(S1-NTD)两个亚基,S1-CTD能识别蛋白质受体充当主要的受体结合域,S1-NTD能识别多糖作为其潜在受体,S2介导膜融合的过程。S蛋白通过和宿主蛋白相互作用在病毒入侵和感染过程中发挥重要作用,近年来的研究表明S蛋白能与猪氨基肽酶N(pAPN)互作,通过内吞途径介导病毒入侵宿主细胞,pAPN与PDCoV感染息息相关,是病毒入侵的主要功能性受体。目前,对其他PDCoV S蛋白相互作用的宿主蛋白研究仍然较少。综合S1-CTD在病毒受体识别过程中的重要作用,以及能诱导产生中和抗体的作用,本研究着眼于筛选和鉴定S1-CTD的相互作用宿主蛋白。筛选到的驱动蛋白结合蛋白(KIFBP)与多种驱动蛋白相互作用,通过与驱动蛋白结合调节蛋白活性,阻断驱动蛋白和微管骨架的相互作用,如和KIF1A结合阻断突触小泡的运输,调控KIF18A活性调节微管动力学。KIFBP具有621个氨基酸,包括2个四肽重复序列,在中枢神经系统和肠道神经系统中表达。它参与轴突的结构和生长,微管动力学和货物运输,并通过结合各种微管相关蛋白发挥作用。其与S1-CTD相互作用的研究有助于了解PDCoV的作用机制。
1 材料与方法
1.1 主要实验材料
猪睾丸细胞(ST)、人胚胎肾细胞(HEK-293T)和猪回肠上皮细胞(IPI-2I)由本实验室冻存;PDCoV NH毒株由本实验室分离保存;pAAV-IRES-heGFP、pCAGGS-HA和pCMV-Myc真核表达质粒由本实验室保存;DH5α感受态细胞由本实验室制备保存。DMEM培养基、Anti-Flag M2 Affinity Gel蛋白纯化试剂盒、Anti-Flag鼠单抗、兔抗HA标签抗体购自Sigma-Aldrich(上海);Alexa Fluor 633 Goat anti-Mouse IgG和Alexa Fluor 594 Goat anti-Rabbit IgG购自Thermo公司;胎牛血清购自Gibco公司;HⅠ、Ⅰ和RⅠ限制性内切酶、ExDNA聚合酶、T4 DNA连接酶购自美国NEB公司;RNAiso Plus、反转录试剂盒和TB Green Premix ExII购自TaKaRa公司;Transmembrane protein Extraction kit购自Mock公司;X-treme GENE HP DNA转染试剂购自德国Roche公司。
1.2 S1-CTD真核表达质粒的构建及表达
根据报道的CTD片段区域,利用SnapGene设计引物(表1),扩增S1-CTD片段,用试剂盒回收目的基因后,用HⅠ和Ⅰ双酶切后与相同酶切处理的pAAV-IRES-heGFP载体连接,转化DH5α感受态细胞,提取质粒后进行双酶切鉴定,并由吉林省库美生物科技有限公司测序鉴定。将重组质粒pAAV-S1-CTD-Flag转染HEK-293T细胞,转染pAAV-IRES-heGFP空载体作为阴性对照,48 h后收集细胞裂解,取上清,用Anti-Flag M2 Affinity Gel蛋白纯化试剂盒进行纯化,用Anti-Flag鼠单抗作为一抗,SDS-PAGE和Western blot鉴定重组质粒的表达。

表1 PCR扩增的引物序列Table 1 Sequence of PCR primers
1.3 宿主膜蛋白提取
猪回肠上皮细胞(IPI-2I)培养于75 cm细胞培养瓶中,待细胞长满单层,用Transmembrane protein Extraction kit提取细胞膜蛋白。用细胞刮刮取下细胞,用PBS洗3次后离心移去上清,加入1 mL Extraction Buffer1+5 μL蛋白酶抑制剂于4 ℃孵育10 min,之后4 ℃ 1 000 r·min离心5 min去除浮层,再加入0.2 mL Extraction 2A+5 μL蛋白酶抑制剂室温孵育45 min后4 ℃ 12 000 r·min离心15 min,将富含膜蛋白的上清液收集,-20 ℃保存备用。
1.4 免疫共沉淀筛选S1-CTD互作宿主蛋白
将提取的宿主膜蛋白和真核表达的S1-CTD诱饵蛋白4 ℃共孵育4 h,加入Anti-Flag M2 Affinity Gel再次4 ℃共孵育4 h,孵育结束后4 ℃ 离心收集树脂,用TBS洗涤液洗涤树脂5次,将样品进行SDS-PAGE分析,SDS-PAGE蛋白胶用考马斯亮蓝染色,脱色后将样品切胶送上海厚基生物有限公司进行Pull-down质谱分析,比对猪源蛋白数据库筛选出宿主蛋白。
1.5 宿主蛋白真核表达质粒的构建和表达
从GenBank数据库中检索猪源基因,使用SnapGene设计引物(表1)。用RNAiso Plus提取IPI-2I细胞总RNA,经反转录合成cDNA,以此为模板扩增猪源基因,经RI和I双酶切与相同酶切处理的载体pCAGGS-HA连接,转化鉴定阳性质粒,送吉林省库美生物科技有限公司测序鉴定。将重组真核表达质粒转染HEK-293T细胞,48 h后收集细胞样品处理,以兔抗HA标签抗体作为一抗, Western blot分析宿主蛋白表达。
1.6 S1-CTD与宿主蛋白相互作用
将宿主蛋白真核表达质粒和pAAV-S1-CTD-Flag共转染HEK-293T细胞,同时将宿主蛋白表达质粒和pAAV-IRES-heGFP空载体共转染,以及pAAV-S1-CTD-Flag和pCAGGS-HA空载体共转染作为对照。转染48 h后,收集细胞裂解液样品。将裂解液与Anti-Flag M2 Affinity Gel在4 ℃孵育12 h后,3 000 r·min离心3 min,分离树脂和上清,用TBS洗涤树脂3次,将所有Co-IP样品,以及裂解液原液加入2×SDS-PAGE上样buffer,进行Western blot检测。
1.7 S1-CTD与KIFBP共定位
根据免疫共沉淀的结果进一步验证S1-CTD和KIFBP是否存在共定位。将pCAGGS-KIFBP-HA和pAAV-S1-CTD-Flag真核表达质粒分别转染宿主细胞IPI-2I和ST细胞,用Anti-Flag鼠单抗和Anti-HA兔多抗作为一抗,通过间接免疫荧光验证S1-CTD和KIFBP在宿主细胞中的表达。之后将IPI-2I细胞培养于激光共聚焦专用培养皿中,在细胞密度较低时将pAAV-S1-CTD-Flag + pCAGGS-KIFBP-HA共转染,同时共转染pAAV-S1-CTD-Flag + pCAGGS-HA空载体和pCAGGS-KIFBP-HA + pAAV-IRES-heGFP空载体作为对照。24 h后固定细胞,室温透膜20 min,5%脱脂乳封闭1 h,用Anti-Flag鼠单抗和Anti-HA兔多抗作为一抗共同孵育1 h,PBST洗3次,Alexa Fluor 633 Goat anti-Mouse IgG和Alexa Fluor 594 Goat anti-Rabbit IgG作为二抗孵育1 h,PBST洗3次后用DAPI染核,激光共聚焦显微镜观察结果。
1.8 KIFBP过表达对病毒的影响
IPI-2I细胞和ST细胞培养于6孔板中,待细胞形成单层时,转染重组质粒pCAGGS-KIFBP-HA和作为阴性对照的pCAGGS-HA空载体,24 h后弃掉培养液,用PBS洗3次,PDCoV NH株感染细胞,37 ℃ 作用1 h后,弃掉培养液并用PBS洗3次后每孔加入2 mL维持液。在感染后12、18和24 h收集上清和细胞。收集后的上清测定病毒滴度,收集的细胞如前所述提取细胞总RNA,反转录为cDNA,按照TB Green Premix ExII相对定量PCR方法对mRNA水平进行差异分析,检测基因PDCoV引物和内参基因-引物如表2。
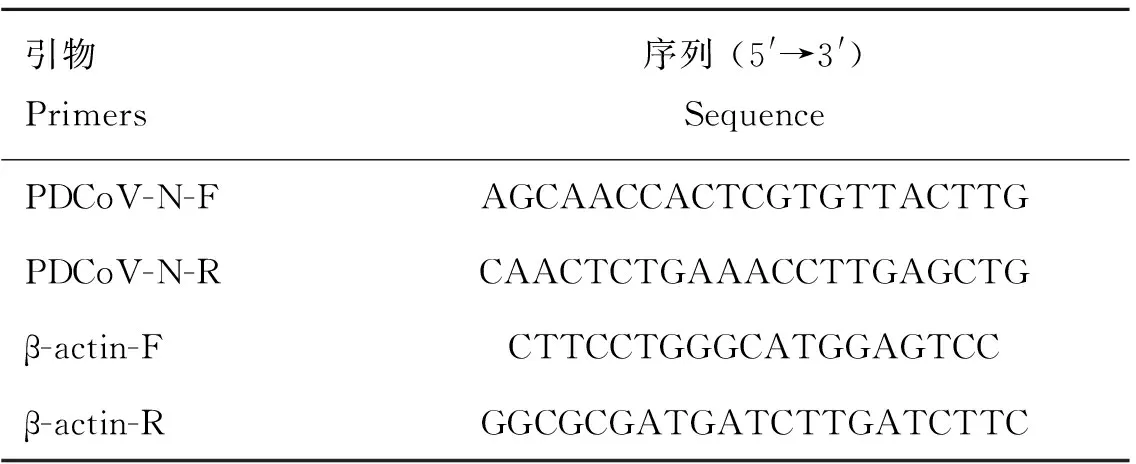
表2 荧光定量PCR的引物序列Table 2 Sequence of qPCR primers
2 结 果
2.1 S1-CTD基因克隆及真核表达
以优化的NH株基因为模板,以1-CTD-F和1-CTD-R扩增1-CTD片段,连接后筛选重组质粒进行双酶切鉴定,经1%琼脂糖凝胶电泳检测,结果显示,可见6 100和1 205 bp的2条片段,与预期大小一致(图1A),进一步测序结果正确,将重组质粒命名为pAAV-S1-CTD-Flag。将重组质粒转染HEK-293T细胞,48 h后收集细胞,裂解后Western blot验证重组蛋白成功表达,大小为58 ku(图1B)。
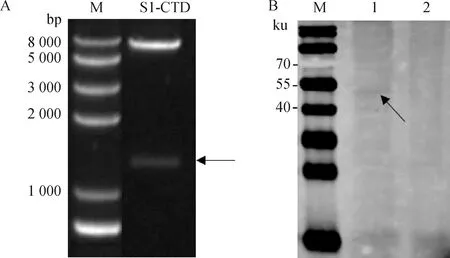
A. pAAV-S1-CTD-Flag双酶切鉴定结果; B. Western blot 鉴定S1-CTD表达(M. 蛋白质相对分子质量标准; 1. S1-CTD蛋白; 2. pAAV-IRES-heGFP空载体对照)A. Restriction enzymes digestion of pAAV-S1-CTD-Flag; B. Identification of S1-CTD expression by WB (M. Protein marker; 1. S1-CTD; 2. Black control)图1 S1-CTD质粒构建及表达Fig.1 Construction and expression of S1-CTD plasmid
2.2 S1-CTD互作蛋白的筛选
SDS-PAGE脱色后,免疫沉淀的蛋白条带和阴性对照无肉眼可见差异,切胶送上海厚基生物有限公司进行质谱鉴定,通过检索猪源蛋白数据库比对,去掉空白对照的阴性结果后,共筛选到32个疑似相互作用的宿主蛋白,部分结果如表3,选取其中最可能与S1-CTD相互作用宿主蛋白进行了验证。
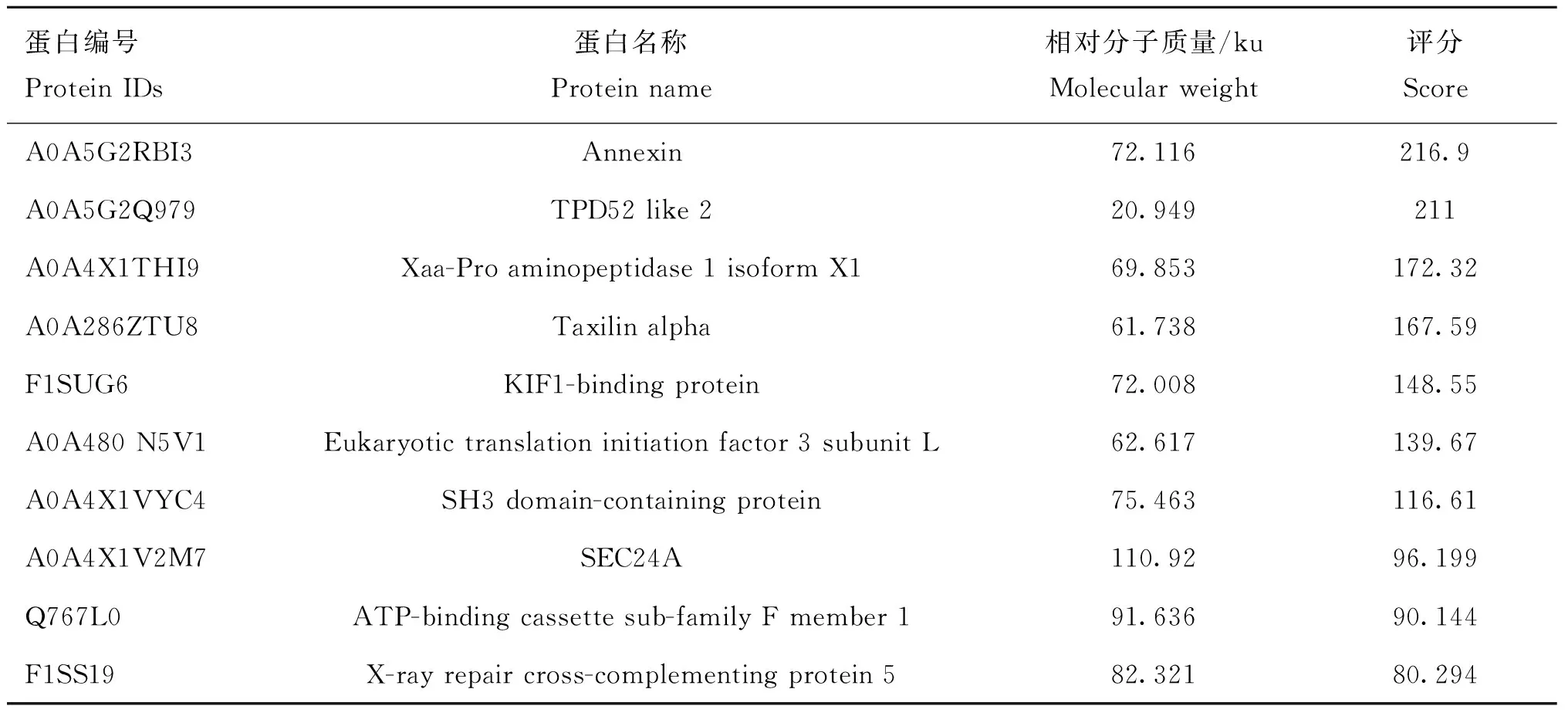
表3 质谱分析部分结果Table 3 Partial results of MS
2.3 KIFBP基因克隆及真核表达
用表1的引物扩增获得的猪源基因与载体pCAGGS-HA连接,筛选重组质粒进行双酶切鉴定,结果显示目的基因大小与预期相符(图2A),经测序鉴定目的基因没有突变、缺失。将构建成功的宿主基因真核表达质粒转染HEK-293T细胞48 h后收取细胞裂解,Western blot鉴定宿主蛋白成功表达,大小与预期结果相符(图2B)。
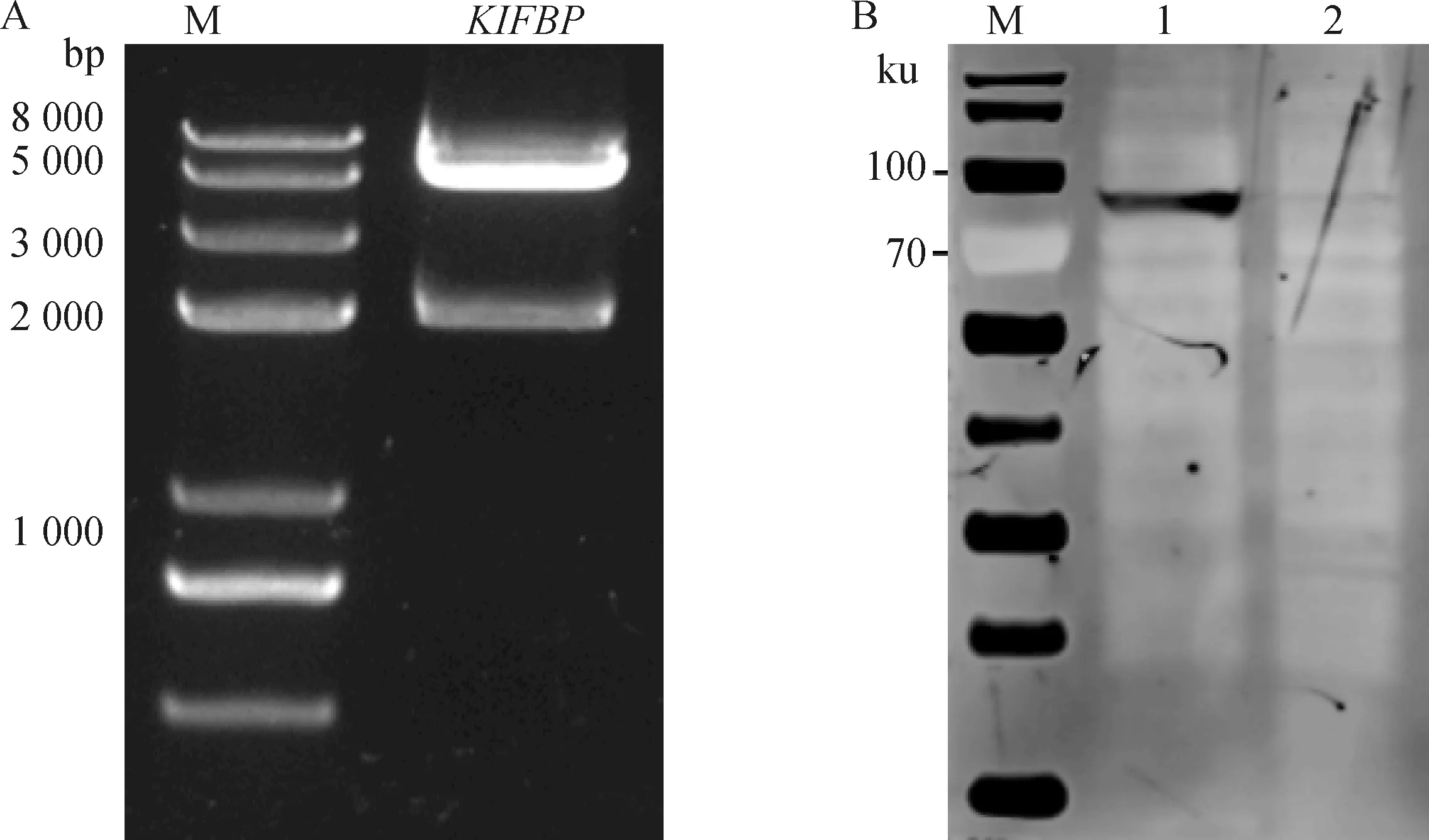
A. 宿主基因重组质粒的双酶切鉴定; B. Western blot鉴定宿主基因的表达(M. 蛋白分子质量标准; 1. KIFBP蛋白; 2. pCAGGS-HA空载体对照)A. Identification of the recombinant plasmid by restriction enzymes digestion; B. Identification of host protein expression by WB (M. Protein marker; 1. KIFBP; 2. Blank control)图2 宿主基因KIFBP载体构建及表达Fig.2 Construction and expression of host gene KIFBP
2.4 免疫共沉淀验证互作
pCAGGS-KIFBP-HA和pAAV-S1-CTD-Flag共转染HEK-293T细胞后,宿主蛋白和诱饵蛋白均成功表达。免疫共沉淀结果显示,HA抗体能够检测出免疫沉淀复合物中的KIFBP-HA重组蛋白(图3),pAAV-IRES-heGFP空载体和KIFBP质粒共转染时,蛋白未被沉淀下来。结果表明,KIFBP与S1-CTD蛋白之间存在相互作用。
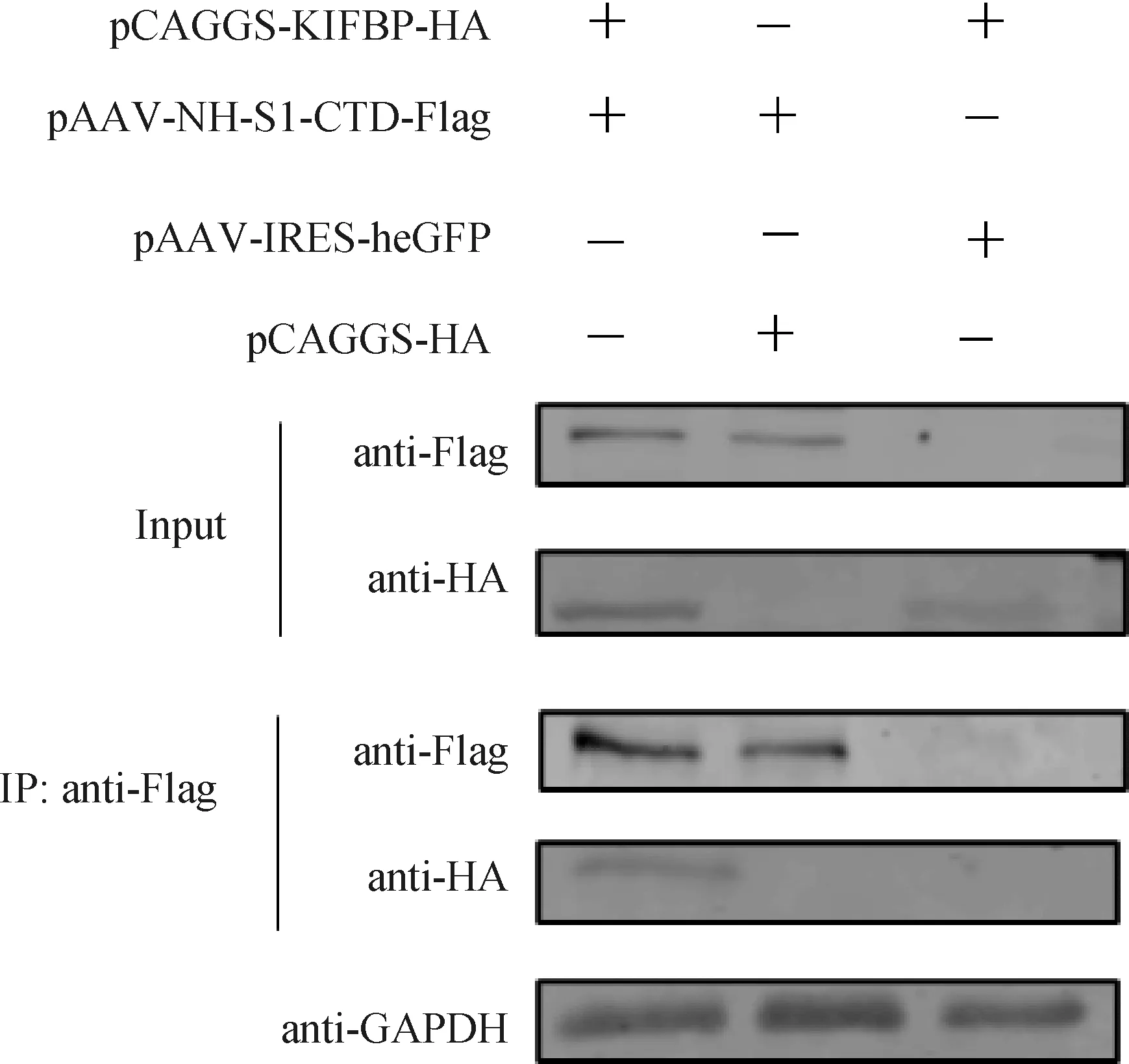
图3 免疫共沉淀验证 SI-CTD与 KIFBP相互作用Fig.3 KIFBP interacts with S1-CTD by CO-IP assay
2.5 KIFBP和S1-CTD共定位
将pCAGGS-KIFBP-HA和pAAV-S1-CTD-Flag分别转染宿主细胞IPI-2I,通过间接免疫荧光验证S1-CTD和KIFBP在宿主细胞中成功表达。用Alexa Fluor 633 Goat anti-Mouse IgG结合Anti-Flag鼠单抗标记的S1-CTD为红色荧光,用Alexa Fluor 594 Goat anti-Rabbit IgG结合Anti-HA兔多抗标记的KIFBP为绿色荧光,激光共聚焦结果显示,KIFBP和S1-CTD均存在于细胞质中,并存在共定位(图4)。

图4 激光共聚焦在IPI-2I细胞上检测S1-CTD与KIFBP共定位(bar=5 μm)Fig.4 Co-localization of S1-CTD with KIFBP in virus-infected IPI-2I cells (bar=5 μm)
2.6 KIFBP过表达抑制病毒增殖
为了分析宿主蛋白KIFBP与PDCoV S1-CTD相互作用对病毒增殖的影响,检测了过表达KIFBP后PDCoV的病毒滴度和转录水平。结果表明,在PDCoV感染后12、18和24 h,上清病毒滴度测定显示过表达KIFBP的IPI-2I细胞和ST细胞病毒滴度均低于空载体转染组,其中,对于ST细胞在12 h时差异不显著,但18和24 h差异显著(<0.01)(图5A),对于IPI-2I细胞,病毒滴度均显著下降(图5B)。对细胞RNA水平定量检测PDCoV基因的结果显示,与转染空载体的细胞相比,过表达KIFBP的IPI-2I和ST细胞基因mRNA水平降低极其显著,在12 h时降低了约70%(图6)。
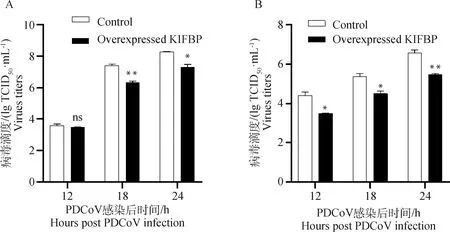
A. ST细胞上清; B. IPI-2I细胞上清。*.P<0.05;**.P<0.01A. ST supernatant; B. IPI-2I supernatant. *.P<0.05;**.P<0.01图5 过表达KIFBP降低上清病毒滴度Fig.5 Overexpression of KIFBP decreased the titer of the supernatant virus
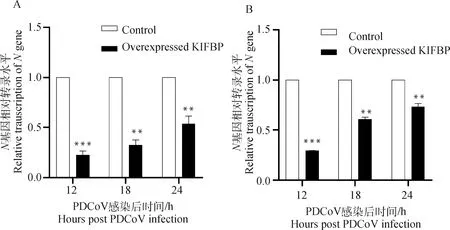
A. ST细胞; B. IPI-2I细胞。**.P<0.01; ***.P<0.001A. ST cells; B. IPI-2I cells.**.P<0.01; ***.P<0.001图6 过表达KIFBP降低N基因mRNA水平Fig.6 Overexpression of KIFBP decreased relative N gene mRNA level
3 讨 论
PDCoV是一种近年新出现的引起仔猪肠道疾病的冠状病毒,位于PDCoV囊膜表面的S蛋白是其主要抗原,可以诱导产生中和抗体。在冠状病毒S蛋白中能够诱导产生中和抗体的区域,往往和受体结合域有着重大关系。Chen等将S蛋白分段截短为S1-CTD(278—616 aa)、S1-NTD(50—286 aa)和S2(601—1 087 aa)并原核表达,免疫兔和小鼠制备多克隆抗体,通过病毒中和试验验证,S1-CTD多抗血清具有最强的中和作用,揭示了S1-CTD区域可能包括S蛋白的主要的中和抗体区域。本研究中对S1-CTD进行HEK-293T真核表达,提取猪回肠上皮细胞膜蛋白,采用Flag-Pull down筛选与其相互作用的宿主蛋白,通过质谱分析后选取了猪源基因进行真核表达质粒的构建及表达,通过免疫共沉淀验证与S1-CTD的相互作用,结果显示,只有驱动蛋白结合蛋白(KIFBP)与S1-CTD存在相互作用,且共转染时激光共聚焦共定位。
本研究首次发现KIFBP与S1-CTD存在相互作用,进一步验证KIFBP对病毒复制是否存在影响,将基因在宿主细胞IPI-2I和易感细胞ST上分别过表达,结果表明KIFBP过表达后抑制了病毒的增殖。过表达KIFBP后,由于KIFBP特殊的右手α螺旋结构,与驱动蛋白相互作用后,封闭了驱动蛋白与微管结合的位点,从而抑制了细胞间的物质转运。与KIFBP相互作用的驱动蛋白家族(kinesin superfamilys, KIFs)是一种保守的分子运动蛋白,具有三磷酸腺苷(ATP)酶活性和运动特性,控制细胞内的货物运输以及细胞微管骨架在细胞发育过程中发挥作用,是细胞内运输的重要分子之一,包括参与突触小泡转运的KIF1A,介导高尔基体和内质网间囊泡转运的KIF1C以及参与线粒体分布的KIF1Bα等。目前,已知的研究中,多种驱动蛋白对于病毒的细胞内转运都有重要的作用。KIF5A、5B和5C能够以结合囊泡的形式有效促进单纯疱疹病毒(HSV)在轴突内转运,KIF1A也能够在伪狂犬病病毒(PRV)的潜伏感染建立和重新激活的过程中,介导依赖于微管的轴突双向转运。在驱动蛋白与冠状病毒相关领域,Hou等通过单病毒跟踪的方法阐明了KIF5B对猪流行性腹泻病毒(PEDV)在核周的融合和聚集起到重要的作用。基于以上研究推测KIFBP过表达以后抑制了驱动蛋白的功能,从而阻挠了病毒的细胞内转运,起到了抑制病毒增殖的效果。但目前未见KIFBP直接与病毒相关的报道,仍需进一步研究。
4 结 论
构建并表达了S1-CTD,成功筛选出一种与其相互作用的宿主蛋白KIFBP。进一步研究表明,过表达KIFBP能有效抑制病毒增殖,结合相关文献阐述了过表达KIFBP抗病毒的可能机制。本研究为PDCoV的致病机制的研究提供了参考。
