β-雌二醇和孕酮促进非洲猪瘟病毒体外复制
2022-08-05袁兴国申超超赵登率崔卉梅杨金柯陈学辉张克山郑海学刘湘涛
袁兴国,申超超,赵登率,杨 博,崔卉梅,郝 雨,杨金柯,陈学辉,张 婷,张克山*,刘 霞,郑海学,刘湘涛
(1.甘肃农业大学生命科学技术学院,兰州 730070; 2.中国农业科学院兰州兽医研究所,兰州大学兽医学院,家畜疫病病原生物学国家重点实验室,兰州 730000)
非洲猪瘟(African swine fever, ASF)是重要的猪传染性疾病,对全球养猪业造成毁灭性的影响。ASF最早于20世纪初在东非被发现,是一种发病率和死亡率都很高的出血性疾病。由于缺乏安全的商品化疫苗,它会造成不可避免的重大经济损失,其防控方式一般为屠宰感染动物以及对疫区进行物理隔离,来阻断其传播。在ASF暴发之前,中国的生猪数量占世界的一半以上,ASF对中国及周边国家的动物健康、生猪生产和人民生活质量构成了重大威胁。
非洲猪瘟病毒(African swine fever virus, ASFV)是一种大的包膜病毒,具有二十面体的形态,平均直径为200 nm。病毒基因组由一个线形、共价封闭式双链DNA分子组成。不同分离株的基因组长度在170~190 kb,编码151~167个开放阅读框。ASFV的复制主要是在细胞质,但细胞核在早期也是病毒DNA合成的场所。该病毒可影响所有品种和年龄段的野猪和家猪。ASFV强毒株可引起受感染动物的超急性或急性出血热,死亡率高达100%。一般来说,临床疾病可以有多种表现形式,从超急性死亡到无症状感染。然而,大多数ASFV分离株会引起家猪急性出血热,致死率接近100%。规模化养殖场发病规律显示,ASFV感染最早发病于母猪。并且怀孕母猪在感染后与猪群其他猪相比表现为最早发病且症状严重,发病后会出现流产,且在发病7 d后致死率可达100%。怀孕期母猪具有较高雌激素水平,一直保持至妊娠期结束。然而,雌激素对于ASFV的感染及其致病有何影响目前还不清楚。
长期以来,由于雌激素的影响,病毒感染后临床症状呈现出性别差异现象。乙型肝炎病毒(hepatitis B virus,HBV)是全球最普遍的人类病原体之一,长期感染约2.5亿人。男性HBV相关的肝细胞癌(hepatocellular carcinoma,HCC)发生率要比女性高得多,比率约为(5~7):1。有研究报道,通过新型miR-18a介导的靶向机制,70%以上的女性HCC患者肝组织中雌激素受体(estrogen receptor-α polypeptide,ER-α)表达显著降低,说明miR-18a可能阻断雌激素的保护作用并导致女性更严重的HCC,表明雌二醇(β-estradiol,E2)对女性具有保护作用。在人类免疫缺陷病毒1型(human immunodeficiency virus-1,HIV-1)感染早期,女性患者的病毒血症明显低于男性,并且在此期间女性患者CD4T细胞的损失是男性患者的两倍。研究证实,这些差异与女性的E2水平有关,E2有助于CD4T的活化和减少病毒复制。另外用小鼠模型感染流感病毒后,用E2治疗的小鼠表现出更短的病程和更晚的发病,总体上呈现出更低的发病率和死亡率,显示出E2的保护作用。用孕酮(progesterone,P4)治疗的小鼠病程更长,发病更早,总体发病率和死亡率都有所增加,显示出有害的效果。目前雌激素与病毒感染相关的研究多集中在肝炎病毒、流感病毒等,在新型冠状病毒SARS-CoV-2的研究中也有报道。
本研究用胎牛血清(fetal bovine serum,FBS)、空怀期猪血清(non-pregnant swine serum,NPSS)和怀孕期猪血清(pregnant swine serum,PSS)培养猪肺泡巨噬细胞(porcine alveolar macrophages,PAMs)和骨髓巨噬细胞(bone marrow-derived macrophages,BMDM)后再用ASFV感染细胞,发现PSS有显著促进ASFV复制的作用,然后分别测定PSS和NPSS培养组细胞上清中的E2和P4含量,发现PSS培养组的E2和P4的含量均高于NPSS组,最后在E2和P4含量很低的FBS组中添加外源E2和P4,发现可以促进ASFV的复制。进一步用PSS和NPSS培养BMDM后,发现PSS培养会显著抑制β-干扰素及下游抗病毒因子的转录,这可能是PSS能促进ASFV复制的初步原因。本研究结果在一定程度上为临床上猪群感染ASF后母猪最早发病且怀孕母猪症状严重的现象提供了科学依据。
1 材料与方法
1.1 材料
非洲猪瘟病毒(ASFV CN/GS/2018)、PAMs和BMDM均由中国农业科学院兰州兽医研究所非洲猪瘟区域实验室保存; RPMI 1640 细胞培养液和FBS购自Thermo Scientific公司;空怀期猪血清和怀孕期猪血清从猪场采集处理得到;E2和P4 ELISA检测试剂盒均购自Cayman公司;外源E2和P4购自SIGMA公司;鼠抗β-actin单抗、HRP标记山羊抗鼠IgG二抗和HRP标记山羊抗兔IgG二抗均购于Thermo Scientific公司;RNA 抽提试剂Trizol购自Invitrogen公司; TB GreenPremix Ex Taq、PCR引物、RT Primer Mix购自TaKaRa公司;ASFV p30单抗和p72多抗由中国农业科学院兰州兽医研究所非洲猪瘟区域实验室制备并保存;ECL显色剂购于Thermo Scientific公司。
1.2 方法
1.2.1 血清的采集与处理 从猪场采集空怀期猪和怀孕期猪血液各5份,室温放置过夜后4 000 r·min离心10 min,将5份血清各自混匀后在水浴锅中56 ℃、30 min热灭活。
1.2.2 细胞培养及病毒感染 PAMs和BMDM从液氮罐中取出后在37 ℃的水浴锅中迅速解冻,1 500 r·min离心5 min,用分别含10% FBS、NPSS和PSS的RPMI 1640 培养液培养细胞。另一份将PAMs复苏后分别用含10% FBS、10% FBS+E2、10% FBS+P4和10% FBS+E2+P4的培养液培养。37 ℃、5% CO培养24 h后感染ASFV(MOI=0.5),48 h后收取样品。一式两份,一份采用绝对定量PCR检测病毒拷贝数,一份采用Western blot检测ASFV p30蛋白水平变化。
1.2.3 血清中E2与P4含量的测定 根据E2 ELISA检测试剂盒(货号:501890)和P4 ELISA检测试剂盒(货号:582601)说明书测定处理后的NPSS、PSS和FBS中E2和P4含量。
1.2.4 实时荧光定量PCR(RT-qPCR) 绝对定量:反应体系25 μL,在ASFV(MOI=0.5)感染PAMs和BMDM 24 h后收集细胞样本,用Qiagen公司的QIAamp DNA Mini试剂盒提取样本DNA,以ASFV p72基因为靶点,使用参考文献[19]采用的实时荧光定量PCR,用相应的引物(表1)进行绝对定量PCR检测ASFV基因组DNA拷贝数。扩增条件:95 ℃预热30 s后,95 ℃ 5 s,58 ℃ 30 s,共40个循环。
相对定量:分别用添加10% NPSS和PSS的培养液培养BMDM 24 h后收集细胞并提取细胞总 RNA 后反转录成cDNA,使用相应引物(表1) 进行相对定量检测。反应体系(10 μL):TB GreenPremix Ex5 μL,上游引物(10 μmol·L) 0.5 μL,下游引物(10 μmol·L) 0.5 μL,ddHO 3 μL,cDNA 1 μL。相对定量反应条件:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 34 s,共 40 个循环,同时进行熔解曲线分析,采用 2-ΔΔ方法,计算目的基因的相对表达量并进行分析。

表1 实时荧光定量PCR引物信息Table 1 Primer information of real-time fluorescence quantitative (RT-qPCR)
1.2.5 Western blot分析 弃去细胞培养液,添加含β-巯基乙醇的1×SDS Loading Buffer,使用细胞刮收集细胞样品至EP管中,100 ℃金属浴煮沸10 min。配制10%聚丙烯酰胺蛋白胶;取20 μL蛋白样品上样并加蛋白预染Marker; 80 V电压电泳30 min后调至120 V; 100 V NC膜转印1.5 h;然后用5%脱脂奶粉室温封闭2 h; 0.1% TBS’T快洗后孵育一抗(分别为ASFV p30单抗、p72多抗和鼠抗β-actin单抗),4 ℃过夜;0.1% TBS’T快洗后孵育二抗,室温2 h;0.1% TBS’T快洗后用高分辨图像采集系统进行ECL显影并保存。利用Image J软件分析目的条带的灰度值,根据所测灰度值计算蛋白相对表达水平(灰度值数值在目的条带的下方用目的蛋白分析数值除以内参蛋白分析数值表示)。
1.2.6 数据分析 所有试验至少重复3次。应用 GraphPad Prism 8软件进行分析并作图,运用独立样品检验进行统计学分析(*.<0.05表示数据具有统计学意义,**.<0.01表示数据具有显著性差异,***.<0.001表示数据间具有极显著性差异)。
2 结 果
2.1 怀孕猪血清(PSS)培养组和空怀猪血清培养组(NPSS) 相比促进ASFV复制
用分别含10% FBS、NPSS和PSS的RPMI 1640 细胞培养液将PAMs和BMDM培养24 h后感染ASFV,一式两份,一份采用绝对定量PCR检测ASFV病毒拷贝数,结果显示用含PSS的培养液培养的PAMs和BMDM组病毒拷贝数显著高于NPSS培养组(图1A、B)。另一份收取样品处理后采用Western blot检测ASFV p30蛋白的表达变化,结果显示PSS培养的PAMs和BMDM中ASFV p30蛋白表达量高于NPSS培养组(图1C、D)。
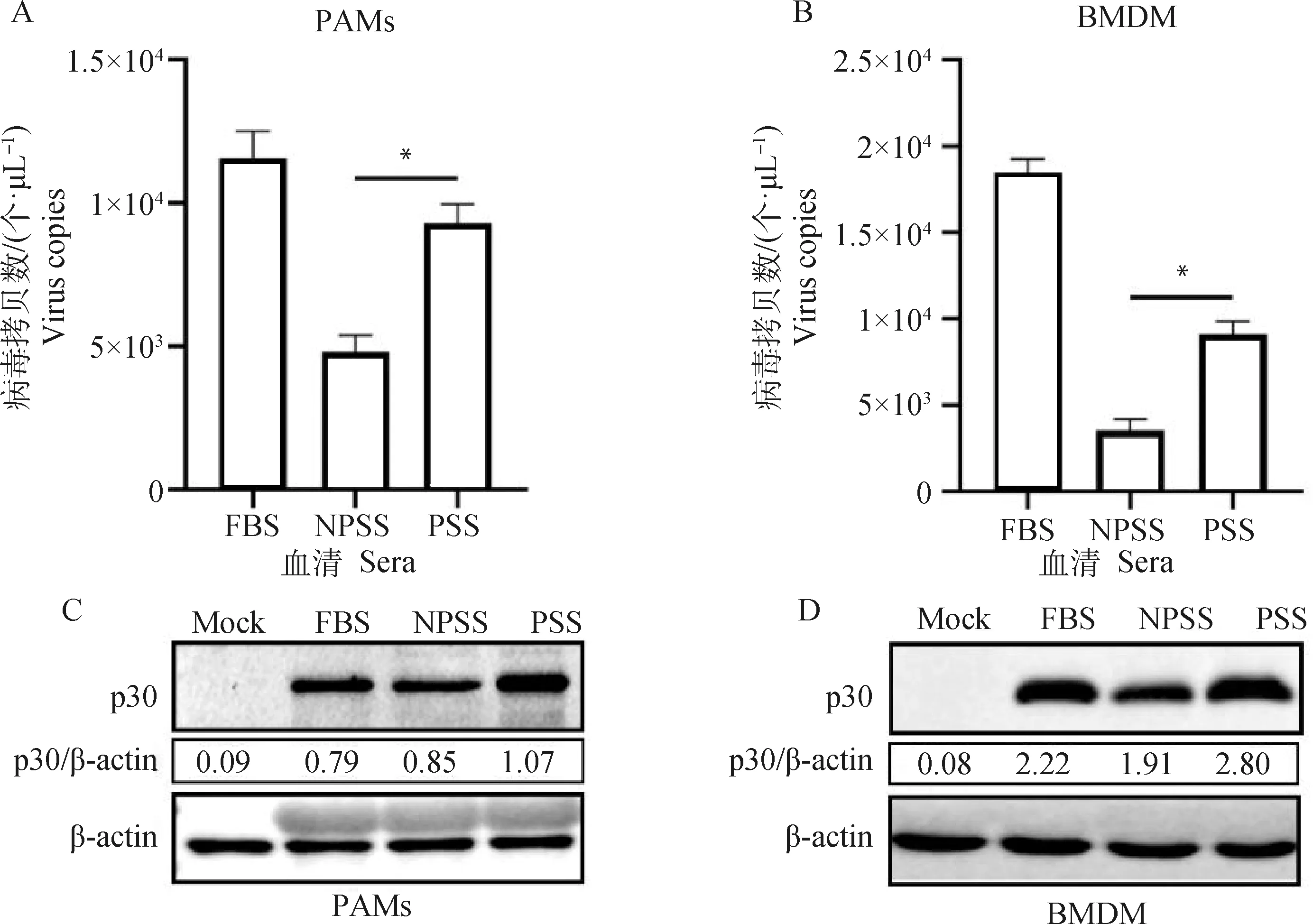
A、B. 绝对定量PCR检测各组病毒拷贝数;C、D. Western blot检测各组p30蛋白表达量。FBS.胎牛血清; NPSS.空怀猪血清;PSS.怀孕猪血清; *.P<0.05,**.P<0.01,下同A, B. Absolute quantitative PCR detection of virus copies in each group;C, D. The expression of p30 protein was detected by Western blot. FBS.Fetal bovine serum; NPSS. Non-pregnant swine serum; PSS.Pregnant swine serum; *.P<0.05, **.P<0.01, the same as below图1 怀孕猪血清组ASFV复制量高于空怀猪血清组Fig.1 The amount of ASFV replication in PSS group was higher than that in NPSS group
2.2 怀孕猪血清(PSS)中E2和P4含量高于空怀猪血清(NPSS)
分别采集5份空怀期猪血清和怀孕期猪血清,进行热灭活后混匀,以去除个体因素引起的差异。然后用E2和P4 ELISA检测试剂盒分别检测这两种血清中E2和P4的含量。结果显示,PSS中E2(图2A)的含量高于NPSS,且数据具有统计学意义。PSS中P4(图2B)的含量显著高于NPSS,且FBS中E2和P4的含量很低。
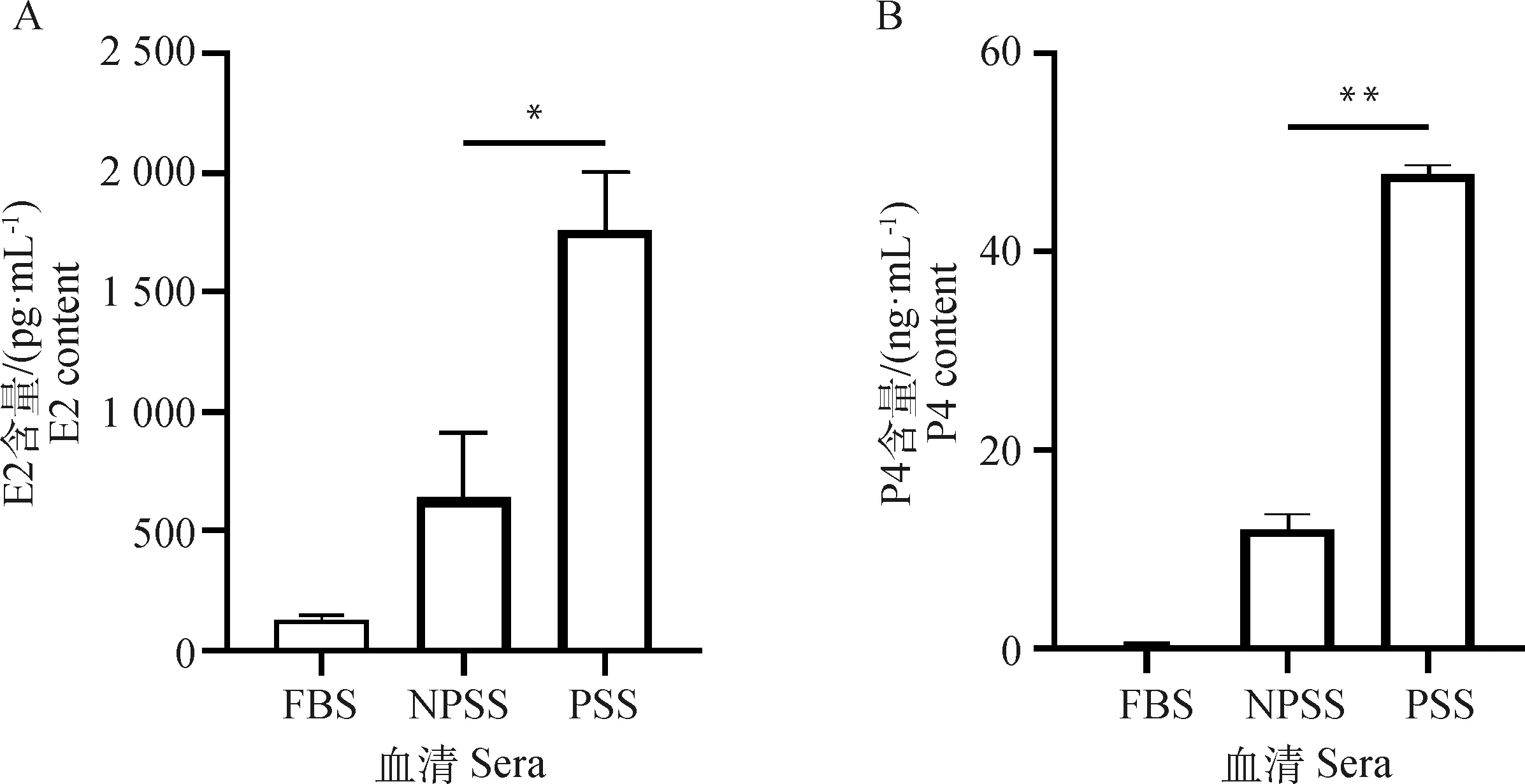
A. ELISA试剂盒检测血清中雌二醇的含量;B. ELISA试剂盒检测血清中孕酮的含量A. E2 content in serum detected by ELISA kit;B. P4 content in serum detected by ELISA kit图2 怀孕猪血清中E2和P4含量均显著高于空怀猪血清Fig.2 The contents of E2 and P4 in serum of pregnant swine were significantly higher than those of non-pregnant swine
2.3 添加外源E2和P4促进ASFV复制
将PAMs复苏后用分别含10% FBS、10% FBS+ 20 ng E2、10% FBS+20 ng P4和10% FBS+10 ng(E2+P4)的培养液培养,48 h后收取样品。一式两份,一份采用绝对定量PCR检测ASFV病毒拷贝数。结果显示,添加E2后ASFV病毒拷贝数升高,且数据具有统计学意义。添加P4试验组和混合添加E2及P4试验组ASFV病毒拷贝数显著高于对照组(图3A)。另一份样品收取处理后采用Western blot检测各组ASFV p72和p30蛋白表达变化。结果显示,添加E2、P4及混合添加这两种激素后ASFV p72和p30蛋白表达均升高(图3B)。

A.绝对定量PCR检测各组病毒拷贝数;B. Western blot检测各组p72和p30蛋白表达量A.Absolute quantitative PCR detection of virus copies in each group;B. The expression of p72 and p30 protein was detected by Western blot图3 胎牛血清中添加E2和P4会促进ASFV复制Fig.3 The addition of E2 and P4 to FBS alone or in combination will promote ASFV replication
2.4 怀孕猪血清(PSS)培养BMDM抑制干扰素及下游抗病毒因子转录
为探究怀孕猪血清(PSS)培养组促进ASFV复制的原因,进一步检测了NPSS和PSS培养组在未感染状态下干扰素及部分下游抗病毒因子的转录。分别用添加10% NPSS和PSS的培养液培养BMDM 24 h后收取样品,利用相对定量检测IFN-β(图4A)、ISG-15(图4B)、ISG-56(图4C)以及MX1(图4D)的mRNA表达水平。结果显示,PSS培养组IFN-β及下游抗病毒因子转录显著下降。
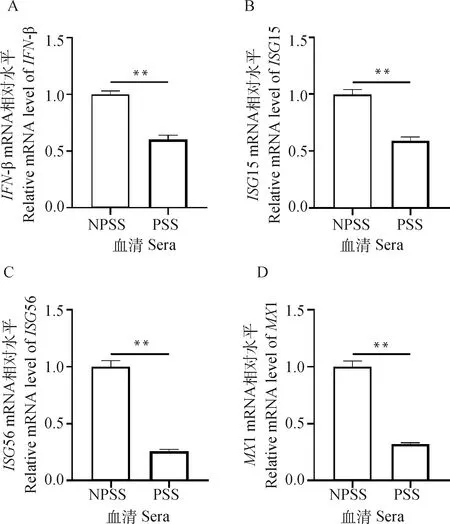
图4 怀孕猪血清培养BMDM会抑制β-干扰素及下游抗病毒因子转录Fig.4 PSS treatment of BMDM can inhibit the transcription of beta-interferon and downstream antiviral factors
3 讨 论
E2和P4在不同的生殖和非生殖过程中起着重要作用,如排卵、妊娠、神经保护、学习和记忆以及免疫反应。E2和P4的功能主要通过它们的细胞内受体发挥。E2和P4主要在卵巢、肾上腺、胎盘和中枢神经系统合成。一旦释放,P4会进入血液,在血液中它要么自由循环,要么与血浆蛋白(如白蛋白或球蛋白)结合。本研究证实了母猪在怀孕期间E2和P4的合成及释放会增加,证明E2和P4对于维持机体正常生理功能发挥重要的作用。
本研究结果与其他文献报道一致,E2也可以促进戊型肝炎病毒(hepatitis E virus,HEV)复制。有研究表明,在妊娠晚期感染HEV的孕妇血清中E2的水平极高,并且在体外用17β-雌二醇和雌激素类似物(如DES)处理细胞后,以剂量依赖的方式促进HEV的复制。而用抗雌激素药物处理细胞后,HEV的复制被抑制,这初步解释了妊娠晚期妇女比未怀孕患者病毒滴度高的原因。并且由于类固醇激素具有免疫抑制作用,通过NF-κB介导淋巴细胞凋亡,使患者表现出严重的肝损伤和较高的死亡率。P4的免疫调节功被证明对HIV-1传播和复制也有影响,主要成分为P4的避孕药,如醋酸甲羟孕酮 (DMPA),可以增加生殖道中HIV-1的复制从而使病情更重。另外,使用避孕药还会增加对 HIV-1 的易感性,使得感染病毒HIV的风险增加2~3倍。本研究结果证实具有高含量E2和P4的PSS和商品化的E2、P4处理细胞后,都促进ASFV体外复制,证实了高含量的E2和P4可能是怀孕猪病情较重的原因之一。
生物体对病毒感染的最初反应之一是合成抗病毒细胞因子,如I型干扰素(IFN-α/β)、白细胞介素、趋化因子以及其他促炎细胞因子。干扰素的产生提供了抵御病毒感染的第一道防线。干扰素可以诱导数百个干扰素刺激基因(interferon-stimulated genes,ISGs)的转录,这些基因的蛋白产物能在病毒复制的多个步骤发挥抑制作用,因此几乎所有病毒都可以通过阻断干扰素的合成或作用来逃避干扰素的抗病毒作用。除了抗病毒作用外,干扰素还影响免疫细胞的功能,激活免疫细胞的干扰素合成与分泌有助于抑制病毒的致病作用。目前ASFV与干扰素相关的研究主要与病毒蛋白的功能与其逃避天然免疫有关,比如ASFV E120R 蛋白通过与 IRF3 相互作用阻止其激活来抑制IFN-β的产生,ASFV CD2v蛋白诱导猪外周血单核细胞IFN-β表达和凋亡等。在本研究中,用PSS处理BMDM后,IFN-β及其下游抗病毒因子ISG15、ISG56和MX1的转录都被显著抑制,证明PSS处理在体外可抑制干扰素的合成从而逃避其抗病毒作用,为E2和P4促进ASFV体外复制提供了进一步的解释。
本研究证实了PSS中高含量的E2和P4可以促进ASFV的复制,其原因可能与PSS培养细胞后抑制β-干扰素及下游抗病毒因子的产生有关,具体的机制还需要进一步的探讨。此结果为临床上解释猪群感染ASF后母猪发病最早且怀孕母猪病情较重的现象提供了一定的科学依据。
4 结 论
怀孕期猪血清与空怀期猪血清相比会促进ASFV复制,并且与空怀期猪血清相比,怀孕期猪血清的E2和P4含量更高,在雌激素含量很低的FBS中单独或者混合添加外源E2和P4同样会促进ASFV的复制。与空怀期猪血清相比,怀孕期猪血清培养BMDM后可以下调干扰素及下游抗病毒细胞因子的转录,这可能是怀孕期猪血清促进ASFV复制的初步原因。
