简析凝乳酶凝乳机理及羔羊凝乳酶自制方法
2022-08-04周希梅黄萌萌李竞前闫奎友
周希梅,赵 华,黄萌萌,李竞前,闫奎友
全国畜牧总站,北京 100125
0 引言
凝乳酶(Chymosin)对奶酪生产至关重要。早在公元3—4世纪,人类就偶然发现动物胃中某种成分可使乳凝固,这是人们认识凝乳酶的伊始[1]。随着现代科学技术的发展,制作奶酪用的工业化商品凝乳酶已经取得了许多突破,但在国内家庭牧场和羊乳企业小规模生产制作奶酪上,凝乳酶的传统提取方法仍是解决其来源的最为简单易行的核心关键技术。
1 凝乳酶种类及作用机理
1.1 种类
根据凝乳酶来源的不同,可以分为动物凝乳酶、植物凝乳酶、微生物凝乳酶、遗传工程凝乳酶四大类。
1.1.1 动物凝乳酶
在传统意义上,动物凝乳酶一般是指从多胃反刍动物(犊牛、羔羊等)的第四胃(皱胃)提取出来的,可使乳凝固的酶制品——皱胃酶(Rennet),有时也称“天然动物酶”。皱胃酶的主要成分是凝乳酶、胃蛋白酶(Pepsin)等,均归类于天冬氨酸肽酶,除此之外,还含少量多肽、核苷、含氮碱基、氨基酸、甘油和脂肪酸等。
小牛皱胃中的凝乳酶占比高达90%。经提取后,皱胃酶中的凝乳酶占比为50%~80%。凝乳酶能特异性水解κ-酪蛋白产生酪蛋白巨肽,近而形成凝乳,而胃蛋白酶的水解特异性并不专一,可同时水解含苯丙氨酸(Phe)、亮氨酸(Leu)、苏氨酸(Tyr)、缬氨酸(Val)的肽键。
猪胃蛋白酶比小牛胃蛋白酶更接近小牛皱胃酶,但因其稳定性差,易受热钝化失活,单独使用活性低,对奶酪成熟中的蛋白质降解贡献极小,使奶酪成熟变得非常慢,组织状态也差。当猪胃蛋白酶与粗制的皱胃酶混合使用时,总体效果可接受,能替代一部分皱胃酶。
骆驼有3 个胃(无瓣胃),驼胃的凝乳酶具有特殊的κ-酪蛋白水解活力,优于小牛皱胃酶。用驼胃的凝乳酶制作奶酪时,非特异性降解蛋白损失少,奶酪产出率高,且苦味少,制成复合凝乳酶制剂,可达到或超过小牛皱胃酶的凝乳效果。水牛胃的凝乳酶稳定性和活性与小牛皱胃酶截然不同,其凝乳具有独特的专一性,仅适合水牛乳奶酪的生产。
1.1.2 植物凝乳酶
自然界的许多植物都含蛋白酶。从其中提取汁液,进行凝乳酶研究的包括木瓜、蓖麻籽油、无花果、菠萝等的蛋白酶。截至目前,已经从各类树木中提取出40 多种能够凝乳的酶,但它们水解速度过快,会过度水解蛋白质而产生苦味肽,影响风味和凝乳,因此,仅适于成熟需要几天的软质奶酪,而不适于需要长时间成熟的硬质奶酪。
从木瓜提取的木瓜蛋白酶可使牛乳和羊乳凝固,其特点为蛋白质分解力强,脂肪损失小,奶酪成品得率高,但制成的奶酪带有明显的苦味,很难推广,只能用于生产某些新鲜奶酪、稀奶油奶酪以及只需要短期发酵的软质奶酪,如细菌发酵成熟的手工奶酪和霉菌发酵成熟的卡门贝尔奶酪等。
新鲜无花果汁经结晶分离,能成功提取无花果蛋白酶,可用其制作半硬质奶酪,凝乳与成熟的效果都较好,但对蛋白质分解力较强,脂肪损失多,奶酪成品得率低,且有苦味。
目前只有白花牛角瓜(Calotropis procera L)、碎米芥(Cardamine hirsuta L.)、捕虫堇(Pinguicula alpina L.)、蓬子菜(Galium verum L.)及蓟属(Cynara L.)等植物酶被认为比较适合制作各种奶酪。其中蓟属植物中的刺菜蓟和菜蓟非常适合生产以绵羊乳和山羊乳为原料的奶酪,国外应用比较多。
1.1.3 微生物凝乳酶
来源于传统意义上的凝乳酶数量有限,不能满足奶酪生产需求。20世纪60年代,微生物凝乳酶开始应用,最为成功的是米黑毛霉(Mucor miehei)和微小毛霉(Mucor pusillus)凝乳酶,但用其生产的奶酪成品得率较低,成熟后风味不够理想,容易因发酵过度而造成奶酪质地不佳。
1.1.4 基因工程凝乳酶
随着基因工程技术不断发展,使凝乳酶基因在微生物宿主进行表达成为现实。目前全球大多数凝乳酶都是借助微生物生产的,大致分成霉菌、细菌、担子菌三种来源。其中应用最多的是源于霉菌的凝乳酶。微生物凝乳酶制作周期短、产量高,不受自然地域的限制,制造成本低,酶纯度高。
基因工程凝乳酶已成功应用于凝乳酶的批量生产,大大缓解了传统动物凝乳酶的供应不足。基因工程凝乳酶与天然动物皱胃酶几乎一致,对酪蛋白水解活力非常相似,且已获得安全性认定,在许多国家得到广泛应用。
近些年,人们通过克隆山羊凝乳酶原cDNA,使其在酵母中进行表达,所生成的cDNA编码序列与山羊凝乳酶原的基因编码具有高度相似性。正是由于克隆山羊凝乳酶所表现出的对κ-酪蛋白的高度特异性,因此,使其广泛运用于山羊奶酪的制作。人工克隆绵羊凝乳酶原的cDNA在大肠杆菌中进行表达凝乳效果和成品品质均与羔羊皱胃酶非常类似。
1.2 凝乳酶作用机理
在奶酪生产中,凝乳的方法归纳起来主要有4 种。一是酶法凝乳。凝乳酶可以使κ-酪蛋白不稳定,在钙离子参与下发生聚合;二是酸法凝乳,酸化而引发的凝乳,凝乳的温度通常为60~80 ℃;三是热诱导凝乳,主要发生在乳被高温加热的情况;四是加盐与加热共同作用的凝乳,如我国广东等南方地区的乳饼(Milk Cake)[2]、意大利里科塔(Ricotta)奶酪等。在这四种凝乳方法中,第一种酶法凝乳是全世界奶酪制作应用最为广泛的,也是本部分论述的重点。
1.2.1 凝乳酶的凝乳过程
乳中酪蛋白不稳定,可以在一定条件下凝聚而凝固,是制作奶酪的基本前提,凝乳则是奶酪生产中至关重要的一个环节。
乳中酪蛋白约90%以微团状态存在,称为酪蛋白胶束,均匀分散在乳中,构成酪蛋白胶体系。酪蛋白胶束中的κ-酪蛋白是以低聚物形式存在的,约6 个分子组成,分布于胶束表面。κ-酪蛋白分子的亲水C-末端从胶束内部以柔韧“发层”伸向液相,具有极强的自由度,“发层”厚度约7 nm。C-末端始于残基86、96位处,凝乳酶分解苯丙氨酸、甲硫氨酸(Phe-Met)键位于残基的105、106位。酪蛋白胶束表面“发层”架构形成位阻空间,使胶束稳定在乳中。
酶凝固,首先始于酪蛋白酶水解,凝乳酶对κ-酪蛋白的作用点位于κ-酪蛋白的N-末端105位的苯丙氨酸与106位的蛋氨酸的肽键结合处,因酶作用而裂成2 个片段,N-末端侧的,称副κ-酪蛋白,而C-末端侧的,称酪蛋白巨肽。前者疏水性高、不溶于水,后者亲水性高并含糖[2]。
κ-酪蛋白水解度达到一定程度时,水解位点又相互结合,发生副酪蛋白的聚合,随着线形链的生成,增强了乳黏度,进而加剧相互交联而成网构状,液体介质充满网构间隙中,诱发液胶-凝胶的转变(Sol-Gel Translation),乳由黏性流体,变成黏弹性的固体。随着酪蛋白结构重排,借助乳中的游离钙离子,促成了更多交联键,称“钙桥”,随着凝块渐厚,最终发生胶凝化凝固,胶体脱水收缩,至乳清析出。
1.2.2 羊乳的酶凝固
羊乳,其凝乳酶的凝乳过程与前文所述基本一致。通常,羔羊凝乳酶凝固羊乳的效率较高,但羊乳的pH、温度会直接影响酶凝乳的效果,为了进一步提高凝乳效率,在加入羔羊凝乳酶之前,还需增加两个重要辅助手段,即加入乳酸菌发酵剂控制乳的酸度和通过加热保温设备控制凝乳的温度。
副酪蛋白聚合阶段对乳的温度很敏感,主要蛋白质的分解阶段发生在pH5.20~5.80范围。在凝乳酶、发酵剂的共同作用下,乳蛋白质被降解成肽类,对促进奶酪后期成熟极其关键,肽类被微生物进一步利用或降解,便产生奶酪的特殊风味和滋味。
当乳pH为4.6,即酪蛋白等电点,在温度为20 ℃时,所得到的蛋白质即为酪蛋白,构成奶酪的主要蛋白质。与其他哺乳动物一样,羊乳的酪蛋白由αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白组成。酪蛋白属两性电解质,在乳中以酪蛋白酸钙与磷酸钙的复合形态存在,对pH高低非常敏感,尤其等电点高于其他蛋白的β-酪蛋白。当pH降至等电点以下,钙离子和β-酪蛋白从胶束中被释放,因β-酪蛋白带正电荷,其他蛋白带负电荷,便引发蛋白质相互吸引,最终形成蛋白质凝固与沉淀。
2 羔羊凝乳酶自制方法
哺乳期小羔羊胃主要分泌的消化酶是皱胃酶。当饲喂母羊乳汁以外的饲料时,其胃就开始分泌胃蛋白酶,随着月龄增大,胃蛋白酶比例逐步增加,而皱胃酶逐渐减少。因此,自制提取羔羊皱胃酶时,应选用正处于哺乳期的小山羊或小绵羊的第四胃(皱胃),所得羔羊皱胃酶含量和活力能够达到最佳。
2.1 羔羊皱胃的处理
挑选健康的0~4 周龄羔羊,宰前10 h停止饲喂。宰后立即切取皱胃。由于皱胃的上半部分所分泌的酶数量最多,应从第三胃(瓣胃)的末端处切取,而下部分也应从第四胃(皱胃)十二直肠的上部分切断(图1),确保不损失有效皱胃酶成分。
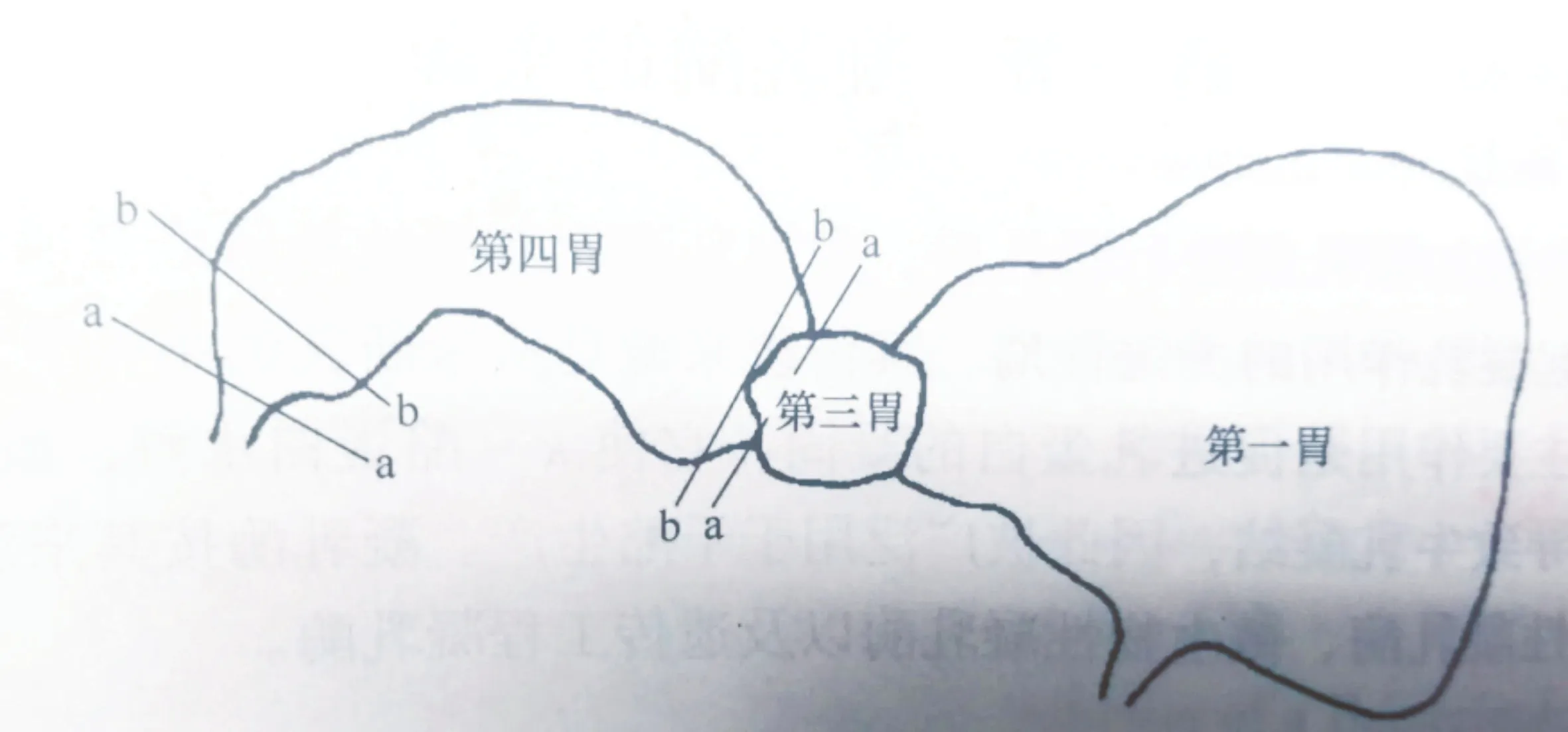
图1 皱胃切取示意图[3]
以洁净的流水,冲洗皱胃,去除胃内残留物,并剔净脂肪与结缔组织,放置在-18 ℃条件下进行冷冻备用。当提取凝乳酶时,要记录本批次所用皱胃的个数,并对皱胃统一进行混合及充分粉碎,确保处理混匀,完全制成肉糜状。
2.2 操作步骤
用食盐酒精混合液浸泡肉糜。其中,食盐浓度4%~5%,酒精浓度10%~12%。具体操作步骤如下。
2.2.1 浸泡保存
按每个羔羊皱胃需用食盐酒精液200 mL的用量,对肉糜进行充分浸泡,并置于阴暗且避光处保存5 d。注意每天应进行2 次以上的充分搅拌。
2.2.2 离心处理
至第6 d时,小心收集上清液,将下部分的浑浊体与残渣,用离心机实施进一步分离,所得的液体,再与上清液混合一处,得到浸出液。注意保留分离的残渣。
2.2.3 浸泡残渣
按每个皱胃用2.2.2得到的浸出液100 mL的比例用量,回加入已分离的残渣中,搅拌并置阴暗避光处,再浸泡2 d时间后,以2.2.2同样的方式,再提取而成浸出液。
2.2.4 澄清处理
将步骤2.2.2和2.2.3的浸出液,全部混合一处,置于洁净的玻璃容器内,按5%的比例,慢慢加入浓度1 mol/L的盐酸并搅拌,静止5~10 min,原来浑浊的浸出液开始出现沉淀现象,浸出液主体逐渐变得较为清澈,少量黏性物质形成沉淀物,沉于容器底部。
2.2.5 盐度与pH值
分离剔除沉淀物后,按一定比例向浸出液中再加入食盐,使浸出液的含盐控制在约15%。再将浸出液的pH调整至5~6,即为液体羔羊凝乳酶。置2~6 ℃阴暗避光处保存。测定活力后,随时可以用于羊奶酪的生产。
上述全程操作可在常温下进行。有条件时,也可采用升华干燥法将液体凝乳酶制成粉末状,以方便贮存和运输。
2.3 注意事项
因为羔羊个体差异以及月龄不同,每个批次的羔羊皱胃浸提液中的凝乳酶与胃蛋白酶可能含量有所不同,为此,可将不同批次制得的浸提液,混合在一起,并用蒸馏水统一稀释到一定的浓度,备用于生产。这样做的目的,是为预防因不同批次制得的浸提液酶浓度不一(过高或过低)而引发羊乳的凝固不均匀,导致不同批次羊奶酪的品质(质地结构)出现差异,影响产品质量。
混合浸提液的稀释倍数,可根据浸提液存放时间和所测得的活力而定。通常情况下,1 个羔羊皱胃所自制成的凝乳酶,能凝固羊乳1 200~1 500 L。
3 羔羊凝乳酶活力测定
掌控凝乳酶活力的强弱,是羊奶酪生产中非常关键的环节。供应商提供的商品凝乳酶,可按供应商提供的应用技术说明方法使用,一般按批次包装进行一次凝乳酶活力测试,做好记录标识。
同样,针对自制的羔羊凝乳酶,须按凝乳酶制作批次进行活力测定。按照每批次生产羊奶酪所用羊乳的重量,生产操作人员应准确计算和量取凝乳酶的用量。在实际生产中,通常用凝乳槽(罐)一次所能容纳的羊乳重量,作为计算依据。出于操作简单和生产效率,注意应做到每次凝乳槽(罐)均保证是恒定的羊乳重量。
3.1 凝乳酶活力
凝乳酶活力,一般是指100 mL的1%凝乳酶溶液(或1 g凝乳酶干粉),在固定温度下(35 ℃)和固定时间内(40 min),能够凝固羊乳的毫升数(mL)。
为方便生产一线操作人员进行凝乳酶活力测定,准确管控凝乳酶用量,下面介绍一种简单实用的凝乳酶具体用量的计算方法。
3.2 测定活力步骤
设施与试剂主要有粗天平、温度计、100 mL量筒、漏斗、普通滤纸、玻璃棒、150~200 mL烧杯、150 mL三角烧瓶、蒸馏水等。为方便表述,现以羔羊皱胃酶干粉为例。测定方法如下。
3.2.1 配制1%凝乳酶溶液
称取1 g的凝乳酶干粉,置放于150 mL三角瓶内,加入100 mL35 ℃的蒸馏水。充分混溶后,确保静止15 min后过滤,保留滤液。提示:配制好的酶溶液,应在2 h之内完成活力测定。
3.2.2 记录开始凝乳时间
用量筒量取100 mL羊乳(供试乳,需取自用来制作羊奶酪的同一批次原料乳)置放于150~200 mL的烧杯内,通过水浴加热到35 ℃后,再加1 mL已配制好的1%酶溶液,并立即以玻璃棒用同方向进行搅拌,同时,记下开始时间(min)。
3.2.3 记录羊乳凝固时间
以玻璃棒,用同方向进行搅拌羊乳后,取出玻璃棒,立即在羊乳的表面上置一个小片纸屑(或木炭颗粒),以此来观察羊乳凝固状态。当纸屑(或木炭颗粒)停止转动时,即表明羊乳已凝固,记下此刻的时间(min)。前后的时间差即为凝乳时间(min)。
3.3 凝乳酶活力计算

3.3.1 计算演示
如100 mL的1%羔羊凝乳酶溶液,在9 min内,使100 mL的羊乳发生凝固,则该羔羊凝乳酶的活力为:
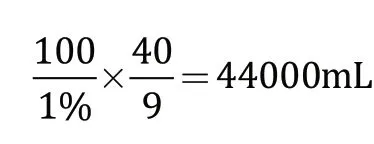
3.3.2 结果应用
100 mL1%的羔羊凝乳酶溶液(或1 g凝乳酶粉),能使44 000 mL的羊乳凝固。生产制造羊奶酪时,就可按此比例,再计算出应加入到羊乳中的凝乳酶用量。
4 小结
本文通过简析凝乳酶凝乳原理并结合羊乳的凝乳条件和特点,重点介绍了自行提取制备羔羊凝乳酶的技术方法。其中,羔羊皱胃选取与处理、充分浸泡和离心处理,以及浸出液盐度与pH值调整至关重要,直接影响羊乳凝乳效果和羊奶酪成品产出率,须严格管控操作步骤和重要技术参数。
