阿司匹林诱导的脂氧素用于慢性非细菌性前列腺炎的治疗研究*
2022-08-04肖瑞海冯绍喜章莹雷康陆文宝
肖瑞海 冯绍喜 章莹 雷康 陆文宝
(1江西省医学科学院附属医院 南昌 360006;2江西省九江市都昌县中医院 都昌 332600;3九江学院附属医院 江西九江 332000)
慢性非细菌性前列腺炎(Chronic Nonbaeterial Prostatitis,CNP)是泌尿外科常见的生殖系统病,主要发病人群是青壮年男性,占总前列腺炎患者人数的90%~95%,其主要表现为骨盆区域长期、反复的疼痛或不适、排尿梗阻、尿踌躇等症状[1],严重影响了患者的身心健康。因此,为慢性非细菌性前列腺炎患者研制新药物,找到一个新治疗途径显得尤为重要[2]。由南昌大学江西省医学科学院实验中心领衔研发的阿司匹林诱生型脂氧素(Aspirin-Triggered Lipoxins,ATL)药物以及小剂量纳米释缓型阿司匹林栓剂是通过独特便捷的给药方式、稳定而持久的治疗途径,可精确治疗病灶、温和有效地改善前列腺炎的新型治疗药物。脂氧素(lipoxin,LX)是通过与其受体结合而参与炎症消退的一类重要抗炎介质,而ATL是一种新型异构脂氧素,同样具有强效抗炎作用[3]。阿司匹林作为经典的且有多种功效的非甾体类抗炎药,在炎症疾病治疗中发挥作用的部分可能为小剂量阿司匹林乙酰化环氧化酶-2(Cyclooxygenase-2,COX-2)产生15-异构的脂氧素(即ATL),而且ATL比天然的LX具有更强效的抗炎效用[4]。但ATL能否促进CNP的炎症消退尚不清楚,目前也没有相关的实验或者临床研究。因此,本研究主要探讨通过外源性给予及内源性诱生的ATL对CNP模型大鼠前列腺细胞的影响和对CNP的消退效果与可能机制,为CNP的治疗找到一个新的治疗途径。现报道如下:
1 材料与方法
1.1 实验动物无特定病原体(Specific Pathogen Free,SPF)级雄性斯波累格·多雷(Sprague Dawley,SD)大鼠60只,体质量240 g左右,由南昌大学医学实验动物中心提供,均饲养于南昌大学江西省医学科学院实验中心动物室。
1.2 药物与仪器ATL药物、小剂量纳米缓释型阿司匹林栓剂,由南昌大学江西省医学科学院实验中心研制提供。生理盐水(北京谨明生物科技公司),苏木精-伊红(Hematoxylin and Eosin,HE)染色液(湖北比克曼生物科技有限公司),酶联免疫试剂盒、TUNEL凋亡检测试剂盒(北京索莱宝科技有限公司),磷酸盐缓冲液(PBS)、DAB显色剂(北京中衫金桥生物技术有限公司),增殖细胞核抗原(Proliferating Cell Nuclear Antigen,PCNA)抗体、羊抗鼠IgG/HRP(杭州华安生物科技有限公司),石蜡切片机、激光共聚焦显微镜(德国徕卡公司),超速冷冻离心机(美国贝克曼公司)。
1.3 分组、造模与给药将60只SD大鼠随机分为6组,每组10只,1组为正常组,其余5组进行造模,分别为阿司匹林组、模型组、ATL高、中、低剂量组。所有SD大鼠按照分组分笼饲养于SPF级动物房,适应性饲养1周后进行实验。根据马建泽实验模型建造方法[5],将3 ml/kg含有10%的水合氯醛注射入大鼠腹腔,去势手术在大鼠麻醉后于无菌条件下进行,缝合切口,消毒包扎,放回鼠笼,自由饮食,每天对伤口用碘酊消毒2~3次,直至愈合。术后次日经腹部皮下给予0.3 mg/kg苯甲酸雌二醇,连续注射30 d。根据人与大鼠等效剂量公式:大鼠剂量=人剂量×35(人因子)/6(大鼠转换因子)。ATL高、中、低剂量组按照ATL药物1.5 g/kg、1 g/kg、0.5 g/kg体质量剂量,分别经前列腺腔注射2 ml;阿司匹林组用生理盐水将小剂量纳米缓释型阿司匹林栓剂溶解稀释为50 mg/kg混悬液,经直肠给药2 ml后悬尾倒立30 s,正常组和模型组均以2 ml生理盐水注射入前列腺腔。所有大鼠于造模30 d后开始给药,1次/d,连续30 d。
1.4 取材及指标检测最后1次给药1 h后,于无菌环境下采集后续实验样本,为每只SD大鼠称重后进行眼眶取血,采集的血液在超速冷冻离心机中进行离心后,取其上清液,并用酶联免疫吸附法检测血清中COX-2、白细胞介素-6(Interleukin 6,IL-6)、白细胞介素-10(Interleukin 10,IL-10)的含量。取血后向腹腔注射10%水合氯醛3 ml/kg进行麻醉,切开腹腔后,剪开耻骨联合,取出前列腺组织,清洗干净后称其总湿重。根据公式:前列腺指数=前列腺组织总湿重/大鼠体质量(单位:mg/g),计算每只大鼠的前列腺指数。称完质量后的前列腺组织,一部分用10%甲醛溶液固定好后,在显微镜下观察已经进行HE染色的组织切片,记录其病理变化;另一部分用于细胞增殖和凋亡的检测。
1.5 TUNEL染色检测细胞凋亡情况严格按照TUNEL试剂盒操作说明进行,在光学显微镜下凋亡细胞的细胞核为深棕色或棕黄色,正常细胞核为蓝色,在每张切片上随机观察并记录5个高倍视野内的阳性细胞数和总细胞数,按照公式:细胞凋亡率=阳性细胞数/总细胞数计算凋亡率,分析细胞凋亡情况。
1.6 免疫组化检测PCNA的表达石蜡切片脱蜡至水后,3%H2O2室温孵育10 min,蒸馏水冲洗,PBS浸泡5 min,重复2次。10%正常山羊血清(PBS稀释)封闭,室温孵育10 min,倾去血清,勿洗。滴加一抗,37℃孵育1 h。PBS冲洗5 min,重复3次。滴加适量生物素标记二抗,37℃孵育10~30 min。PBS冲洗5 min,重复3次。滴加适量碱性磷酸酶标记的链霉卵白素工作液,37℃孵育30 min。PBS冲洗5 min,重复3次。DAB显色剂显色3~15 min,自来水充分冲洗,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片。经染色后在显微镜下观察每张切片内5个随机选取的高倍视野,记录阳性细胞数/总细胞数,取平均值。
1.7 统计学分析应用SPSS21.0软件对相关数据进行统计分析。计量资料以(±s)表示,两组间比采用t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠前列腺指数结果比较与正常组相比,ATL高剂量组和阿司匹林组的前列腺湿质量和指数无明显差别(P>0.05),其余各组的前列腺湿质量和指数均明显升高(P<0.05),表明造模成功。与模型组相比,其余各组的前列腺湿质量和前列腺指数均明显降低(P<0.05),表明ATL高剂量组和阿司匹林组的药物恢复前列腺组织效果显著。见表1。
表1 各组大鼠前列腺指数结果比较(±s)

表1 各组大鼠前列腺指数结果比较(±s)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与ATL低剂量组相比,△P<0.05。
组别 n 大鼠体质量(g) 前列腺湿质量(g) 前列腺指数正常组模型组ATL低剂量组ATL中剂量组ATL高剂量组阿司匹林组10 10 10 10 10 10 F P 442.45±18.67 448.63±22.18 441.72±16.10 442.29±19.61 439.17±15.74 440.90±17.22 0.307 0.907 0.82±0.08 1.17±0.11*0.95±0.09*#0.92±0.09*#0.85±0.07#△0.89±0.08#20.073 0.000 0.001 9±0.000 23 0.002 6±0.000 25*0.002 2±0.000 26*#0.002 1±0.000 16*#0.001 9±0.000 19#△0.002 0±0.000 21#14.081 0.000
2.2 各组大鼠血清中COX-2、IL-6、IL10表达水平比较正常组与高剂量组中血清COX-2、IL-6、IL-10比较无明显差别(P>0.05),模型组中IL-10明显降低,COX-2、IL-6明显升高(P<0.05);与模型组相比,中、高剂量组和阿司匹林中的血清COX-2、IL-6均明显降低,IL-10明显升高(P<0.05),表明一定剂量的ATL前列腺腔注射剂与阿司匹林直肠给药能有效降低COX-2、IL-6的水平,提升IL-10的水平。见表2。
表2 各组大鼠血清中COX-2、IL-6、IL10表达水平的比较(±s)
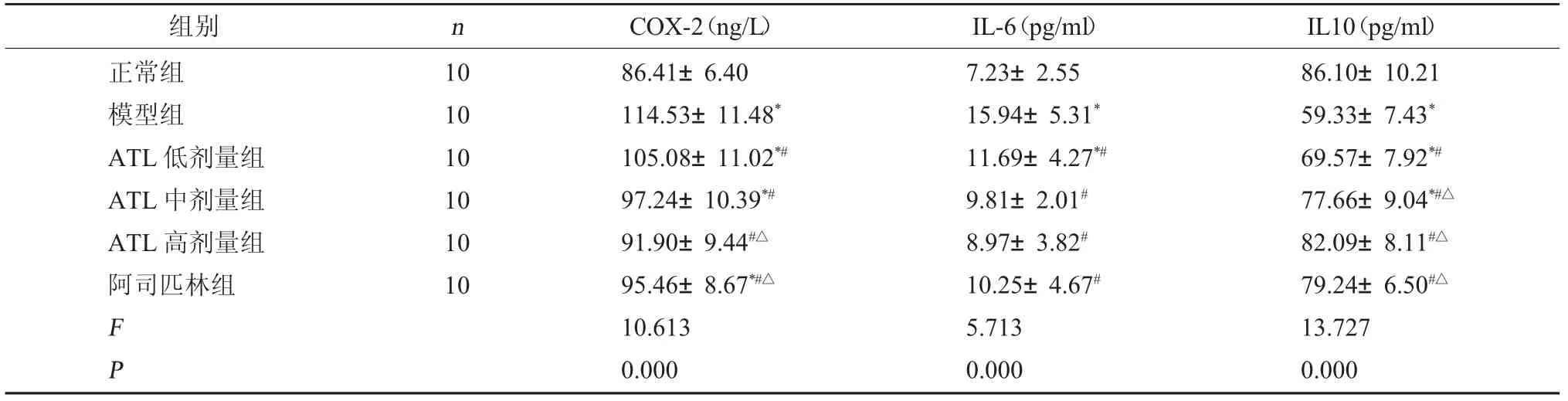
表2 各组大鼠血清中COX-2、IL-6、IL10表达水平的比较(±s)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与ATL低剂量组相比,△P<0.05。
组别 n COX-2(ng/L) IL-6(pg/ml) IL10(pg/ml)正常组模型组ATL低剂量组ATL中剂量组ATL高剂量组阿司匹林组10 10 10 10 10 10 F P 86.41±6.40 114.53±11.48*105.08±11.02*#97.24±10.39*#91.90±9.44#△95.46±8.67*#△10.613 0.000 7.23±2.55 15.94±5.31*11.69±4.27*#9.81±2.01#8.97±3.82#10.25±4.67#5.713 0.000 86.10±10.21 59.33±7.43*69.57±7.92*#77.66±9.04*#△82.09±8.11#△79.24±6.50#△13.727 0.000
2.3 大鼠前列腺组织病理形态结果HE染色后显示的大鼠前列腺组织的病理变化为:正常组腺体上皮组织结构匀称完整,排列分布有序,腔内有较丰富的蛋白性液体,细胞间质中无明显炎症细胞浸润,纤维及肌细胞也发育正常;模型组腺体上皮组织萎缩非常严重且结构极度不完整,排列杂乱无序,有大量炎症细胞浸润肿大的间质和增生的纤维。ATL低剂量组上皮组织萎缩且结构破坏减轻,间质肿大和组织增生减轻,炎症细胞稍微减少,炎症消退较明显。ATL中剂量组上皮组织轻微萎缩,结构较完整,少许炎症细胞浸润轻度水肿的间质。ATL高剂量组和阿司匹林组腺体组织结构基本恢复正常,间质肿大及纤维增生不明显,无明显炎症情况。见图1。

图1 大鼠前列腺组织病理形态
2.4 各组前列腺细胞凋亡百分率的比较与正常组相比,ATL高剂量组的前列腺细胞凋亡百分率无明显差别(P>0.05),而模型组明显降低(P<0.05);与模型组相比,ATL中、高剂量组、阿司匹林组的前列腺细胞凋亡百分率均明显升高(P<0.05),表明ATL高剂量组的药物能有效增强前列腺细胞的凋亡能力。见表3。
表3 各组前列腺细胞凋亡百分率的比较(±s)

表3 各组前列腺细胞凋亡百分率的比较(±s)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与ATL低剂量组相比,△P<0.05。
组别 n 凋亡百分率(%)正常组模型组ATL低剂量组ATL中剂量组ATL高剂量组阿司匹林组10 10 10 10 10 10 F P 12.97±6.01 4.86±1.21*7.09±1.85*8.93±2.86*#10.48±4.77#△9.38±3.43*#7.119 0.000
2.5 各组PCNA表达百分率的比较与正常组相比,ATL高剂量组和阿司匹林组的PCNA表达百分率无明显差别(P>0.05),而模型组明显升高(P<0.05);与模型组相比,ATL中、高剂量组、阿司匹林组的PCNA表达百分率均明显降低(P<0.05),表明ATL高剂量组和阿司匹林组的药物能显著抑制PCNA的表达。见表4。
表4 各组PCNA表达百分率的比较(±s)

表4 各组PCNA表达百分率的比较(±s)
注:与正常组相比,*P<0.05;与模型组相比,#P<0.05;与ATL低剂量组相比,△P<0.05。
组别 n PCNA表达百分率(%)正常组模型组ATL低剂量组ATL中剂量组ATL高剂量组阿司匹林组10 10 10 10 10 10 F P 9.57±2.35 21.67±8.09*17.12±5.60*14.32±5.18*#10.93±3.27#△12.10±4.73#△3.868 0.005
3 讨论
CNP作为男科和泌尿外科最为棘手的疾病之一,具有发病缓慢,病因病理复杂,症状表现多样化,病程迁延,反复发作,经久难愈的临床特点[6]。目前CNP的治疗方法很多[7],包括西医的抗生素、抗炎类等药物治疗和直肠激光、体外射频等物理疗法以及中医的针灸治疗、中药熏洗外治等方法,但治疗效果不佳且不良反应较大,给患者带来了极大的生理痛苦及精神负担[8]。近年来,针对CNP的研究逐渐增多,其病因和发病机制仍尚不明确[9],随着CNP患者日益增多,对其治疗方法的研究也极其重要。LX是花生四烯酸衍生的内源性脂质介质,因其强效抗炎作用,被当成当前炎症消退机制研究和新型抗炎促消退药物开发的关键靶点[10]。ATL是LX的一种,通过外源性给予ATL可以降低急性损伤小鼠炎症介质的释放,使急性肺损伤的病理状态得到恢复[11]。有研究发现,ATL对慢性炎症抑制作用同样显著,低剂量的阿司匹林通过内源性诱生LX,可增加心肌组织炎症小鼠体内ATL的水平,明显改善了小鼠心肌缺血与损伤时的炎症状态[12]。本实验采用大鼠去势结合皮下注射苯甲酸雌二醇(0.30 mg/kg)法构建CNP大鼠模型,结果显示模型组中的前列腺湿质量和指数相较于正常组明显更高;病理学形态显示,模型组中腺体上皮组织被破坏,结构极度不完整,大量炎症细胞浸润肿大的间质和增生的纤维,表明CNP大鼠模型建造成功。
本研究通过腹腔注射法外源性给予ATL药物和由小剂量纳米释缓型阿司匹林栓剂通过直肠给药法内源性诱生ATL,进一步探索ATL对CNP大鼠的治疗作用。大鼠前列腺指数和病理学形态显示,ATL高剂量组和阿司匹林组的前列腺湿质量和指数相较于模型组显著降低,而且这两组的前列腺组织结构、生理功能基本恢复正常,无明显炎症情况,这表明ATL药物和小剂量纳米释缓型阿司匹林栓剂能有效改善CNP大鼠的炎症状态,恢复其生理组织。在CNP的病情进展中,炎症反应起到至关重要的作用,炎症因子的水平变化也影响着CNP的发生发展[13]。有研究发现,ATL可以抑制中性粒细胞在炎症部位的募集,调节促炎因子和抗炎因子的平衡,降低炎症程度,修复病理组织[14]。本研究为了进一步了解ATL对CNP大鼠的炎症水平的影响,选择COX-2、IL-6、IL-10作为检测对象。COX-2是参与ATL和前列腺素生成并在病理状态下高表达的重要炎症因子[15];IL-6、IL-10分别作为促炎和抗炎细胞因子参与细胞增殖、凋亡等生物进程,IL-6可以促进细胞活化,从而导致细胞恶性坏死,IL-10则可以减轻细胞炎症状态[16~17]。本研究通过酶联免疫吸附法检测得出,ATL药物和阿司匹林栓剂可以显著降低血清COX-2、IL-6水平,升高血清IL-10的水平,且ATL高剂量组与正常组结果无明显差别,其疗效要优于中、低剂量组;阿司匹林组中对各血清水平的影响效果均低于ATL高剂量组,其原因可能是前列腺腔直接注射外源性ATL药物可以精确到达病灶,节省运行时间的同时使ATL与受体大量、高效结合。有研究发现,腹腔注射ATL可以降低急性肾损伤小鼠中促炎因子的表达,从而达到保护的目的[18]。
前列腺组织细胞凋亡和增殖失衡是导致CNP发病的关键性因素,细胞凋亡是一种受生理系统控制的细胞正常死亡过程,其平衡有利于内环境的稳定[19]。PCNA是一种参与真核细胞DNA合成的重要的细胞核多肽,其表达水平与细胞增殖状态密切相关[20]。本研究为了探究ATL对CNP大鼠前列腺细胞凋亡和增殖的影响,通过TUNEL染色和免疫组化检测得出,与模型组相比,ATL中、高剂量组、阿司匹林组的前列腺细胞凋亡百分率均明显升高,PCNA表达百分率均明显降低,表明一定剂量的ATL药物和内源性诱生ATL均能有效增强前列腺细胞的凋亡能力,抑制PCNA的表达水平。
综上所述,ATL药物、小剂量纳米缓释型阿司匹林栓剂能调节大鼠前列腺细胞凋亡和增殖的平衡,对CNP具有一定的治疗作用,其机制可能与调节血清COX-2、IL-6、IL-10水平有关。以往研究中,有关ATL在CNP治疗方面的研究较少,本研究为临床治疗CNP提供了新的理论思路。
