TIM-3和CTLA-4基因多态性在HBV感染和HCC中的作用
2022-08-04张国妤黎巧信陆宏伟
张国妤,卢 乐,黎巧信,陆宏伟
(1西安交通大学第一附属医院感染科,西安 710061;2西安交通大学第二附属医院普外科;*通讯作者,E-mail:luler2008@163.com)
乙型肝炎病毒(hepatitis B virus, HBV)感染可以诱导机体产生急性和慢性肝病,对全球人群的健康产生了巨大影响。人群感染HBV后,部分可逐渐转变为慢性肝炎(chronic hepatitis, CH),在体内免疫反应的介导下,可逐渐发展为肝硬化(cirrhosis of liver, LC)、肝细胞癌(hepatocellular carcinoma, HCC),甚至重型肝炎[1]。HBV感染后能否被机体清除,与宿主的免疫功能强弱密切相关[2]。与免疫调节呈负性相关的几个重要的免疫抑制性分子—程序性细胞死亡分子-1(programmed cell death-1, PD-1)、细胞毒性T淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen-4, CTLA-4)、T细胞免疫球蛋白及黏蛋白分子-3(T cell immunoglobulin and mucin domain-3, TIM-3)越来越受到人们的关注[3,4]。这些分子高表达后,可引起T细胞、树突状细胞、单核细胞等免疫细胞功能下降,导致机体不足以抑制HBV的感染以及由这些感染造成的损伤[5]。
这些免疫抑制性分子不仅与病毒感染相关,也在肿瘤调控中发挥着重要作用,参与肿瘤细胞和肿瘤浸润淋巴细胞的免疫逃逸和免疫应答。许多研究发现,肿瘤微环境能影响某些免疫调节因子的功能,而这些因子通过调节机体免疫应答进而促进或者抑制肿瘤生长[6]。CTLA-4可以与T细胞表面的协同刺激分子受体(CD28)竞争结合抗原提呈细胞表面的CD80/86,抑制CD28传导共刺激信号,阻止T细胞的增殖与活化。TIM-3则在维持免疫平衡和肿瘤免疫调节中发挥着重要作用,肿瘤细胞可利用该基因逃避机体的免疫监视[4,7]。
HBV感染机体以后的临床转归和HCC的发生发展不仅与宿主的免疫功能有关,也与遗传因素密切相关。而在遗传因素中,许多基因的单核苷酸多态性(single nucleotide polymorphism, SNP)与HBV感染的不同结局以及HBV感染相关性HCC相关[8,9]。在以前研究中,已证实CTLA-4 +49基因多态性与HBV感染相关,TIM-3 -1516 G/T基因多态性与HBV感染和HCC相关[8,9]。本研究拟进一步探讨二者联合与HBV感染及HCC的关系。
1 资料与方法
1.1 病例来源
收集西安交通大学第一附属医院2011年8月至2013年6月慢性HBV感染者439例(男333例,女106例),年龄(39.34±13.16)岁。所有病例的诊断均符合2010年中华医学会感染病学分会、肝病学分会联合修订的慢性乙型肝炎诊断标准,并排除合并其他肝脏疾病(甲型、丙型、丁型、戊型病毒性肝炎、药物性肝炎、脂肪性肝炎、酒精性肝炎、自身免疫性肝炎、Wilson’s病)、可引起机体发生高代谢的疾病(包括糖尿病、获得性免疫缺陷综合征、甲状腺功能亢进)、伴随严重的心血管系统、呼吸系统以及肾功能损害和年龄不满18岁的患者。439例HBV感染者的临床分型为无症状携带者(asymptomatic carriers,ASC)48例,慢性肝炎154例,肝硬化134例和肝癌103例。健康对照者220例(男163例,女57例),为中国陕西籍或长期居住在陕西地区无血缘关系的健康献血员和健康体检者,年龄(38.68±14.09)岁。两组间年龄和性别的差异均无统计学意义(P>0.05)。所有研究对象均知情同意和自愿参加。
1.2 主要试剂
购买北京天根生化科技有限公司的血液基因组DNA提取试剂盒,购买西安润德生物技术有限公司的2×Taq PCR Mix,购买大连宝生物工程有限公司DNA Marker。
1.3 DNA提取
所有受试者清晨空腹抽全血2 ml,用EDTA抗凝,-20 ℃保存待提取人类基因组DNA。用天根血液基因组DNA提取试剂盒提取基因组DNA。按说明书操作步骤如下:①取200 μl加入EDTA抗凝剂的血液,加入1.5 ml的离心管中,向管中加入20 μl蛋白酶K溶液,混匀。②加入200 μl缓冲液GB,充分颠倒混匀,70 ℃放置10 min。③加入200 μl无水乙醇,充分振荡混匀15 s。④将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中,12 000 r/min离心30 s,倒掉废液,将吸附柱CB3放回收集管中。⑤向吸附柱CB3中加入500 μl缓冲液GD(已加入无水乙醇),12 000 r/min离心30 s,倒掉废液,将吸附柱CB3放入收集管中。⑥向吸附柱CB3中加入700 μl漂洗液PW(已加入无水乙醇),12 000 r/min离心30 s,倒掉废液,将吸附柱CB3放入收集管中。⑦向吸附柱CB3中加入500 μl漂洗液PW,12 000 r/min离心30 s,倒掉废液。⑧将吸附柱CB3放回收集管中,12 000 r/min离心2 min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。⑨将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50~200 μl洗脱缓冲液TE,室温放置2~5 min,12 000 r/min离心2 min,将溶液收集到离心管中。离心管中收集的液体即是洗脱下来的基因组DNA,置-20 ℃保存备用。
1.4 基因型分析
CTLA-4 +49 A/G(rs231775)和TIM-3 -1516 G/T(rs10053538)多态性的基因型分别采用限制性片段长度多态性聚合酶链反应(PCR-RFLP)技术进行分析[9,10]。引物序列、内切酶、产物长度见表1。

表1 CTLA-4和TIM-3基因多态性使用的引物序列、内切酶、PCR产物长度
使用上述引物进行PCR反应,反应体系如下:DNA 6.0 μl,2×Master Mix 12.5 μl,上下游引物各1.0 μl,ddH20 4.5 μl,总体系25 μl;反应条件如下:94 ℃预变性3 min,94 ℃变性30 s,64 ℃(CTLA-4 +49 A/G)或59 ℃(TIM-3 -1516 G/T)退火30 s,72 ℃延伸1 min,72 ℃延伸10 min,共30个循环。
1.5 统计学分析
使用SPSS 16.0软件(SPSS,Inc.,Chicago,IL)进行统计分析。基因型频率用Hardy-Weinberg平衡检验。采用χ2检验分析基因型频率、等位基因频率在HBV感染组与对照组的分布情况以及在肝癌组与非肝癌组的分布情况。P<0.05为差异有统计学意义。
2 结果
2.1 CTLA-4和TIM-3的基因型和等位基因
HBV感染组的CTLA-4 +49 GA、AA基因型和含A基因型(GA+AA)频率高于对照组(P<=0.001)。HBV感染组的CTLA-4 +49 A等位基因频率高于对照组(P<0.001)。HBV感染组的TIM-3 -1516 GT基因型和含T基因型(GT+TT)频率高于对照组(P<0.001)。HBV感染组的TIM-3 -1516 T等位基因频率高于对照组(P=0.002,见表2)。
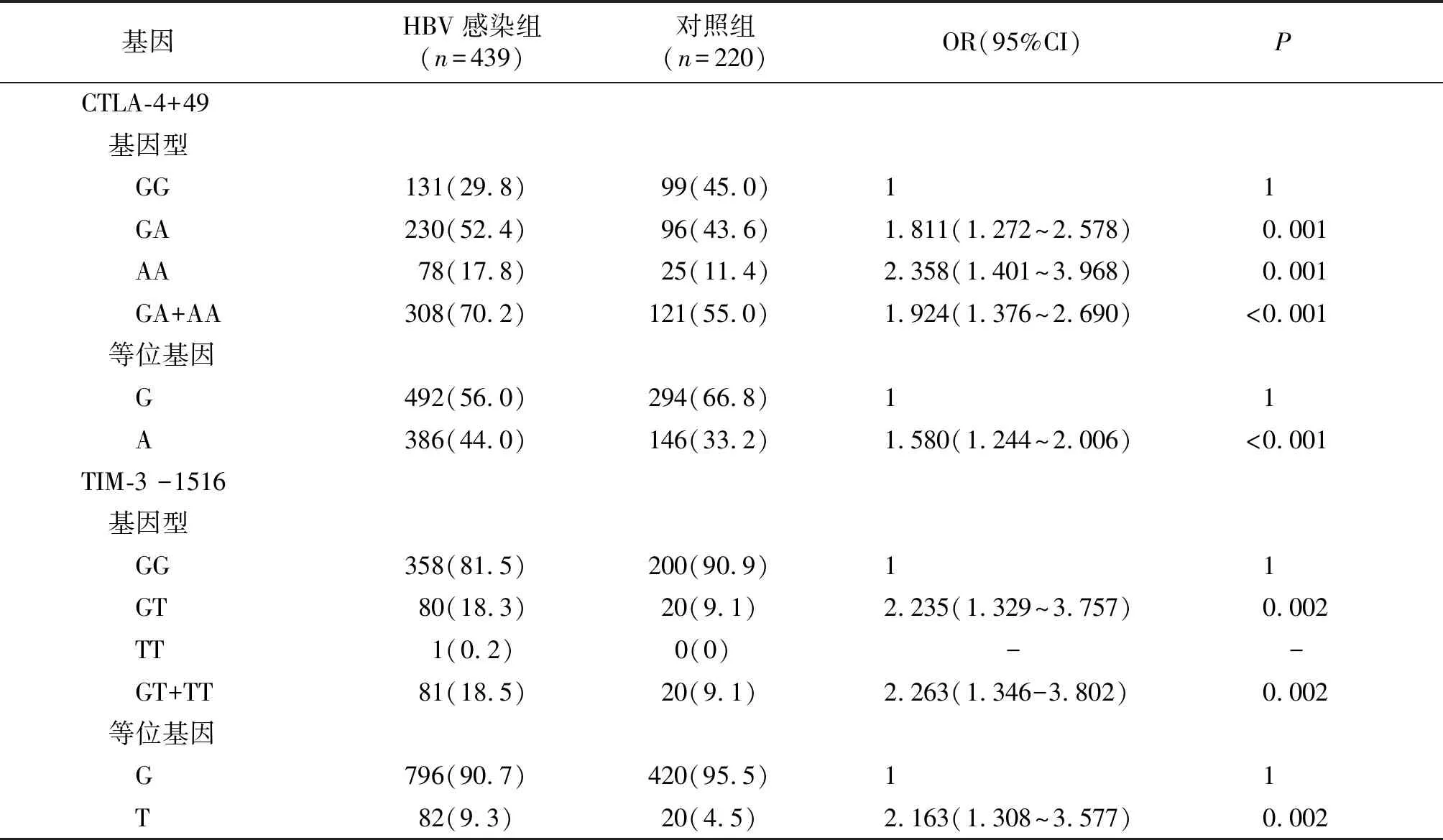
表2 CTLA-4和TIM-3基因型和等位基因频率分析 频次(%)
2.2 CTLA-4和TIM-3基因型的联合作用
以HBV易感基因型CTLA-4 +49 AA/TIM-3 -1516 GT+TT作为参照,基因型组合在HBV感染组和对照组之间无显着差异。由于CTLA-4 +49 AA/TIM-3 -1516 GT+TT基因型数量太少,将CTLA-4 +49 AA和AG基因型合并后,CTLA-4 +49 AA+AG/TIM-3 -1516 GG、CTLA-4 +49 GG/TIM-3 -1516 GG基因型组合在HBV感染组中的分布频率低于对照组(分别为P=0.048和P<0.001,见表3),即基因型组合CTLA-4 +49 AA+AG/TIM-3 -1516 GT+TT在HBV感染组中的分布频率更高。
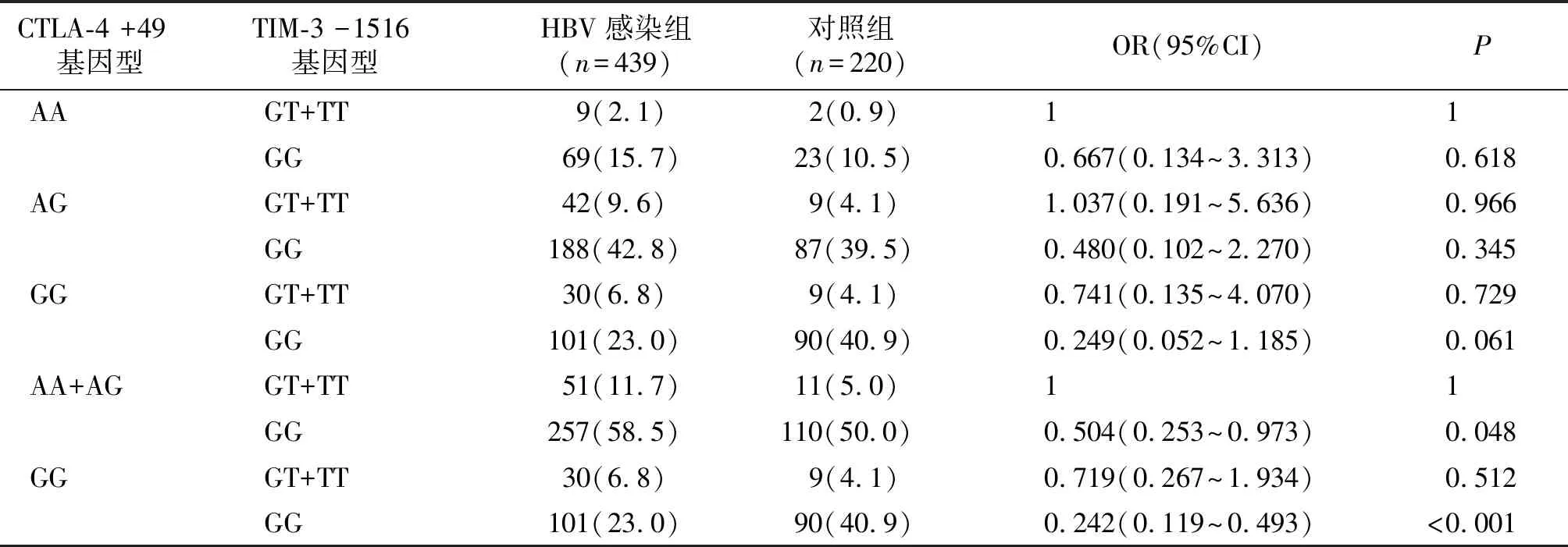
表3 CTLA-4和TIM-3在HBV感染组和对照组的基因型组合频率分析 频次(%)
2.3 CTLA-4和TIM-3基因型和等位基因与疾病严重程度的关系
将HBV感染组按疾病严重程度分为无症状携带者(ASC)组、慢性肝炎(CH)组、肝硬化(LC)组和肝癌(HCC)组,CTLA-4 +49基因型和等位基因频率在各组间差异有统计学意义,TIM-3 -1516在各组间无显著性差异(见表4)。

表4 CTLA-4和TIM-3在乙肝不同临床诊断组的基因型和等位基因频率分析 频次(%)
TIM-3 -1516基因型和等位基因进一步组间分析,HCC组的GT+TT基因型频率高于CH组(P=0.039,OR=1.923,95%CI 1.027~3.603)。HCC组的T等位基因频率高于CH组(P=0.034,OR=1.869,95%CI 1.039~3.361)。提示携带有T的基因型(GT+TT)和T等位基因可能与肝癌相关。
CTLA-4 +49基因型和等位基因进一步组间分析,ASC组的GA、AA、GA+AA基因型频率高于HCC组(分别为P=0.005,OR=3.279,95%CI 1.387~7.752;P=0.002,OR=4.821,95%CI 1.670~13.918和P=0.001,OR=3.637,95%CI 1.599~8.274),CH组的GA、AA、GA+AA基因型频率高于HCC组(分别为P<0.001,OR=2.842,95%CI 1.610~5.017;P=0.007,OR=2.892,95%CI 1.313~6.373;P<0.001,OR=2.854,95%CI 1.662~4.900),LC组的GA、AA、GA+AA基因型频率高于HCC组(P=0.028,OR=1.885,95%CI 1.068~3.328;P=0.041,OR=2.260,95%CI 1.024~4.988;P=0.012,OR=1.972,95%CI 1.154~3.371)。ASC组的A等位基因频率高于HCC组(P=0.001,OR=2.250,95%CI 1.373~3.689),CH组的A等位基因频率高于HCC组(P=0.001,OR=1.813,95%CI 1.258~2.613),LC组的A等位基因频率高于HCC组(P=0.016,OR=1.586,95%CI 1.088~2.311)。提示GG基因型和G等位基因可能与肝癌相关。
2.4 CTLA-4和TIM-3基因型组合与疾病严重程度的关系
以肝癌相关基因型CTLA-4 +49GG/TIM-3 -1516 GT+TT作为参照,基因型组合在各组间的差异有统计学意义(见表5)。进一步组间分析,CTLA-4 +49 GA/TIM-3 -1516 GG和CTLA-4 +49 AA/TIM-3 -1516 GG基因型组合在CH组的分布频率高于HCC组(分别为P=0.001,OR=5.214,95%CI 1.822~14.921和P=0.007,OR=4.924,95%CI 1.484~16.340)。
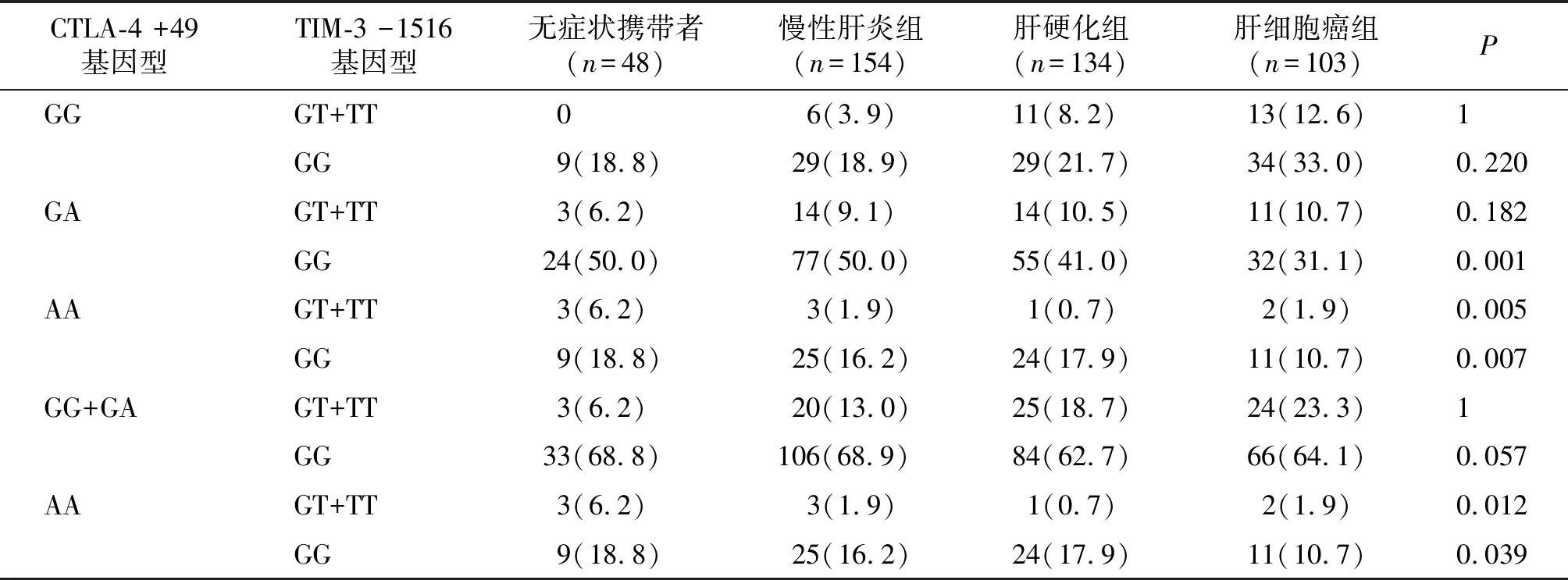
表5 CTLA-4和TIM-3在乙肝不同临床诊断组的基因型组合频率分析 频次(%)
由于CTLA-4 +49 GG/TIM-3 -1516 GT+TT基因型组合例数太少(在ASC组为0),进一步将携带有CTLA-4 +49肝癌相关基因,即GG和GA基因型合并,基因型组合在各组间的差异有统计学意义(见表5)。进一步组间分析,CTLA-4 +49 GG+GA/TIM-3 -1516 GG、CTLA-4 +49 AA/TIM-3 -1516 GT+TT和CTLA-4 +49 AA/TIM-3 -1516 GG基因型组合在ASC组的分布频率高于HCC组(分别为P=0.023,OR=4.000,95%CI 1.122~14.256;P=0.010,OR=12.000,95%CI 1.392~103.480和P=0.008,OR=6.545,95%CI 1.477~29.009)。CTLA-4 +49 AA/TIM-3 -1516 GG基因型组合在CH组的分布频率高于HCC组(P=0.031,OR=2.727,95% CI 1.082~6.876)。
2.5 CTLA-4和TIM-3基因型与肝癌的关系
以HCC易感基因型CTLA-4 +49 GG作为参照,非HCC组(ASC、CH和LC患者)的GA基因型和AA基因型频率高于HCC组(分别为P<0.001和P=0.003)。以HCC易感基因型TIM-3 -1516 GT+TT作为参照,非HCC组的GG基因型频率高于HCC组(P=0.042,见表6)。
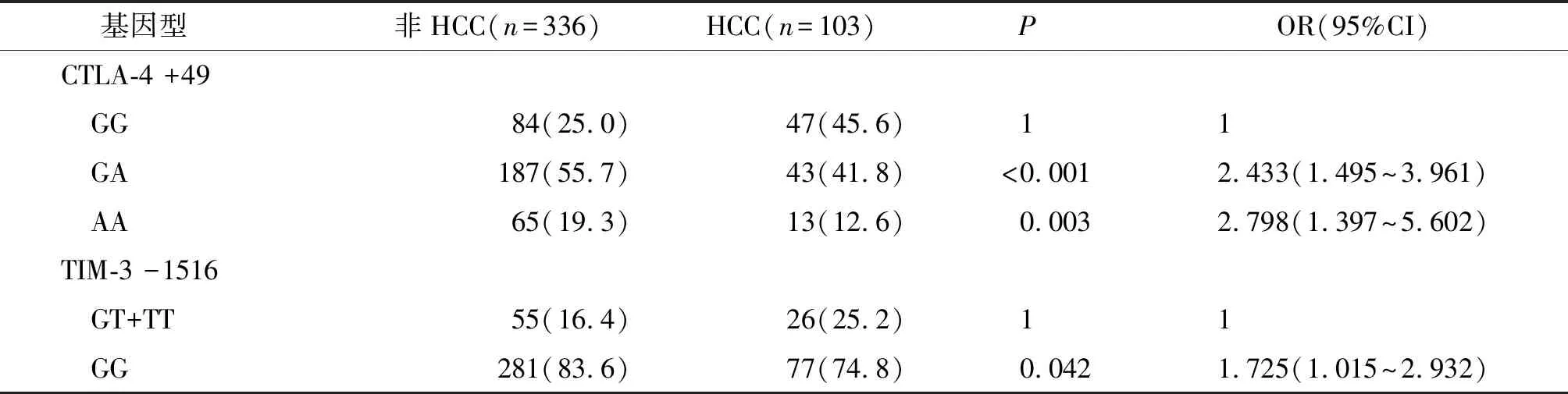
表6 CTLA-4和TIM-3基因型频率与肝癌的关系 频次(%)
进一步基因型组合分析,CTLA-4 +49 GA/TIM-3 -1516 GG和CTLA-4 +49 AA/TIM-3 -1516 GG基因型组合在非HCC组的分布频率高于HCC组(分别为P=0.001和P=0.003,见表7)。
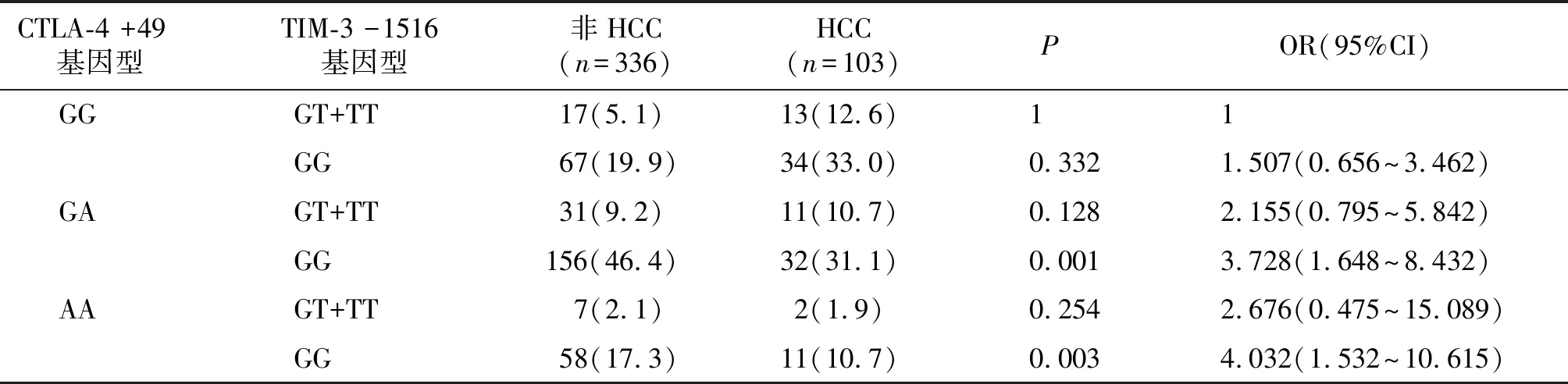
表7 CTLA-4和TIM-3基因型组合频率与肝癌的关系 频次(%)
3 讨论
CTLA-4是由CTLA-4基因编码的一种跨膜蛋白质,主要表达于活化的T淋巴细胞表面,与T细胞表面的协同刺激分子受体(CD28)竞争,抑制T细胞的增殖与活化。其外显子1的+49位点A/G突变会导致丙氨酸转变为苏氨酸,并增加了CTLA-4 mRNA和蛋白的表达,增强对T细胞活化的抑制作用[11]。CTLA-4 +49 A等位基因可能通过增加细胞表面CTLA-4的表达来抑制T细胞的增殖和活化,增加HBV的易感性[10]。TIM-3也是一种负性调节分子,表达于Th1细胞、巨噬细胞、树突状细胞(DCs)、CD8+T细胞以及NK细胞等,与配体半乳糖苷酶结合蛋白9(galectin-9,Gal9)结合,参与调节细胞的凋亡和免疫耐受[12,13]。位于TIM-3启动子区的-1516 G/T位点可能通过调节这些细胞因子,与疾病的易感性或耐受性有关[14,15]。本研究结果也证实CTLA-4 +49 AA基因型和A等位基因与慢性HBV感染发生相关,TIM-3 -1516含T基因型(GT+TT)和T等位基因也与HBV感染相关。基因型组合进一步增加了HBV感染的风险。CTLA-4 +49 AA+AG/TIM-3 -1516 GT+TT基因型组合分别增强了慢性乙型肝炎的发病风险,与CTLA-4 +49 AA+GG相比,OR从1.924增至4.131,与TIM-3 -1516 GG+TT基因型相比,OR从2.263增至4.131。因此,CTLA-4 +49基因与TIM-3 -1516基因结合时,它们的相互作用可能增加HBV感染的易感性。
免疫调节信号通路在肿瘤发生的调控中起着重要作用,参与肿瘤细胞和肿瘤浸润淋巴细胞的免疫逃逸和免疫应答。许多研究发现,肿瘤微环境可以影响某些免疫调节因子的功能,这些因子通过调节免疫应答促进或抑制肿瘤生长[16,17]。CTLA-4和TIM-3均属于这一重要的免疫调节因子。降低CTLA-4的表达可增强T细胞功能,增强机体的抗肿瘤免疫功能和抗癌能力。位于CTLA-4外显子区的+49位点基因多态性同样会通过影响蛋白质的氨基酸序列而影响CTLA-4蛋白的表达,在肺癌、结直肠癌以及肝癌等肿瘤中均有研究,CTLA-4 +49GG基因型和G等位基因与肝癌、结直肠癌、肺癌的易感性相关[18-20]。TIM-3也与许多肿瘤的发生、发展、临床分期和肿瘤浸润密切相关,高水平TIM-3预示肿瘤恶性度较高,患者的总体生存率更低且预后差[21,22]。而TIM-3的基因多态性也与许多肿瘤的发生密切相关。胃癌患者的TIM-3 -574G/T,-882C/T、-1516G/T基因多态性与胃癌显著相关,+4259 G/T基因型与胃癌的远处转移有关[23]。TIM-3 -1516G/T多态性也与HCC的一些性状相关,包括肿瘤分级和淋巴结转移[9]。近期,也有一项meta分析证实,TIM-3 -1516 G/T基因位点与人类许多癌症的风险增加有关[24]。本研究结果与上述结果也是一致的。CTLA-4 +49 GG基因型、G等位基因,TIM-3 -1516含T基因型(GT+TT)和T等位基因与HCC的发生相关。当CTLA-4和TIM-3基因型组合后,基因型组合也增加了HCC的发生风险。CTLA-4 +49 GG/TIM-3 -1516 GT+TT基因型组合分别增强了HCC的发病风险,与CTLA-4 +49 GG基因型相比,OR从2.798增至4.032,与TIM-3 -1516 GT+TT基因型相比,OR从1.725增至4.032。
但是,本研究也存在不足之处:首先,研究样本比较小,HBV感染组为439例,因此,在进一步分组和基因分型后,每个组别的例数比较少,有些组别数只有1个或0个,在分析时需要将这些组与其他组合并后进行分析。第二,本研究为单中心研究,研究队列仅为西安交通大学第一附属医院的研究人群,大规模的多中心的病例对照研究将会更有说服力。
总之,CTLA-4和TIM-3的表达水平、遗传变异与慢性HBV感染和HCC的发生、发展密切相关,为从基因水平探讨HBV感染易感性、疾病进展以及结局提供依据。在本研究基础上,进一步进行大样本多中心的队列研究,探讨多个基因的协同或阻遏作用,有助于从多基因角度了解HBV感染发生和发展的机制,为HBV感染基于基因信息的个体化防治提供新的策略。
