臭氧关节腔注射对胶原诱导性关节炎大鼠破骨细胞相关分子的作用
2022-08-04望雪雪刘宁宁王海瑶张莉芸高晋芳温晓婷郭瑞团任丽民高文琴张丽中张改连
望雪雪,刘宁宁,王海瑶,张莉芸,高晋芳,温晓婷,郭瑞团,和 平,任丽民,高文琴,张丽中,张改连,2*
(1山西医科大学第三医院,山西白求恩医院,山西医学科学院,同济山西医院风湿免疫科,太原 030032;2山西医科大学第五医院,山西省人民医院风湿免疫科;*通讯作者,E-mail:13754820091zgl@sina.com)
类风湿关节炎(rheumatoid arthritis,RA)是一种以关节滑膜炎症为特征的慢性自身免疫性疾病,其病理特点为大量炎性细胞浸润,导致滑膜增生、血管翳形成,最终导致关节软骨和骨破坏[1]。破骨细胞异常活化介导的骨侵蚀在RA骨破坏中发挥重要作用。核因子κB受体活化因子(receptor activator of nuclear factor-κB,RANK)与表达于破骨细胞前体细胞表面的RANK配体(RANK ligand,RANKL)结合,可促进破骨细胞及其前体细胞分化成熟和活化,是破骨细胞存活、分化、激活过程中的主要介质。骨保护素(osteoprotegerin,OPG)和肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)是调节RANKL-RANK信号的两种主要蛋白。OPG是RANKL的诱导受体,可以阻断RANKL-RANK信号,减少破骨细胞的产生。在RA患者滑膜组织中RANKL/OPG比值明显增加,进而促进破骨细胞过度分化、激活,引起骨质破坏[2]。TRAF6是一种衔接分子,在RANKL-RANK信号通路的初始阶段被招募,并通过激活丝裂原活化蛋白激酶(MAPKs)、NF-κB和活化蛋白-1(AP-1)介导破骨细胞的分化[3,4]。
臭氧(ozone,O3)具有抑制病原微生物、激活氧代谢、调节免疫系统的作用,且副作用小[5],被广泛用于治疗各种疾病,如病毒性疾病、循环系统疾病、退行性病变、风湿性疾病/关节炎、艾滋病等[6]。RA动物模型的研究表明,经O3处理可减轻关节炎症,抑制促炎细胞因子(IL-1β、TNF-α、IL-12、IL-6)和血管内皮生长因子(VEGF)的产生,增加抗炎细胞因子IL-10的表达,此外还可重建细胞氧化还原平衡[7-10]。目前臭氧治疗对RA骨破坏的作用及其相关机制尚不清楚。我们的前期研究显示,O3关节腔注射可延缓CIA大鼠的关节影像学进展,降低血清RANKL水平及RANKL/OPG比值[11],由此推测O3治疗也可能通过影响骨代谢等非炎症靶向机制发挥治疗RA的作用。本研究采用O3关节腔注射对胶原诱导性关节炎(collagen-induced arthritis,CIA)大鼠进行干预,评估其对关节滑膜组织的影响,检测各组CIA大鼠滑膜组织TRAF6蛋白的表达,以及滑膜组织、淋巴结、脾脏组织中RANKL、OPG、RANKL/OPG和TRAF6 mRNA水平,从破骨细胞相关分子角度探讨臭氧治疗RA骨破坏的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 所有实验动物护理和实验步骤均按照山西医科大学动物护理和使用委员会指南进行。健康雌性Wistar大鼠40只(年龄7周左右,体质量160~180 g),饲养条件:20 ℃室温,50%相对湿度,定时喂食,自由摄水,光照周期(8 h光线和16 h黑暗)。
1.1.2 主要试剂与仪器 牛Ⅱ型胶原蛋白:Sigma公司(美国)。完全弗氏佐剂(CFA):Sigma公司(美国)。TRAF6单克隆抗体:Abcam有限公司(美国)。Rotor-Gene SYBR Green PCR试剂盒:Qiagen公司(德国)。医用臭氧发生仪:赫尔曼公司(德国)。X射线摄影设备:美国飞利浦公司。LEICA RM-2235型切片机:LEICA公司(德国)。Image-ProPlus 5.1图形软件分析系统:美国Media Cybernetics公司。Olympus BX41照相显微镜:美国Media Cybernetics公司。Rotor-Gene Q实时荧光定量PCR仪:QIAGEN公司(德国)。
1.2 方法
1.2.1 CIA大鼠模型的制备 大鼠被随机分为正常对照组(n=8)和模型组(n=32),CIA模型的制备参照以往文献[12]。牛Ⅱ型胶原蛋白在0.1 mol/L的冰乙酸中溶解,浓度为2 mg/ml,在4 ℃冰箱过夜,用完全弗氏佐剂(CFA)等量乳化。制成含牛Ⅱ型胶原1 mg/ml的乳化液。用5%的水合氯醛5 ml/kg腹腔注射进行麻醉,初次免疫分别在大鼠背部3点(上背部2点、下背部1点)、尾根部和任一后足掌皮内注射乳化液共0.5 ml(含牛Ⅱ型胶原0.5 mg)。加强免疫于1周后在大鼠腹腔注射0.2 ml乳化液(含牛Ⅱ型胶原蛋白0.2 mg),诱导建立CIA模型。正常对照组注射等量0.9%氯化钠注射液。32只雌性大鼠中24只成功建立CIA模型。
1.2.2 分组及干预方案 造模成功的24只大鼠被随机分为3组(8只/组):CIA模型组(CIA组)、甲氨蝶呤组(MTX组)和臭氧组(O3组)。CIA组指造模成功且未注射任何药物的CIA大鼠;MTX组给予腹腔注射甲氨蝶呤(MTX)0.9 mg/kg,每周1次,连续3周;O3组在大鼠后足双踝关节局部注射O3(40 μg/ml)1 ml,每周1次,连续3周[2]。正常对照组和CIA组不予以任何药物处理。
1.2.3 滑膜、淋巴结及脾脏组织标本的来源及处理 各组Wistar大鼠在初次免疫后第5周时腹腔注射5%的水合氯醛(5 ml/kg)麻醉,采用颈椎脱位法处死,解剖获取新鲜双踝关节滑膜、淋巴结和脾脏。一部分组织浸泡在4%多聚甲醛中固定过夜,石蜡包埋进行免疫组化检测;另一部分在液氮中储存以便进行RT-PCR检测。
1.2.4 免疫组化检测双踝关节滑膜组织中TRAF6蛋白的表达 滑膜组织经冰冻石蜡包埋后,用切片机切成5 μm切片,黏附于清洁载玻片上,放置在烤箱30 ℃恒温干燥4 h以上。石蜡切片在二甲苯Ⅰ、Ⅱ、Ⅲ溶液中分梯度脱蜡各10 min,3% H2O2室温下孵育10 min以消除内源性过氧化物酶的活性。抗原修复,4 ℃过夜,然后用抗TRAF6单克隆抗体室温孵育40 min,用磷酸盐缓冲盐水(PBS)冲洗后,切片与聚合物辅助剂孵育20 min,PBS冲洗,滴加羊抗兔IgG多聚体抗体在37 ℃孵育30 min后用PBS洗涤,用二氨基联苯胺冲洗切片,然后用清水反复冲洗,苏木精染色,脱水封片,在光学照相显微镜上获取放大200倍的图像,并使用Image-ProPlus 5.1软件进行分析。
1.2.5 RT-PCR检测双踝关节滑膜组织、淋巴结、脾脏组织中RANKL、OPG、TRAF6 mRNA表达水平 用RT-PCR技术检测各组CIA大鼠双踝关节滑膜、淋巴结、脾脏组织中RANKL、OPG、TRAF6 mRNA表达水平。总RNA提取过程如下:用Trizol试剂对组织样品裂解,裂解液在12 000 r/min和4 ℃下离心15 min。用苯酚-氯仿混合物从上清液中提取RNA,用异丙醇沉淀,7 500 r/min,4 ℃离心5 min,弃上清。将RNA沉淀重新溶解在焦炭酸二乙酯(DEPC)处理过的水中,琼脂糖凝胶电泳显示RNA。利用Primer 3.0软件设计PCR引物,序列见表1。RT-PCR采用Rotor-Gene SYBR Green PCR试剂盒,在Rotor-Gene Q实时荧光定量PCR仪上进行,每个样品进行3次重复分析。

表1 引物名称及序列
1.3 统计学方法
应用SPSS 22.0软件进行统计分析。正态分布数据以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA);若不符合正态分布,采用Wilcoxon秩和检验,两样本比较用Man-whttey检验,多组间比较采用Kruskal-Wallis秩和检验。P<0.05为差异具有统计学意义。
2 结果
2.1 O3治疗可抑制CIA模型大鼠双踝关节滑膜组织中TRAF6蛋白表达
免疫组化分析显示,在各组大鼠滑膜组织中TRAF6为胞浆型表达;正常对照组大鼠滑膜组织可见2~3层滑膜细胞,核周淡黄色着色,TRAF6呈阴性表达(见图1A);CIA模型组大鼠滑膜组织可见20~30层滑膜细胞,显示滑膜增生,核周胞浆弥漫分布深褐色着色,TRAF6呈强阳性表达(见图1B);O3治疗组大鼠滑膜组织可见2~3层滑膜细胞,几乎接近正常的滑膜组织,胞浆呈蓝色染色,TRAF6呈近似阴性表达(见图1C);MTX治疗组大鼠滑膜组织可见4~6层滑膜细胞,增生较CIA组减轻,胞浆呈褐色着色,TRAF6呈弱阳性表达(见图1D)。经O3和MTX治疗后,TRAF6表达水平明显下降,表现为阳性免疫染色区域面积减少且染色变浅。以上结果表明,与MTX作用相似,O3治疗可抑制CIA模型大鼠滑膜组织中TRAF6蛋白表达。
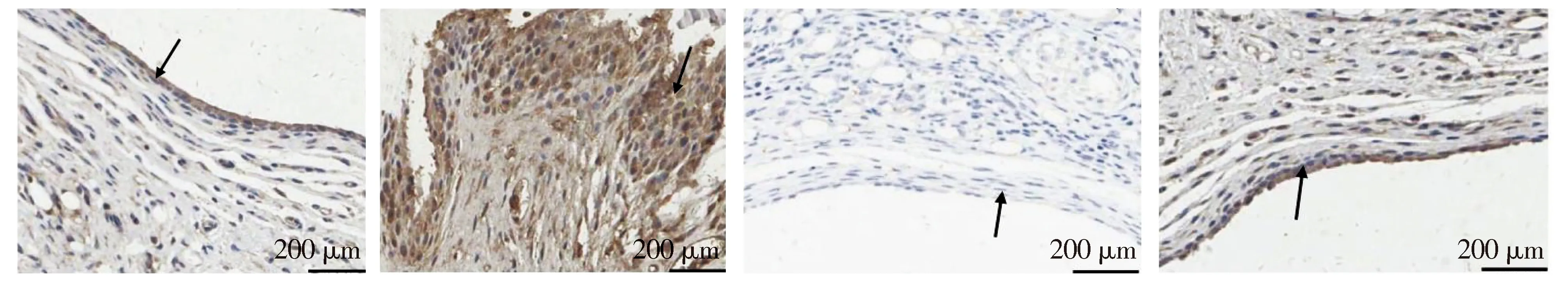
A.正常对照组 B.CIA模型组 C.O3组 D.MTX组图1 免疫组化检测大鼠滑膜组织TRAF6的表达 (苏木精染色,×200)Figure 1 Expression of TRAF6 in synovial tissue of rats by immunohistochemical staining (hematoxylin staining,×200)
2.2 O3治疗可抑制双踝关节滑膜组织、淋巴结和脾脏组织中RANKL、TRAF6 mRNA表达
RT-PCR结果显示,与正常对照组相比,CIA组大鼠滑膜、淋巴结、脾脏组织中RANKL、TRAF6 mRNA表达水平显著升高(P<0.05),O3组和MTX组大鼠滑膜、淋巴结、脾脏组织中RANKL、TRAF6 mRNA的表达水平均显著低于CIA组,差异具有统计学意义(P<0.05),O3组与MTX组相比差异均无统计学意义(P>0.05,见图2,图3)。

与正常对照(Con)组比较,*P<0.05;与CIA组比较,#P<0.05图2 不同组织中RANKL mRNA表达水平Figure 2 The expression levels of RANKL mRNA in different tissues

与正常对照组(Con)比较,*P<0.05;与CIA组比较,#P<0.05图3 不同组织中TRAF6 mRNA表达水平Figure 3 The expression levels of TRAF6 mRNA in different tissues
CIA组大鼠脾脏组织中OPG mRNA表达水平显著高于正常对照组(P<0.05),O3组和MTX组大鼠脾脏组织中OPG mRNA的表达水平均显著低于CIA组(P<0.05),而在滑膜和淋巴结中各组比较无统计学差异(P>0.05,见图4)。O3组RANKL/OPG比值在滑膜和淋巴结中显著低于CIA组(P<0.05),与MTX组相比差异无统计学意义(P>0.05,见图5)。这些结果表明,与MTX治疗效果相似,O3关节腔注射可能通过下调CIA大鼠关节局部和免疫系统RANKL、RANKL/OPG水平,抑制TRAF6表达,介导骨破坏。

与正常对照组(Con)比较,*P<0.05;与CIA组比较,#P<0.05图4 不同组织中OPG mRNA表达水平Figure 4 The expression levels of OPG mRNA in different tissues
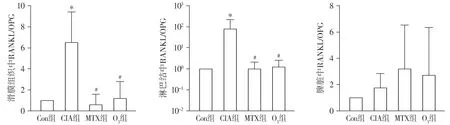
与正常对照组(Con)比较,*P<0.05;与CIA组比较,#P<0.05图5 不同组织中RANKL/OPG水平Figure 5 The levels of RANKL /OPG in different tissues
3 讨论
MTX是治疗RA的一线用药,其作用机制多样,包括抑制嘌呤和嘧啶的合成,促进腺苷和一些细胞因子的释放,抑制ROS,降低RANKL/OPG比率等,但长期使用可能会引起病理性多器官毒性,包括胃肠道毒性、肺间质纤维化,骨髓毒性、心脏毒性、肾毒性和肝毒性,从而限制了其治疗潜力[13,14]。研究表明精确治疗剂量的O3可以使人体产生适度的氧化应激,激活抗氧化系统和免疫系统,发挥抗炎作用且无明显副作用,被用于治疗RA、纤维肌痛综合征等自身免疫病中[15]。有临床研究显示MTX联合O3治疗RA患者比MTX单药治疗更能降低疾病的活动度[16]。国内外对O3治疗CIA大鼠的研究主要集中于相关炎症因子水平的探讨[6,8,9,17]。研究发现O3关节腔注射可抑制CIA大鼠关节滑液中促炎细胞因子TNF-α、IL-12的产生,促进抑炎细胞因子IL-10的产生,改善CIA大鼠关节炎症,且多次O3关节腔注射比单次应用更加有效[6]。O3关节腔注射可减轻RA大鼠关节肿胀及关节损伤,降低RA大鼠脾脏、滑膜组织中TNF-α水平[8,9]。另一项由弗氏完全佐剂(Freund’s complete adjuvant,FCA)诱导的关节炎模型中也有类似发现,O3关节腔注射可改善大鼠的关节炎症状及组织病理学表现[17]。目前,O3对RA骨破坏的作用及相关机制尚不清楚。我们的前期研究发现O3关节腔注射可延缓CIA大鼠的关节影像学进展,降低血清RANKL及RANKL/OPG比值,与MTX疗效相当[11]。本研究进一步证实O3关节腔注射可以减轻CIA大鼠的滑膜增生,降低CIA大鼠滑膜组织、淋巴结中RANKL、TRAF6及RANKL/OPG水平,降低脾脏组织中RANKL、TRAF6、OPG水平,且与MTX作用相当,这一发现为臭氧治疗RA相关骨侵蚀的机制提供了依据。
我们的研究发现O3治疗可抑制CIA模型大鼠滑膜组织增生,降低滑膜组织、淋巴结和脾脏RANKL的mRNA表达水平,且疗效与MTX治疗相当。RANKL在破骨细胞分化中起着重要作用,它的表达升高可预测局部骨侵蚀和骨质疏松的发生[4]。因此,抑制RANKL表达可能是一种预防RA模型大鼠骨丢失的潜在治疗策略[18]。有报道称,抗炎治疗可抑制RANK/RANKL轴[19],IL-27可通过影响RANKL信号抑制破骨细胞的生成[20]。因此,我们推测RANKL抑制骨破坏可能是通过抗炎作用引起的。目前以炎症因子为靶点的多种生物制剂,如英夫利昔单抗、阿达木单抗、托珠单抗等,它们在抑制炎症的同时还可以延缓骨破坏,这可能进一步证实了上述观点。OPG可通过竞争性结合可溶性RANKL来抑制破骨细胞的形成[21]。正常情况下,RANKL和OPG表达的平衡可维持正常骨代谢;但在RA滑膜组织中,RANKL和OPG表达失衡[2]。本研究显示O3治疗可降低滑膜和淋巴结RANKL/OPG比值和脾脏OPG mRNA表达,提示O3治疗可重建CIA模型大鼠滑膜微环境和免疫系统的RANKL/OPG平衡,这可能为O3延缓RA关节破坏及骨侵蚀的机制提供线索。
TRAF6是RANKL/RANK信号转导中的主要转运蛋白。RANKL与破骨细胞表面的RANK及其前体细胞结合,诱导TRAF6与RANK的特定位点结合,进而启动下游信号,激活细胞内MAPKs、NF-κB和AP-1,导致破骨细胞分化和激活[4]。RA患者滑膜组织中TRAF6的表达与血清骨形成指数(I型胶原N端前肽)、骨转换指数(骨钙素N端中间片段)以及滑膜炎症的严重程度呈正相关。此外,滑膜组织中TRAF6的表达促进了滑膜炎症细胞的浸润及促炎细胞因子的分泌。这些证据表明,TRAF6不仅影响骨代谢,还可参与RA的炎症反应[22-25]。因此,TRAF6可能成为治疗RA的潜在靶点。在本研究中,我们发现O3治疗降低了CIA模型大鼠滑膜、淋巴结和脾脏组织中TRAF6 mRNA的表达,且TRAF6 mRNA表达降低与滑膜增生减低有关。
骨免疫学的研究发现RANKL/OPG-TRAF6信号通路可调节疾病相关的骨代谢紊乱和免疫异常[26,27],在RA中存在相似的调控机制。针对RA骨免疫学角度的靶向治疗药物,将大大提高RA的疗效并改善预后。总之,这一系列证据表明,O3治疗可能通过RANKL/OPG-TRAF6信号通路来抑制CIA大鼠的关节炎症和骨破坏,有望成为RA的一种可选择的新的治疗方法。但本研究尚未探究不同浓度O3对CIA大鼠破骨细胞相关分子的作用,O3关节腔注射对CIA大鼠破骨细胞相关分子的作用是否具有剂量依赖性?这需要进一步的研究。
