基于Ag-CDs纳米粒子的比色法和SERS方法协同检测尿酸
2022-08-04于海波王艾琳
何 婧, 于海波, 王艾琳
(东北师范大学 物理学院, 长春 130024)
纳米酶具有稳定性高、 成本低和催化活性可调节等优点, 是天然酶的良好替代品. 目前多种纳米酶已被设计合成并应用, 包括金属纳米颗粒、 金属有机框架和氧化石墨烯等[1-5]. 此外, 碳量子点(CDs)因其优异的化学稳定性、 低毒性和易于表面改性等优点而引起人们广泛关注: Datta等[6]以碳量子点为催化剂进行了电化学水氧化的研究; Safavi等[7]合成了具有过氧化物酶催化活性的碳量子点, 并用于偶氮染料降解研究; Cailotto等[8]将碳量子点用于无金属光氧化还原催化研究; Fe2O3/CD,ZnO/CD和Au/CD等基于半导体/碳量子点和贵金属/碳量子点的纳米复合材料也表现出优异的催化活性[9-11]; 当碳量子点覆盖在金、 银等贵金属纳米颗粒上时, 复合材料表现出表面增强Raman散射(SERS)活性[12-14]; SERS可为生物化学、 生物传感、 催化和电化学提供高灵敏度检测[15-18].
尿酸是嘌呤代谢的最终产物. 尿酸水平异常可增加患痛风、 关节炎、 肾脏和心血管相关疾病的风险[19-21]. 有效检测尿酸水平对疾病的诊断和治疗具有重要意义, 传统方法通过比色反应检测尿酸[22-24]. 过氧化氢是尿酸被尿酸酶氧化的产物, 在过氧化物酶的催化下, 过氧化氢可将3,3′,5,5′-四甲基联苯胺(TMB)氧化为氧化TMB(oxTMB), 同时溶液由无色变为蓝色. 比色检测具有较高的选择性, 但检测的灵敏度较低, SERS可提高检测灵敏度.
本文用CDs还原AgNO3, 合成了核壳结构的Ag-CDs纳米粒子, 其中碳壳的厚度为2.2 nm. 用透射电子显微镜(TEM)分析Ag-CDs纳米粒子的形成过程. 与Ag纳米粒子相比, Ag-CDs纳米粒子具有优异的过氧化物酶催化活性和SERS活性. 以Ag-CDs纳米粒子为催化剂和以SERS为衬底, 通过协同比色反应和增强SERS光谱检测尿酸. Ag-CDs纳米粒子可催化过氧化氢氧化TMB形成蓝色的oxTMB, 尿酸可将oxTMB还原. 随着尿酸浓度的增加, oxTMB的SERS信号逐渐降低. 比色法和SERS协同检测方法使尿酸的检测更可靠和准确.
1 实 验
1.1 材 料
尿素、 对苯二胺、 过氧化氢(H2O2, 体积数为30%)、 柠檬酸钠、 NaOH和乙醇均购自国药化学试剂有限公司, AgNO3购自阿拉丁(上海)试剂有限公司, 4-巯基苯胺(4-ATP)购自西格玛-奥尔德里奇(上海)有限责任公司, TMB购自上海克拉马尔试剂有限公司, 葡萄糖、 KCl和NaCl购自北京化工厂, 草酸二水合物购自天津市广福科技开发有限公司, 5,5-二甲基-1-吡咯啉-N氧化物(DMOP)和尿酸购自深圳市深强科技有限公司.
1.2 仪 器
透射电子显微镜(THEMISZ型, 上海赛默飞世尔科技有限公司); X射线衍射仪(UltimaⅣ型, 日本理学公司); Fourier红外光谱仪(Nicolet iS10型, 上海赛默飞世尔科技有限公司); 紫外-可见分光光度计(UV2600型, 日本岛津仪器有限公司); 模块化荧光光谱仪(QuantaMaster8000型, 法国HORIBA科学仪器公司); Raman光谱仪(Jobin-Yvon HR800型, 法国HORIBA科学仪器公司); 电子顺磁共振波谱仪(EMX nano型, 德国布鲁克科技有限公司).
1.3 Ag-CDs纳米粒子的合成
利用水热法合成CDs[25]. 先将0.12 g尿素和0.12 g对苯二胺溶解于30 mL超纯水中, 再将溶液置于高压反应釜中, 160 ℃加热10 h. 冷却至室温后, 将深棕色的CDs溶液通过微孔膜过滤, 并用水透析. 最终得到CDs溶液的质量浓度为0.62 mg/mL. 将3 mL NaOH溶液(10 mmol/L)加入3 mL的CDs溶液(0.033 mg/mL)中, 在50 ℃水浴下加热, 边搅拌边滴加3 mL AgNO3溶液(0.2 mmol/L). 将混合溶液在50 ℃加热2 h得到Ag-CDs纳米粒子. 单独的Ag纳米粒子参照文献[26]方法合成.
1.4 SERS活性测试
以4-ATP为探针分子测试Ag-CDs纳米粒子、 Ag纳米粒子和CDs的SERS活性. 将4-ATP乙醇溶液(10-5mol/mL)分别滴加在3 mL的Ag-CDs纳米粒子、 Ag纳米粒子和CDs溶液中, 静置1 h后, 离心除去多余的4-ATP. 最后将样品滴在载玻片上, 测量3种基底的4-ATP SERS光谱.
1.5 类过氧化物酶的催化活性及动力学分析
先将1 mL的TMB(4 mmol/L)与1 mL过氧化氢(4 mmol/L)混合, 再将混合物分别加入0.5 mL的Ag-CDs纳米粒子(0.25 mg/mL)、 CDs(11 mg/L)、 Ag纳米粒子(0.25 mg/mL)和超纯水中. 每2 min测量一次溶液的吸收光谱. 通过改变TMB或过氧化氢的浓度进行稳态动力学测定. 控制过氧化氢浓度(0.8 mol/L)和Ag-CDs纳米粒子的质量浓度(0.1 mg/mL), 先将TMB的浓度由0.1 mol/L逐渐调至0.8 mol/L. 再控制TMB浓度(0.8 mol/L)和Ag-CDs纳米粒子的质量浓度(0.1 mg/mL), 将过氧化氢浓度从0.1 mol/L逐渐调至0.8 mol/L. 将溶液静置3 min后测试吸收光谱. 通过oxTMB在652 nm处的吸收光谱变化监测TMB的氧化过程. 利用米-门二氏方程式的双倒数曲线
计算米氏常数Km和最大反应速率Vmax[27].
1.6 羟基自由基检测
将DMPO作为羟基自由基的捕获剂进行电子自旋共振(ESR)光谱检测, 将0.2 mL的Ag-CDs纳米粒子、 0.01 mL的DMPO和0.02 mL过氧化氢(体积分数为30%)混合. 静置3 min后, 检测羟基自由基的ESR谱. 分别将AgCDs纳米粒子或过氧化氢与DMPO混合, 并检测ESR光谱作为对照.
1.7 尿酸的协同检测
将0.5 mL Ag-CDs纳米粒子、 1 mL过氧化氢(4 mmol/L)和1 mL的TMB(4 mmol/L)混合, 20 min后检测混合物的吸收光谱和SERS光谱. 先分别向混合溶液中加入不同浓度的尿酸溶液, 再将尿酸溶液替换为相同浓度的NaCl、 KCl、 草酸、 尿素和葡萄糖水溶液, 研究尿酸检测的选择性. 分别检测各样品的吸收光谱和SERS光谱.
2 结果与讨论
CDs的TEM和高分辨TEM(HRTEM)照片如图1所示. 由图1可见, CDs尺寸均匀, 直径约为2.5 nm, 具有良好的分散性. Ag-CDs纳米粒子的TEM和HRTEM照片如图2所示. 由图2可见, Ag核的直径为30 nm, 碳壳的厚度为2.2 nm. CDs的晶格间距为0.312 nm, Ag核的晶格间距为0.238 nm, 分别与石墨烯的(002)面和Ag的(111)面相对应, 表明Ag核的晶格结构良好, CDs具有与石墨烯相似的晶格结构. CDs和Ag-CDs纳米粒子的X射线衍射(XRD)谱如图3所示. 由图3可见, 位于28.6°处的峰来自CDs, 在38°,44°,64°和77°处的4个强峰分别对应Ag核的(111),(200),(220),(311)面, 表明Ag核结晶良好, 具有面心立方结构. CDs和Ag-CDs纳米粒子的Fourier变换红外(FTIR)光谱如图4所示. 由图4可见, CDs和Ag-CDs纳米粒子具有多个明显特征峰, 位于1 129,1 069 cm-1处的峰分别对应C—O—C的反对称和对称伸缩振动[28], 位于839 cm-1处的峰对应N—H的形变振动, 位于1 269,1 319 cm-1处的峰对应C—O振动[29]. 此外, Ag-CDs纳米粒子在1 389.7 cm-1处出现一个新的特征峰, 对应C—N振动. 因此碳膜的形成是基于氨基和羧基之间的酰胺反应.

图1 CDs的TEM和HRTEM照片Fig.1 TEM and HRTEM images of CDs

图2 Ag-CDs纳米粒子的TEM和HRTEM照片Fig.2 TEM and HRTEM images of Ag-CDs nanoparticles

图3 CDs和Ag-CDs纳米粒子的XRD谱Fig.3 XRD patterns of CDs and Ag-CDs nanoparticles

图4 CDs和Ag-CDs纳米粒子的FTIR光谱Fig.4 FTIR spectra of CDs and Ag-CDs nanoparticles


图5 CDs和Ag-CDs纳米粒子的XPSFig.5 XPS of CDs and Ag-CDs nanoparticles
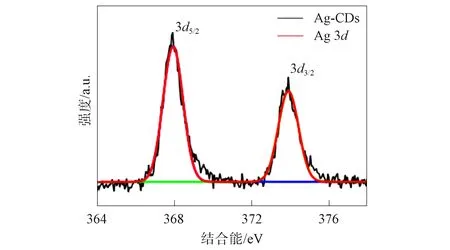
图6 Ag-CDs纳米粒子中Ag 3d的精细能谱Fig.6 Fine energy spectra of Ag 3d of Ag-CDs nanoparticles

图7 CDs和Ag-CDs纳米粒子的紫外-可见吸收光谱Fig.7 UV-Vis absorption spectra of CDS and Ag-CDs nanoparticles
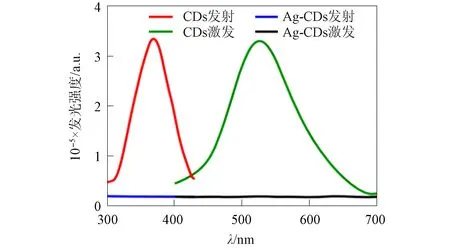
图8 CDs和Ag-CDs纳米粒子的发射光谱Fig.8 Emission spectra of CDs and Ag-CDs nanoparticles
Ag-CDs纳米粒子具有良好的SERS活性, 可用作SERS基底. 图9为探针分子4-ATP在不同基底上的SERS光谱. 由图9可见, 在1 076,1 142,1 390,1 434,1 577 cm-1处的信号峰均来自探针分子4-ATP[30], Ag-CDs纳米粒子比Ag纳米粒子具有更好的SERS活性. Ag-CDs纳米粒子增强的SERS活性是由于电磁场增强所致[31]. 图10为用三维有效差分时域法模拟Ag-CDs纳米粒子周围的光电场. 由图10可见, 在Ag核之间的纳米缝隙处光电场明显增强, 因此以Ag-CDs纳米粒子为SERS基底的探针分子信号明显增强.

图9 不同基底4-ATP的SERS光谱Fig.9 SERS spectra of 4-ATP on different substrates

图10 Ag-CDs纳米粒子的光电场模拟Fig.10 Photoelectric field simulation of Ag-CDs nanoparticles
在过氧化物酶的催化作用下, TMB被过氧化氢氧化生成蓝色溶液. 图11为TMB氧化过程中吸收光谱随时间的变化曲线, 其中插图为在TMB溶液中加入Ag-CDs纳米粒子(Ⅰ),CDs(Ⅱ),Ag纳米粒子(Ⅲ)和空白组(Ⅳ)的样品照片. 由图11可见: 在Ag-CDs纳米粒子的催化作用下, oxTMB在652 nm处的吸收峰强度增加最快, 溶液明显变蓝, 表明Ag-CDs纳米粒子具有良好的类过氧化物酶催化活性; 当以CDs为催化剂时, oxTMB吸收峰强度增加缓慢, 溶液轻微变蓝; Ag纳米粒子与空白对照组结果接近, 表明单独的Ag纳米粒子不具有催化活性. 通过稳态动力学分析进一步研究Ag-CDs纳米粒子的催化活性, 结果如图12所示, 其中: (A)为固定过氧化氢浓度, 改变TMB浓度; (B)为固定TMB浓度, 改变过氧化氢浓度. 以TMB或过氧化氢为底物观察米-门曲线. 动力学参数根据Lineweaver-Burk曲线计算. 以TMB和过氧化氢为底物的Km值分别为0.049,0.287,Vmax值分别为5.51×10-8,3.17×10-8m/s.
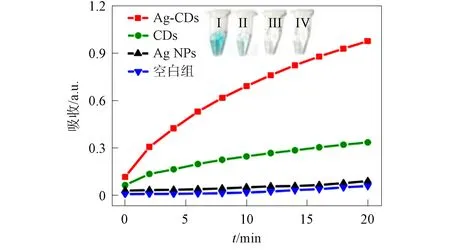
图11 不同样品中oxTMB在652 nm处 吸收光谱随时间的变化Fig.11 Changes of absorption spectra of oxTMB at 652 nm in different samples with time
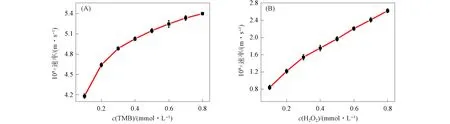
图12 稳态动力学分析Fig.12 Dynamic analysis of steady state
Ag-CDs纳米粒子在催化过氧化氢氧化TMB过程中具有较低的Km和Vmax值, 表明Ag-CDs纳米粒子对底物具有较好的亲和性, 从而表现出良好的催化活性. 以DMPO为自由基捕获剂, 不同样品中羟基自由基的ESR光谱如图13所示. 由图13可见, DMPO与过氧化氢或Ag-CDs纳米粒子的混合溶液未检测到明显的ESR信号. 当DMPO与过氧化氢和Ag-CDs纳米粒子混合时, 检测到强度比为1∶2∶2∶1的4个等距信号, 信号来自捕获了羟基自由基的DMPO. 表明过氧化氢在Ag-CDs纳米粒子的催化下被分解为羟基自由基, TMB被羟基自由基氧化.
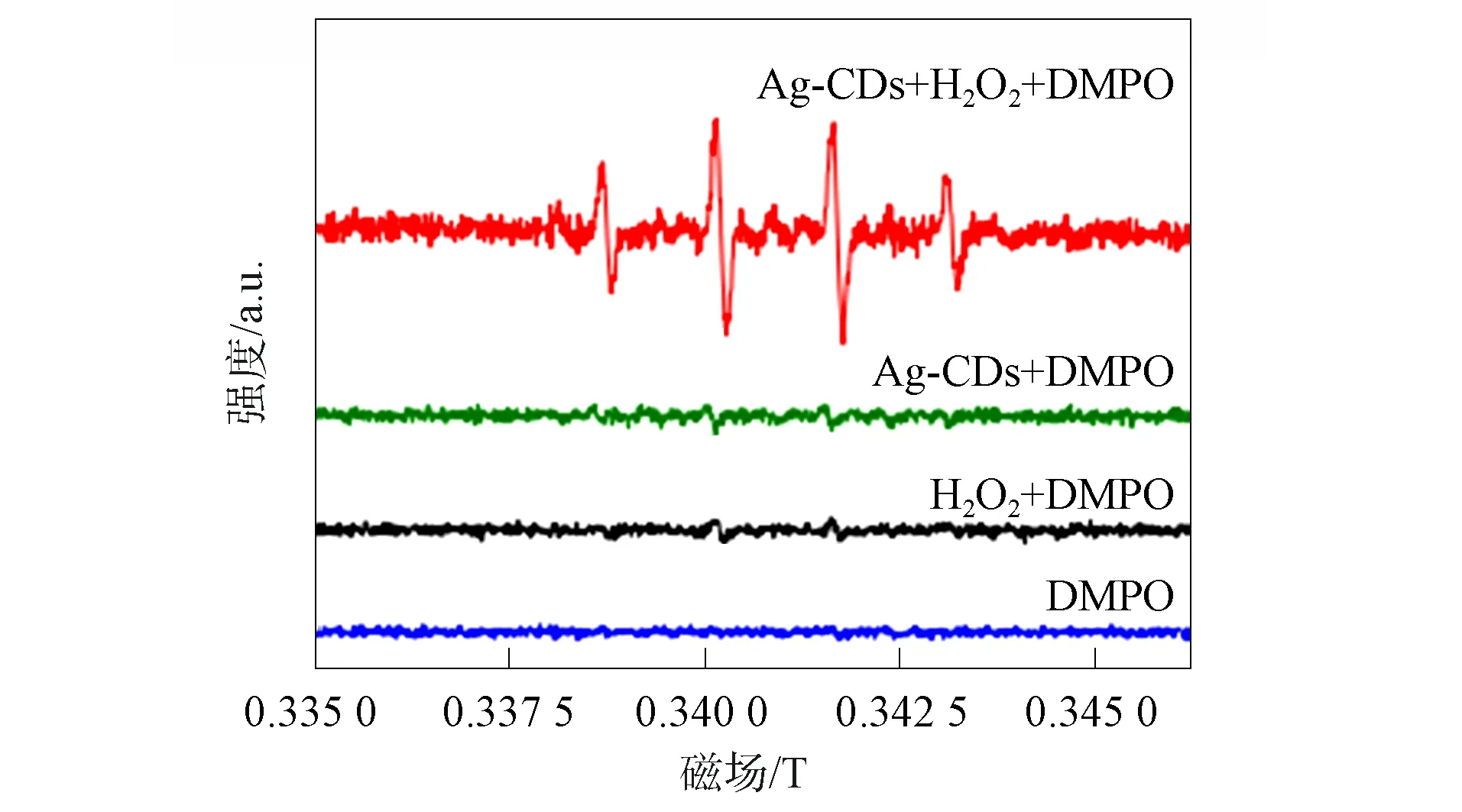
图13 不同样品中羟基自由基的ESR光谱Fig.13 ESR spectra of hydroxyl radicals in different samples
Ag-CDs纳米粒子良好的类过氧化物酶活性与电子转移增强有关[32]. CDs最低的空轨道(LUMO)高于Ag的Fermi能级. 在Ag-CDs纳米粒子中, 电子可从碳壳的LUMO能级向Ag核的Fermi能级转移. 界面上的电子进一步与过氧化氢结合, 并将过氧化氢分解为羟基自由基. 由于碳壳与Ag核间的相互作用, 因此Ag-CDs纳米粒子具有良好的类过氧化物酶催化活性. 基于Ag-CDs纳米粒子的催化性质可将其用于尿酸检测. Ag-CDs纳米粒子可促进羟基自由基氧化TMB, 加入尿酸后, 蓝色的oxTMB被还原为无色的TMB[33].
不同浓度尿酸的oxTMB紫外-可见吸收光谱和SERS光谱如图14所示. 由图14(A)可见: oxTMB的吸收峰随尿酸浓度的增加而逐渐降低, 当尿酸浓度为0.1 μmol/L时, oxTMB的吸收峰几乎没有变化; 当尿酸浓度小于5 μmol/L时, 溶液颜色没有明显变化, 灵敏度较低. 由图14(B)可见: 尿酸浓度的检测范围为0.01~500 μmol/L; 随着尿酸浓度的增加, oxTMB的SERS信号逐渐降低, 当尿酸浓度为0.01 μmol/L时, SERS信号强度仍变化明显.

图14 不同浓度尿酸的oxTMB紫外-可见吸收光谱(A)和SERS光谱(B)Fig.14 UV-Vis absorption spectra (A) and SERS spectra (B) of oxTMB with different concentrations of uric acid
oxTMB在1 605 cm-1处的SERS信号强度与尿酸浓度的关系如图15所示. 由图15可见: 当尿酸浓度为0.01~100 μmol/L时, oxTMB在1 605 cm-1处信号峰强度随尿酸浓度显著变化; 当尿酸浓度为1~25 μmol/L时, SERS信号强度随尿酸浓度呈线性变化. 因此用SERS光谱检测可提高检测灵敏度. 为测试尿酸检测的选择性, 用其他干扰物质代替尿酸检测oxTMB的SERS信号变化, 结果如图16所示, 其中干扰物质包括在血液和尿液中含量较高的NaCl、 KCl、 葡萄糖、 草酸和尿酸. 由图16可见, 干扰物质未使SERS信号发生明显变化, 表明用SERS光谱检测尿酸具有良好的选择性.

图15 oxTMB在1 605 cm-1处的SERS 信号强度与尿酸浓度的关系Fig.15 Relationship between SERS signal intensity of oxTMB at 1 605 cm-1 and concentration of uric acid
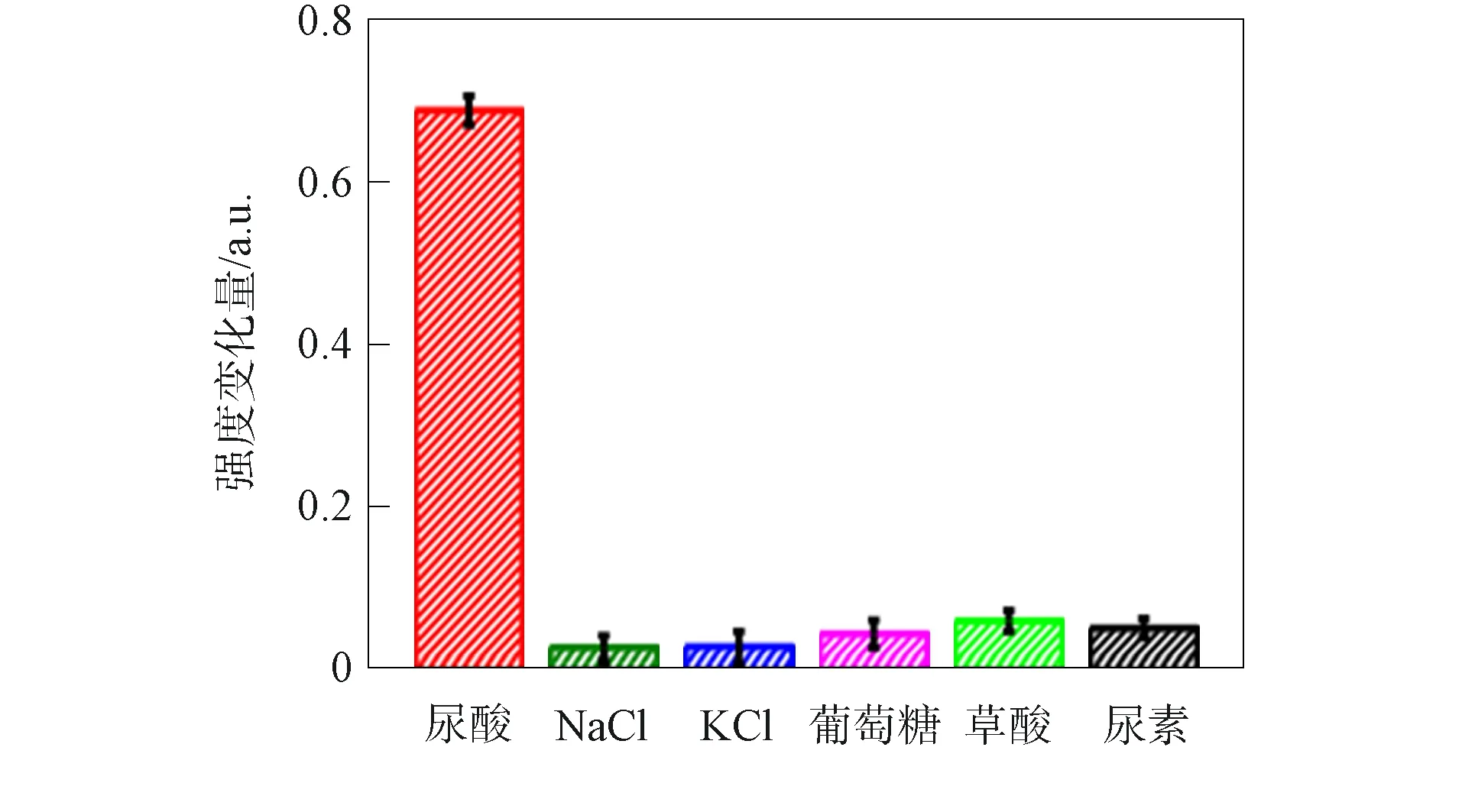
图16 在尿酸及其他物质作用下oxTMB 的SERS信号强度变化Fig.16 Changes of SERS signal intensity of oxTMB under action of uric acid and other substances
综上, 本文以CDs为还原剂制备了具有良好SERS活性和类过氧化物酶催化活性的核壳结构Ag-CDs纳米粒子. 采用三维有效差分时域法研究了Ag-CDs纳米粒子的SERS增强机理, 并通过TMB的氧化实验研究了Ag-CDs纳米粒子的催化活性. 由于尿酸可将蓝色的oxTMB还原为无色的TMB, 因此可用比色法协同SERS光谱检测尿酸, 该协同检测方法具有检测限低、 检测范围广和检测精度高等优点.
